胃癌误诊为环状胰腺并胰腺炎并十二指肠梗阻1例
黎聪聪 曾安祥
1 广东医科大学(湛江 524023)
2 梅州市人民医院(梅州 514000)
环状胰腺(annular pancreas,AP)作为罕见的先天性疾病,其症状与成人各种消化道疾病相似,胃癌是常见的消化道恶性肿瘤,通过胃镜及活组织检查(活检)病理、腹部CT等影像学检查可以明确诊断。然而,以骨转移作为首发症状的胃癌在临床上并不多。本次报告重点探讨1例胃癌误诊为环状胰腺并胰腺炎并十二指肠梗阻的原因和治疗。
1 病例资料
患者,男性,46岁,因“发现右输尿管狭窄1年余”于2019年11月1日收住入院。患者曾因“腹胀、呕吐2月”2018年入住我院并诊断为:①环状胰腺并胰腺炎;②十二指肠降段狭窄并梗阻;③先天性肠旋转不良;④胆囊泥沙样结石等。经多学科综合会诊后考虑患者反复腹胀、呕吐为环状胰腺并胰腺炎并十二指肠降段狭窄梗阻、先天性肠旋转不良所致,反复住院保守治疗效果欠佳,后于2018年4月10日插管全身麻醉下行完全腹腔镜下胃空肠吻合+Braun吻合术。2018年8月27日因“胃空肠吻合口输出袢空肠穿孔”行全身麻醉下“腹腔镜探查:空肠穿孔修补术”。2018年9月17日因“右输尿管上段狭窄并右肾积水”行全身麻醉下“右输尿管狭窄扩张+内支架置入术”,2018年12月25日返院行“右输尿管内支架拔除术”。患者因术后1年拟复查且近期有反酸、呕吐、解黑便症状(门诊病历提及)于2019年10月31日来我院胃肠外科门诊就诊,查血常规:白细胞13.1×109/L,中性粒细胞比率81.8%,红细胞4.54×1012/L,血红蛋白109 g/L。血淀粉酶188.7 U/L。粪便常规+潜血:颜色褐色,隐血(粪便)+++。上腹部CT增强:胃-空肠术后改变同前,吻合口未见异常,空肠-空肠吻合口未见异常,建议随诊复查;胆囊仍稍增厚,拟慢性胆囊炎改变,请结合临床;肝内和肝外胆管以及胰管的轻度扩张与之前相似;环形胰腺较前相仿;肝右叶前上段钙化灶及肝内多发小囊肿同前;胃周、胰周、肝门区、腹主动脉旁多发小淋巴结较前相仿;附见:右肾萎缩同前,右肾积液较前明显。患者为进一步诊治“右肾萎缩并右肾积液”入住我院泌尿外科。
入院体格检查:体温36.6 ℃,脉搏76 次/分,呼吸18 次/分,血压101/62 mmHg(1 mmHg=0.133 kPa)。神志清楚,查体合作。心率76 次/分,节律正常,无明显额外心音。其余体格检查正常,生理反射存在,病理反射未引出。
入院后查:血生化:碱性磷酸酶225 U/L,谷酰转肽酶348 U/L,尿素氮8.31 mmol/L,肌酐114.4 μmol/L。凝血四项正常。核素肾显像:①左肾形态、大小正常,皮质显影清晰,右肾区较大放射性稀疏缺损区,考虑积液所致,请结合临床;②左肾排泄欠畅,左侧肾小球滤过功能呈代偿性增高,右侧肾小球滤过功能重度受损[肾小球滤过率(GFR):左侧70.62 mL/min,右侧11.33 mL/min。肾显影面积:左侧91.35 cm2,右侧62.46 cm2]。上腹部MRI平扫+增强:胃-空肠呈吻合术后改变,所示胃-空肠吻合口及空肠-空肠吻合口区未见明确异常;环状胰腺,拟并胰腺炎,邻近十二指肠降段炎性水肿改变,伴低位梗阻性胆系扩张、胰管扩张较前稍明显;胆囊胆汁淤积,胆囊泥沙样结石较前不明显;附见:右肾重度积液,右肾实质受压菲薄;双肾小囊肿。2019年11月6日行“右输尿管支架置入术”。患者上腹部MRI提示环状胰腺并胰腺炎、低位梗阻性胆系扩张、胰管扩张,经肝胆外科会诊有手术指征(图1),患者家属同意后转至肝胆外科,完善胃镜:慢性胃炎伴胆汁反流(图2)。肠镜:①大肠多发息肉;②内痔。术前复查血常规:白细胞5.2×109/L,中性粒细胞比率57.7%,红细胞 3.55×1012/L,血红蛋白83 g/L。血生化:钙2.04 mmol/L,谷丙转氨酶69 U/L,碱性磷酸酶345 U/L,谷酰转肽酶 454 U/L,总胆汁酸 17.7 μmol/L,肌酐 112.1 μmol/L。于2019-11-13行插管全身麻醉下“肠粘连松解术+胰十二指肠根治性切除术”。术后病理:whipple术标本(含有胰头及其钩突、空肠近端、原胃空肠吻合、十二指肠、胃远端及胆囊、胆总管):胃窦低分化腺癌,Lauren分型:弥漫型。浸润全层并侵透浆膜,侵及十二指肠壁全层及胰腺、原胃空肠吻合口。查见大量脉管内癌栓及神经侵犯。空肠近端、肠肠吻合口、胆囊及胆总管未见癌侵及。另见:慢性胆囊炎,胆石症。免疫组织化学:CK20(-),CK7(+),CK5/6(-),CD56(部分+),CgA(+),Syn(部分+),S100(-),SMA(-),Ki67(约5%+)。后患者诉右侧腰腿部疼痛,完善磁共振:腰5椎体及右侧附件、骶1~4椎体及双侧附件、双侧髂骨翼、坐骨以及股骨粗隆,右侧耻骨联合、耻骨多发异常信号,结合病史,考虑骨转移瘤,建议增强扫描;所示胸腰骶椎弥漫骨质信号异常改变,考虑血液系统相关疾病所致可能性大;腰椎退行性变:腰3/4、腰4/5椎间盘膨出;膀胱壁增厚,考虑慢性膀胱炎;盆腔少量积液。予加强镇痛治疗后出院。
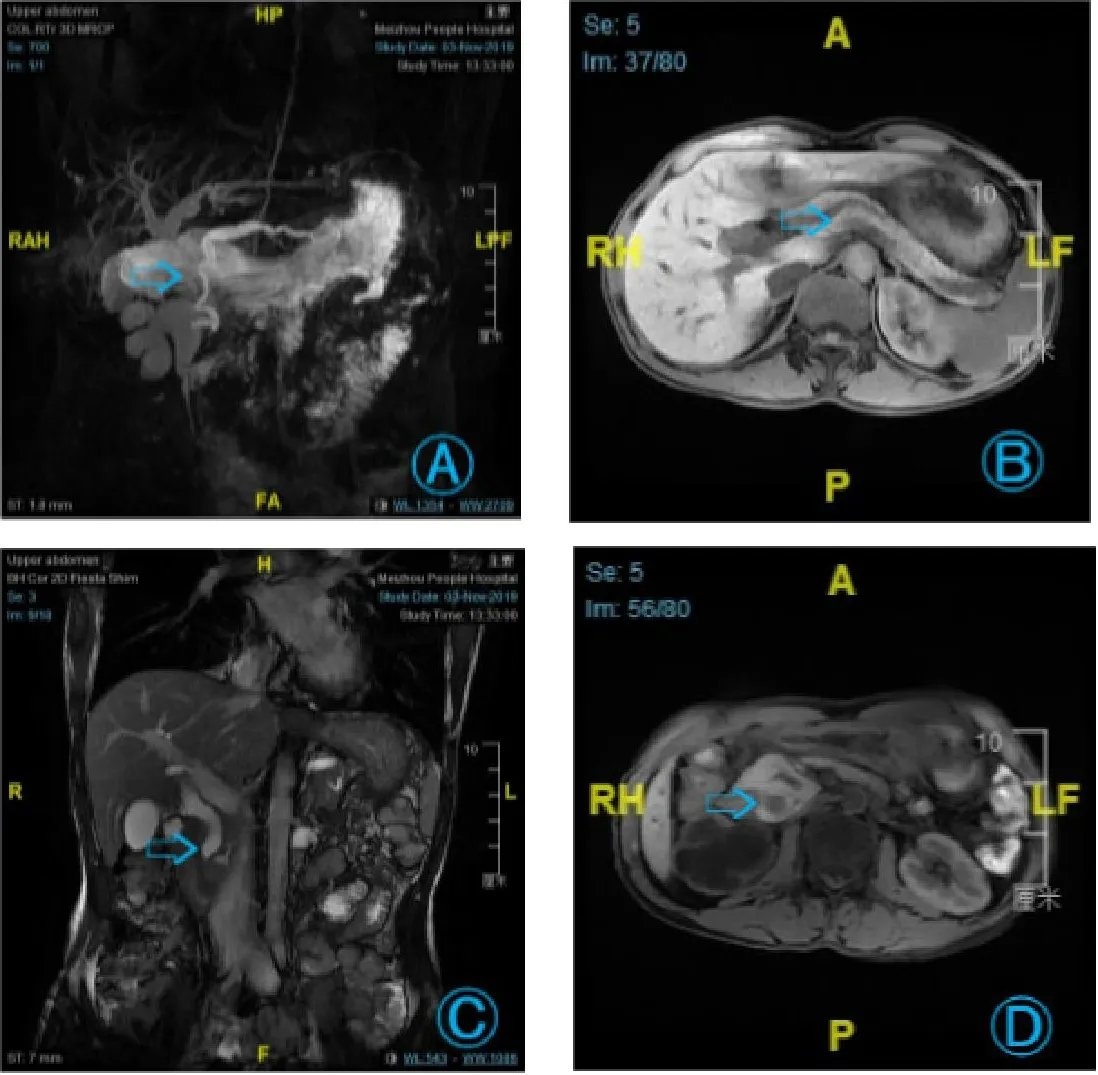
图1 术前上腹部MRI

图2 术前胃镜
出院诊断:1、胃窦低分化腺癌并侵犯胰腺、十二指肠(pT4N0M1 IV期);2、全身多发骨转移;3、胆囊结石并慢性胆囊炎;4、右肾积液萎缩并右输尿管狭窄;5、胃空肠吻合术后。
术后患者择期至肿瘤内科行8次“SOX”方案化疗及唑来膦酸预防骨不良事件发生,完善癌胚抗原、糖类抗原19-9提示升高明显(表1及图3),后患者反复出现腰骶部爆发痛,予吗啡、羟考酮缓释片止痛治疗后效果欠佳,经放疗科会诊建议可行局部减症放疗,于2020年8月20日开始放疗,方案:PGTVDT30Gy/10F,正常组织剂量在安全范围内,照射范围为肿瘤转移灶(图4)。至2020年11月5日后患者未再次我院就诊。
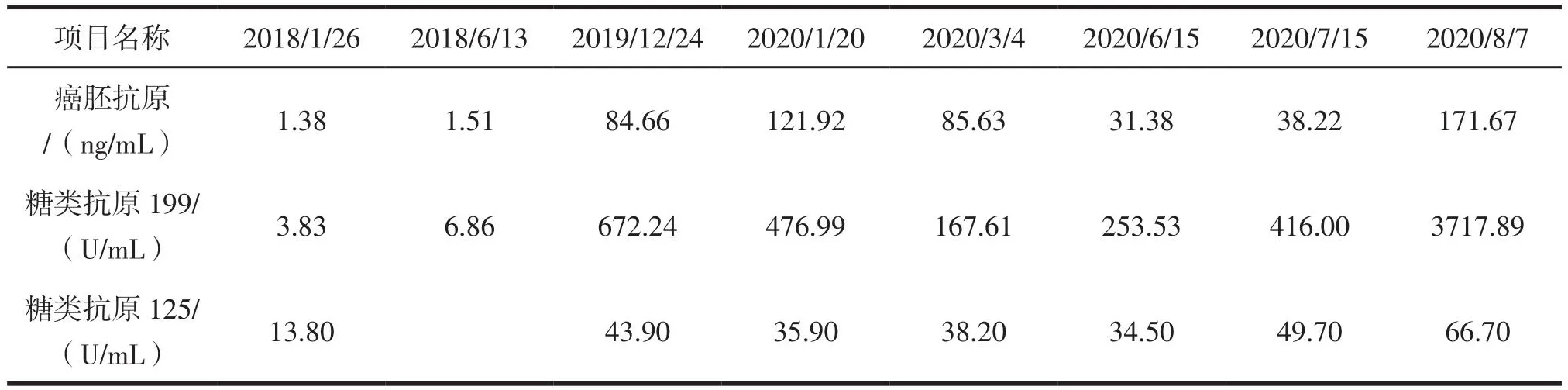
表1 肿瘤标志物
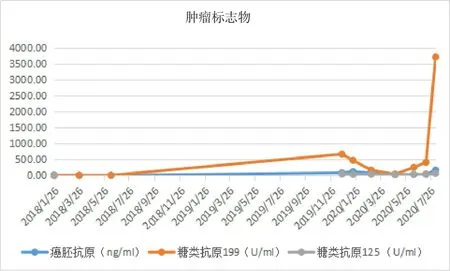
图3 肿瘤标志物

图4 术后化疗前PET-CT
2 讨 论
2.1 环状胰腺
环状胰腺是一种罕见的因胚胎时期胰芽融合异常而导致的胰腺先天性畸形,以胰腺组织全部或部分环绕十二指肠降段为特征[2]。在1818 年由Tiedman 在尸检时首次发现,1862年由Ecker正式命名其为环状胰腺,1905 年,Vidal 首次成功给1例因AP引起的十二指肠梗阻的新生儿进行十二指肠侧侧吻合术[1-2]。
目前,据外国学者通过尸检结果进行统计,AP的发病率约为5/100 000~15/100 000之间[3]。临床上根据发病年龄及诊断时间将其分为新生儿型和成人型 AP[2]。由于胰腺的异常发育在胚胎期已经发生,在新生儿和婴儿中,环状胰腺的诊断率相对较高,因为呕吐症状明显。成人多以消化道症状、胰腺炎、十二指肠梗阻、胆道疾病等合并症而发病,甚至一些成年人没有明显的症状,由于偶然的医学影像学发现,因此相对诊断率很低[2,4]。来自我国一项单中心病例回顾性研究发现,AP多见于新生儿,更好发于男性,大部分在出生后1周内发病,且常伴有其他先天性异常,如先天性心脏病、肠道旋转不良、肛门闭锁、Meckel 憩室、唐氏综合征等,并都进行外科手术干预后效果可[5]。
目前,环状胰腺的诊断主要依靠先进的医学影像学检查。影像学检查在诊断 AP 方面有重要作用,腹部影像学检查见胰腺组织包绕十二指肠降段即可确诊 AP,腹部平片及消化道造影是通过对梗阻部位的位置和形状的观察间接提示诊断,但其X线表现与新生儿的十二指肠梗阻性疾病有很大的交叉,其特异性较差,病因诊断价值不高[6],CT、MRI、内镜超声和ERCP可显示十二指肠周围胰腺组织的直接征象。CT可见胰腺组织延伸到十二指肠前后,与十二指肠附近组织形成锐角,称为“鳄鱼颚征”,是环状胰腺在CT上的一种特殊表现[7]。而MRCP 和 ERCP 均可显示主副胰管走行及环状胆管的解剖结构[2,8]。但因症状和体征可能与其他上消化道疾病相似,包括十二指肠闭锁、十二指肠蹼和十二指肠旁疝等,且部分AP患者和伴有其他畸形的患者没有典型症状,故仍有40%的环状胰腺患者需要首选腹腔镜探查确认诊断[9-10]。
手术是 AP的首选治疗方法,但只有临床症状明显时才需要手术,其目的是解除梗阻、重建消化道、保持吻合口畅通、保持消化道的完整性。十二指肠侧侧吻合术是新生儿患者的首选,具有保持消化道连续性、捷径短和符合生理性的优点。无症状的成人AP无需特殊治疗,但多数患者常因胃十二指肠流出道梗阻、消化性溃疡等合并症而需手术治疗,通常建议十二指肠-空肠或胃-空肠吻合术。这种术式更具生理性,可避免胰液和胆汁反流到胃内,从而避免形成碱性反流性胃炎[11-12]。
2.2 胃癌并骨转移
近年来,胃癌是中国最常见的消化系统恶性肿瘤之一。据统计胃癌均占我国肿瘤发病谱及肿瘤死因谱的第3位[13-15]。根据国际癌症研究机构的统计,2020年,全球新增胃癌病例数量在恶性肿瘤病例数中排名第五,约108.9万例。2020年全球因胃癌死亡人数位居恶性肿瘤死亡人数的第四位,约76.9万例。其中43.9% 发病病例和48.6% 死亡病例发生在中国[16],因此中国胃癌抗癌道路任重道远。
胃癌常见的临床表现主要以腹痛、食欲不振、消化不良、黑便、无诱因体质量下降或可触及上腹部包块、Virchow淋巴结等。胃癌的主要转移方式为直接浸润、淋巴结转移、血行转移及腹腔种植转移。淋巴结、肝脏、腹膜和肺是胃癌的常见转移部位,骨转移的概率较低。
胃癌根据疾病发展的时间分为早期胃癌和进展期胃癌,进展期胃癌按目前国际上广泛采用的Borrmann分型法可分为I型(结节型)、II型(溃疡局限型)、III型(溃疡浸润型)、IV(弥漫浸润型),其中Borrmann IV型病变位于黏膜下层,在肿瘤细胞之间常间隔有大量纤维成分,病变胃壁广泛增厚变硬呈皮革状,难以确定肿瘤边界,且内镜下表面黏膜变化不明显,常因内镜医师识别肿瘤困难或取材不满意而漏诊[17],且该型病变恶性程度高,容易发生早期转移,预后极差,诊断较其他3型困难。根据Lauren分型分类,胃癌分为:肠型、弥漫型和混合型。肠型具有分化好、恶性程度低、预后好的特点;而弥漫型则表现为分化差、易出现淋巴结转移和远处转移,预后较差[18]。
与肺癌、前列腺癌、乳腺癌这些易发现骨转移癌症病种有所不同的是,在胃癌的初步诊断、治疗和随访中,美国国立综合癌症网络指南和其他相关国际指南未推荐评估骨转移。结合国内外有关研究显示胃癌骨转移发生率约为0.8%~10.1%,其中约 28.0%~34.9% 同时存在胃癌和骨转移,且国内一项多中心研究显示确诊胃癌骨转移患者中,只有骨转移而没有其他部位转移者仅占4.3%[19-21]。而以骨转移为初始临床表现的胃癌发生率较低,约为0.46%[22]。
国内外相关研究显示早期出现胃癌骨转移的高危因素包括:年轻患者、男性、低分化腺癌或印戒细胞癌、原发灶位于胃体部或胃窦部、肿瘤浸润深度为T3或T4等[19,23]。胃癌骨转移最常见的部位是脊柱,其中胸腰椎转移占90.6%,其次为骨盆和肋骨以及股骨、肱骨等。胃癌骨转移主要为溶骨性转移,其次为混合性,较少出现成骨性转移,且往往合并乳酸脱氢酶、碱性磷酸酶、血钙及癌胚抗原的升高[24]。转移性胃癌生存期短、预后差,而胃癌骨转移患者预后更差,诊断为骨转移后,平均生存时间仅为5.8个月,骨转移可导致骨强度下降,尤其是当发生溶骨性破坏时,患者可能出现骨痛、病理性骨折、脊髓压迫或截瘫等症状,可在出现并发症前骨手术干预以提高患者生存时间或局部骨放疗、双磷酸盐等药物减轻骨痛症状,改善生存质量[21]。
3 结 论
本例患者既往有反复腹胀及呕吐症状,经相关检查后考虑环状胰腺并胰腺炎并十二指肠降段狭窄梗阻、先天性肠旋转不良所致,手术治疗后症状缓解,此次因上腹部MRI提示环状胰腺并胰腺炎、低位梗阻性胆系扩张、胰管扩张,经肝胆外科会诊建议手术治疗,门诊病历提及患者入院前近期出现反酸、呕吐、解黑便症状,入院后病程记录未提及明显上消化道症状,术前上腹部CT增强、上腹部MRI增强均未提示胃癌影像学改变,且胃镜下胃体、胃窦黏膜光滑,无明显结节、溃疡、糜烂改变,仅仅提示胆汁反流,病理证实为胃窦低分化腺癌,Lauren分型:弥漫型,浸润全层并侵透浆膜,侵及十二指肠壁全层及胰腺、原胃空肠吻合口,术后复查上下腹CT仍未有进一步提示,后续患者诉右侧腰腿部疼痛,完善腰椎MRI检查最终明确有多发骨转移,脊柱、坐骨、股骨等骨骼均有累及,而后患者至肿瘤内科进行化疗前完善PET-CT提示全身多发骨转移。
胃癌骨转移的发病率低,本例患者术前CT、MRI、胃镜均未提示胃癌病变表现,加上临床症状不典型,术后脊柱MRI进一步检查才发现骨转移的更为少见,加上与肺癌、前列腺癌等这些易出现骨转移的癌症病种不同,在整个胃癌的诊治随访过程中,极少进行骨转移评估,这也导致我们临床医生往往不够重视患者的其他系统的表现,就像本例术前病程记录中未提及全身骨痛情况,术后病理结果回报后数天病程记录中才提及患者诉有右侧腰腿部疼痛,患者术前伴有碱性磷酸酶升高,且患者为年轻男性,虽既往住院查癌胚抗原、糖类抗原19-9均正常,但此次住院未查相关癌胚抗原指标,患者后续至肿瘤内科住院化疗时查癌胚抗原、糖类抗原19-9已明显升高,术前影像学检查仅提示有环状胰腺胰腺炎、十二指肠炎性水肿及胆系、胰管扩张,无胃癌表现,加上患者出现反酸、呕吐这些不典型上消化道症状,也让临床医生出于惯性考虑为既往疾病引起,因此作为消化专科临床医生,要细致询问患者全身情况,不能单纯关注消化专科症状,更不能被既往史所蒙蔽双眼,要善于发现患者出现的其他症状并及时记录,当检测结果提到血清碱性磷酸酶、乳酸脱氢酶和癌胚抗原升高时,应筛查患者是否出现骨转移。本例患者虽最终明确诊断为胃癌,但病理提示分化差,合并全身多处骨转移,疾病进展迅速,后续放化疗效果欠佳。
综上所述,胃癌骨转移的发病率低,极少进行骨转移评估,易造成误诊。当出现胃十二指肠流出道梗阻时,虽患者合并环状胰腺,仍需警惕胃癌的可能,及早完善全身检查,明确诊断,尽早行抗肿瘤等积极的治疗措施可延长患者生存时间及改善患者生存质量。 早期诊断、早期治疗是改善胃癌患者预后的关键。

