蒜芥茄PR-10基因的克隆与表达分析
程捷 张涵雪 蔚亚楠 尹梦莹 董相书 吴丽艳 杜光辉

关键词:蒜芥茄;PR10蛋白;基因克隆;表达分析
病程相关蛋白(pathogenesisrelatedproteins,PRs)是植物受生物或非生物胁迫后诱导产生并积累的一类蛋白质总称。PR蛋白主要分为17个亚类[1],广泛存在于单子叶和双子叶植物中。部分PR蛋白(PR2、PR3、PR4、PR8)具有几丁质酶或葡聚糖酶的活性,对于真菌有一定抑制性[2]。而PR10具有核糖核酸酶活性,可以裂解入侵病毒的RNA,在植物抗病毒途径中发挥着重要作用[3]。除此之外,PR10对植物的生长、发育和衰老也有一定作用[4]。PR10基因受多种激素诱导表达,如JA、SA、ABA、GA3,也受部分病原体或冷害、干旱等非生物胁迫的诱导表达,一些外源物质H2O2、CuCl2也可以诱导PR10基因的表达[5];PR10在植物不同组织器官中的表达量也不同,如,PR10基因在大豆的根、茎及叶中均有表达,其中叶部表达最高[6]。多个研究表明,PR10蛋白是分子量为16~19kDa,等电点偏酸性的小分子量蛋白;该蛋白作为一种胞内蛋白,一般定位在细胞质中[7-9]。PR10蛋白可分为特异性细胞因子结合蛋白和乳胶蛋白两大类[10]。虽然,PR10蛋白参与植物抗病相关途径的调控,但PR10受各种因素诱导表达的机制尚不明确;PR10蛋白具有核酸酶活性和体外抑菌的特性,但其如何抵御病菌的侵害也有待揭示。
黄萎病是影响茄子产量、由轮枝菌(Verticilliumspp.)引起的一种土传病害,发病快、危害面积广。有研究表明,PR10蛋白具有高效的抗真菌作用[11],对轮枝菌也表现出一定的抗性。例如,棉花的GaPR10基因在受到大丽轮枝菌(Verticilliumdahliae)侵染时,表达水平显著增高,该基因可能参与了相应的防御反应[12-13];ZANDVAKILI等[14]发现玉米PR10蛋白有良好的体外抗真菌活性,在接种了黄萎病病菌、菌核病菌等4种真菌后,PR10蛋白均可不同程度地抑制其孢子萌发和菌丝生长。并且,PR10基因对烟草花叶病毒(TMV)也表现出很高的抗性,辣椒CaPR10[3]、刺茄SsPR10[4]与烟草NtPR10[15]基因在TMV侵染过程中表达水平显著上调,有很好的抗TMV的作用。除此之外,PR10蛋白对疫霉菌[3]、稻瘟病菌[4]、青霉菌[16]等多种病菌都表现出一定的抑制作用,在植物抗病方面发挥重大作用。
蒜芥茄(SolanumsisymbriifoliumLam.),為茄科、茄属植物,一年生草本,属于野生茄的一种。蒜芥茄由于长期在野外生存,具有良好的抗逆性,研究表明,蒜芥茄是黄萎病的高抗材料[17]。本研究在前期建立的蒜芥茄转录组数据库[18]的基础上,通过RT-PCR技术,从蒜芥茄中克隆获得病程相关蛋白PR-10基因,即SsPR-10。并对该基因进行生物信息学分析及预测,利用荧光定量PCR技术检测SsPR-10基因在蒜芥茄不同器官的表达特性以及接种黄萎病病菌后表达水平的变化,对蒜芥茄SsPR-10基因应对生物胁迫的表达机制提供一定的理论基础,有助于进一步开发利用蒜芥茄优良的抗病性状。
1材料与方法
1.1材料
供试材料野生蒜芥茄由云南省农业科学院园艺作物研究所提供。将蒜芥茄种子用500mg/L的赤霉素(GA3)溶液催芽24h,待种子露白转移到育苗基质,取成熟期的根、茎、叶进行混样,作为基因克隆和表达分析材料;待第一片真叶完全展开时用大丽轮枝菌菌株QZ-S(V.dahliaeKleb.)接种,接菌后0、24、48、72h取叶片进行RNA提取,用于目的基因表达分析。
1.2方法
1.2.1SsPR-10基因克隆采用PlantRNAKit试剂盒(Omega,美国)提取蒜芥茄不同器官(根、茎、叶)的RNA,并用分光光度计检测RNA的纯度。再采用5×all-In-OneRTMasterMix(withAccuRTGenomicDNARemovalKit)试剂盒(ABM,加拿大)将RNA反转录为cDNA,具体操作按试剂盒说明书进行。利用PrimerPremier5.0软件设计引物(F:AAAGGCAAATACTAATCAAAC;R:AGAAAACACACAACAAAAAAC),以cDNA为模板,进行目的基因ORF的扩增,引物合成委托昆明擎科生物科技有限公司进行。PCR扩增体系(25μL)为:cDNA1μL,10μmol/L的正反引物各1μL,ddH2O12μL,EsTaqMasterMix(Dye)10μL。反应程序为:95℃预变性5min,94℃变性30s,54℃退火30s,72℃延伸2min,35个循环后72℃延伸10min,4℃保存。取5μL的PCR产物在1.0%琼脂糖凝胶电泳进行检测,将目的基因条带进行回收后送昆明擎科生物科技有限公司进行测序,将测序结果应用DNAMAN软件进行序列比对。通过NCBI在线网站的ORFFinder程序(https://www.ncbi.nlm.nih.gov/orffinder/)对SsPR-10进行开放阅读框预测。
1.2.2生物信息分析及系统进化树构建利用ExPasy在线ProtParam软件(http://www.expasy.org/tools/protparam.html)对SsPR-10蛋白氨基酸的理化性质、亲水性、稳定性等进行预测;使用ProtScale(https://web.expasy.org/cgi-bin/protscale/protscale.pl)对亲水性进行进一步分析。分别用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)、SWISS-MODEL(https://swissmodel.expasy.org/)在线网站分析SsPR-10蛋白的二、三级结构,再用Cell-PLoc2.0在线网站(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)预测SsPR-10的亚细胞定位。使用推定的ORF序列在网站NetPhos(http://www.cbs.dtu.dk/services/NetPhos/)中预测SsPR-10蛋白的磷酸化位点。在TMHMM2.0在线软件(http://www.cbs.dtu.dk/services/TMHMM-2.0/)上预测Ss-PR-10蛋白的跨膜区;利用InterProScan在线网站(http://www.ebi.ac.uk/cgi-bin/iprscan/)对SsPR-10蛋白进行保守结构域分析预测。利用NCBI数据库Blast工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对SsPR-10蛋白的氨基酸序列进行同源序列比对,并选取相似度高的蛋白序列应用DNAMAN软件进行序列比对分析,再使用MEGA软件利用邻接法(neighbor-joining,NJ),构建系统进化树。
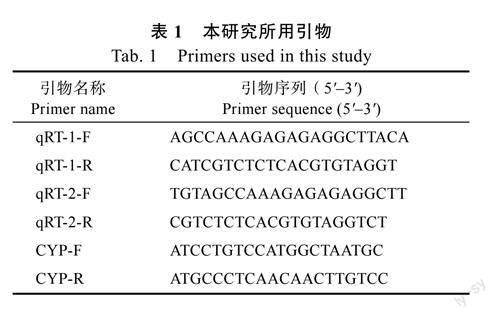
1.2.3基因表达分析应用实时荧光定量PCR(RT-qPCR)技术对SsPR-10基因在蒜芥茄不同器官中的表达进行分析。引物设计通过PrimerPremier5.0软件进行,以CYP为内参基因(表1)。对蒜芥茄接种大丽轮枝菌,并在一定时间内(0、24、48h)测定SsPR-10基因的表达,以无菌水处理为对照,具体接种方法参照吴丽艳等[19]进行。试剂盒选用MonAmpTMSYBR?GreebqPCRMix(LowRox)(莫纳生物科技有限公司),具体操作按照试剂盒说明书进行。通过实时荧光定量PCR仪进行试验,每个样品设置3次重复。PCR反应体系如下:MonAmpTMSYBR?GreebqPCRMix10μL,cDNA溶液1μL,正向引物及反向引物各0.8μL,ddH2O7.4μL,共20μL。PCR扩增程序:95℃预变性2min,继续95℃变性10s,55℃退火15s,72℃延伸15s,35个循环,72℃终延伸5min。
2结果与分析
2.1SsPR-10基因的克隆与ORF序列分析
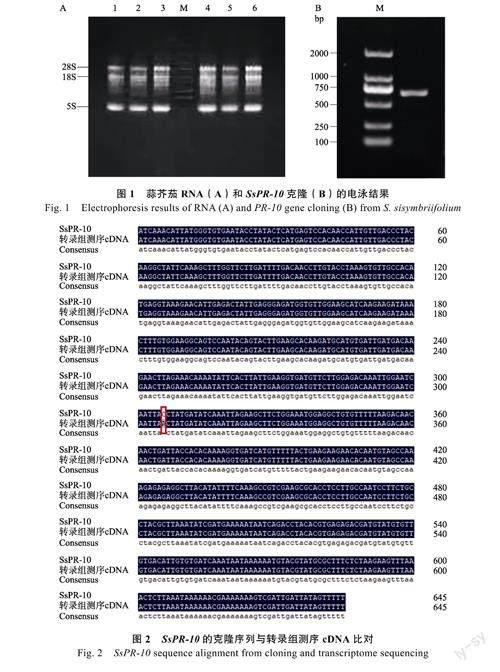
以蒜芥茄为材料,提取RNA(图1A),反转录后获得cDNA。以cDNA为模板进行PCR扩增,得到与预期长度符合的PR10基因(图1B)。测序后,获得基因序列,全长645bp,命名为SsPR-10。将克隆得到的SsPR-10基因与转录组测序的cDNA序列进行比对,相似度为99.85%,其中只有1个碱基变异(图2)。以测序结果为准,利用NCBI的ORFFinder基因开放阅读框分析工具进行预测,结果显示开放阅读框为480bp,共编码159个氨基酸(图3)。
2.2SsPR-10基因的生物信息学分析
2.2.1SsPR-10蛋白理化特性预测利用在线网站ProtParam对SsPR-10进行分析,结果表明SsPR-10编码的蛋白分子式为C794H1247N207O245S3,总分子量17.71kDa,共编码159个氨基酸,其中带正電荷残基数(Arg+Lys)17个,带负电荷残基数(Asp+Glu)25个,理论等电点为5.54,推测该蛋白为酸性蛋白;不稳定系数(II)为34.34,小于40;该蛋白的亲水性平均值(GRAVY)为–0.325,为亲水性蛋白。在ProtScale程序中,对该蛋白的亲疏水性进一步分析(图4),第23位亮氨酸的疏水性最高为1.733,第122位苏氨酸亲水性最高为–2.267。总体来看,疏水区主要集中在前部,亲水区集中在中部、后部,预测该蛋白为亲水性蛋白。
2.2.2SsPR-10蛋白二、三级结构和亚细胞定位分析利用在线软件SOPMA进行SsPR-10蛋白质二级结构预测(图5A),结果显示SsPR-10蛋白二级结构主要由4种结构构成,分别为43.40%的α-螺旋、23.27%的β-折叠、8.81%的β-转角、24.53%的无规卷曲。在线网站SWISS-MODEL对SsPR-10的三级结构进行预测(图5B),结果显示SsPR-10的三级结构与草莓过敏原Fraa1-2的相似度达到53.16%,以6stb.1.A作为模板构建。通过Cell-PLoc2.0在线网站对SsPR-10进行亚细胞定位,结果显示SsPR-10定位在细胞质中。
2.2.3SsPR-10蛋白磷酸化位点及信号肽分析通过在线网站NetPhos对SsPR-10蛋白进行磷酸化位点的预测(磷酸化位点阈值为0.5),共预测了12个磷酸化位点(图3),第10、52、84、107位的丝氨酸;第12、99、117、122位的苏氨酸;第83、100、120位的络氨酸。信号肽预测结果显示该蛋白无信号肽。
2.2.4SsPR-10蛋白跨膜区和结构域分析利用TMHMM2.0在线软件对SsPR-10蛋白跨膜区进行分析,发现该蛋白无跨膜区(图6A)。通过InterProScan在线网站对SsPR-10蛋白进行保守结构域分析预测(图6B),发现其含有1个BetvⅠ过敏原结构域(IPR024949),其中88~120位存在局部保守序列(图3);1个START脂质结合结构域(IPR023393);1个BetvI/MLP乳胶蛋白结构域(IPR000916)。
2.2.5SsPR-10蛋白同源序列比对和系统进化分析利用NCBI在线网址中BLAST的功能检索与蒜芥茄SsPR-10蛋白序列相近的其他植物,发现SsPR-10与黄果茄(Solanumvirginianum)、马铃薯(Solanumtuberosum)、番茄(Solanumlycopersicum)、辣椒(Capsicumannuum)、烟草(Nicotianabenthamiana)等的识别度较高。再通过DNAMAN软件将SsPR-10蛋白序列和这几种植物PR10蛋白序列进行序列比对分析(图7),发现它们在位置47~52有一个保守序列,富含甘氨酸的环状结构“P-LOOP”环。
选择上述与蒜芥茄SsPR-10蛋白序列相似度较高的植物蛋白序列和SsPR-10序列进行比对(图7),运用MEGA软件构建系统进化树(图8),结果显示,蒜芥茄SsPR-10蛋白与黄果茄的PR10蛋白亲缘关系最近,其次与马铃薯的STH-2蛋白较近。
2.3SsPR-10基因的表达分析
利用RT-qPCR技术对SsPR-10基因在蒜芥茄根、茎、叶中表达情况进行分析(图9),结果显示,SsPR-10在根部表达最高,其次是叶,在茎部表达较低。
用黄萎病病菌接种蒜芥茄,对接种后0、24、48、72h的SsPR-10基因的表达情况进行分析(图10),发现接种后SsPR-10总体表达情况呈先上升后下降的趋势。当接菌24h后,SsPR-10表达水平增加了3倍左右,且达到最高水平;48h后,其表达水平明显下降且低于对照;72h后,对照组与接种病菌组中基因表达水平相差不大。
3讨论
PR10蛋白是植物病程相关蛋白家族中的第10类蛋白,因其具有一定核酸酶活性,在植物生长发育、抵御病原菌和非生物胁迫方面都有作用,并且在多种植物,如苹果[20]、大豆[6]、棉花[12]、百合[21]等中都有发现,而受广大研究者的关注。多个研究表明,PR10基因编码的氨基酸中都具有一个高度保守的GXGGXG(X是任意氨基酸)序列模型,被称为“P-LOOP”环[5,22],这一保守结构可能与PR10蛋白的磷酸化有关。PARK等[3]研究发现,辣椒CaPR10蛋白磷酸化的活性比未磷酸化的活性高约12倍,并预测了其丝氨酸、苏氨酸和酪氨酸磷酸化位点;同样,OZYIGIT等[22]预测了大豆、水稻、番茄等6种植物的PR10蛋白三级结构和它们的配体结合位点,这些结合位点上的残基有着更高程度的变异,可能形成具有不同功能、新的催化位点。
蒜芥茄作为重要的野生茄资源,其部分抗病性状比栽培茄更有优势,但对其有利基因的挖掘还不深入。目前,关于蒜芥茄抗黄萎病相关基因Ve基因与泛素结合酶(E2s)UBC基因的分子机制已经得到初步分析[17,23],而对于蒜芥茄PR-10基因的研究还未被报道。本研究通过RT-PCR技术获得蒜芥茄PR-10基因的序列,并对其进行相关生物信息学分析和表达分析。对预测的蛋白序列进行理化检测发现SsPR-10蛋白大小为17.71kDa,等电点为5.54,属于亲水性蛋白,而LIU等[4]研究刺茄SsPR10蛋白,发现其大小为17.58kDa,等电点为5.29,共编码160个氨基酸。ZHOU等[12]从棉花中分离的GaPR-10基因所编码的PR10蛋白分子量为17.3kDa,等电点为4.95,编码159个氨基酸;张弛等[9]研究了杨树PR10基因编码的蛋白,发现其分子量为17.6kDa,等电点为5.20,编码158个氨基酸,也为亲水性蛋白。以上研究结果与本研究相近,可证明PR10蛋白为小分子量(不超过20kDa)酸性亲水性蛋白。本研究预测了SsPR-10蛋白在细胞中的定位,结果显示在细胞质中,对SsPR-10进行跨膜区分析,发现SsPR-10无跨膜区;信号肽分析也表明SsPR-10无信号肽。张玉等[15]研究了烟草NtPR10蛋白的定位,发现其定位在细胞质,并对NtPR10蛋白进行了信号肽和跨膜结构域预测,发现该蛋白无信号肽和跨膜结构域;NAOKI等[24]在研究水稻PR蛋白时,也发现其定位在细胞质,这些研究结果与本研究预测蒜芥茄PR10蛋白的定位一致,而OZYIGIT等[22]对于海岛棉、王百合和藏红花的亚细胞定位结果显示PR10蛋白在叶绿体和细胞质中。这些结果表明PR10蛋白是不含信号肽的胞内蛋白。
本研究对SsPR-10以及其近缘物种进行序列比对,发现存在保守序列GXGXG(47~51位,X为任意氨基酸),称为“P-LOOP”结构,且存在结构域Bet-v1。“P-LOOP”是一个有关磷酸结合激酶以及核苷酸结合蛋白的结构域,是PR10蛋白家族的特征结构。而BetvⅠ相关蛋白家族由许多结构相关的植物过敏原组成;该结构中存在若干疏水配体结合位点,这些位点可以形成一个大的“Y”型疏水配体结合口袋,可以结合油菜素内酯(brassinolide,BR)等并起到转移极性配体的作用,可能参与到植物的病理防御作用[21]。前人研究表明,刺茄的SsPR10蛋白[4]以及辣椒的CaPR10蛋白[3]均含有保守序列GXGGXG(47~52位),与本研究结果相比较这2种蛋白在第50位多了一个甘氨酸;而马铃薯的PR10蛋白在第45~47位含有保守序列GXG[4],这与本研究结果也有一定差异。推测不同的P-LOOP模式和甘氨酸残基的位置变化可能是PR10基因进化过程中替换、缺失和插入的结果。
有研究表明,在植物的根、側根和根尖等易受机械干扰和病原菌侵袭的部位,PR10表达量会显著增加[22,25]。本研究发现SsPR-10基因在根部的表达明显高于在茎、叶的表达量,存在明显的组织特异性。在接种大丽轮枝菌24h后,蒜芥茄PR-10基因的表达量最高,相当于对照组的4~5倍;而24~48h,PR-10的表达量下降较多,SsPR-10表达水平由上调变为下调;72h后,该基因表达量与对照组相差不大。亚洲棉GaPR10基因[12]在根部有低水平的转录,而在叶片、花、茎中都不表达,也属于组成型表达;杨树PR10基因[9]与刺茄的PR10基因[4]在根系的表达量也高于叶片和茎。但是,大豆PR10基因在叶部的表达量高于茎部和根部[6]。辣椒和刺茄在接种TMV后,其PR10基因表达量均大幅增加[3-4];同样,亚洲棉用大丽轮枝菌处理后,PR10基因在12h内达到最高水平的表达,并在24h内保持高水平的表达[12],这与本研究SsPR-10响应大丽轮枝菌接种的反应相近。虽然SsPR-10在根、茎、叶等部位可以表达,但比接种病菌后其表达是明显较低的,这表明SsPR-10受到病菌诱导时,表达水平会显著上升。
4结论
本研究从蒜芥茄中克隆得到了病程相关蛋白SsPR-10基因,该基因编码区全长480bp,共编码159个氨基酸。SsPR-10蛋白无跨膜区和信号肽,属于胞内蛋白,与黄果茄PR10蛋白亲缘关系最近。蒜芥茄SsPR-10基因的表达具有组织特异性,并受大丽轮枝菌的诱导而高表达,说明SsPR-10基因可能参与蒜芥茄抗黄萎病的应答过程。

