基于网络药理学探究凉膈散对急性胰腺炎肺损伤大鼠的保护作用
葛 鹏,罗亚岚,徐秋实,许才明,张桂信,3,陈海龙*
(1.大连医科大学附属第一医院腹部急症外科,辽宁 大连 116011;2.大连医科大学附属第一医院中西医结合临床重点学科实验室,辽宁 大连 116011;3.大连医科大学中西医结合研究院,辽宁 大连 116044;4.大连市中心医院神经外科,辽宁 大连 116083)
急性胰腺炎(acute pancreatitis,AP) 是胰腺的炎性疾病,是常见的外科急症[1]。急性肺损伤(acute lung injury,ALI) 是重症AP 最常见的并发症,也是早期高死亡率的主要原因[2]。目前,亟待挖掘特异性药物阻止AP 向ALI 的发展。凉膈散出自《太平惠民和剂局方》,已被广泛应用于口腔、鼻咽及肺部炎症[3-4]。也有报道称凉膈散对AP、脓毒症及肠缺血再灌注损伤亦有积极的治疗作用[5-7]。然而,凉膈散治疗AP-ALI 的分子机制尚不明确。网络药理学是一门新兴学科,常被用于阐释中药干预疾病的分子机制。本研究旨在通过网络药理学及体内动物实验探讨凉膈散治疗AP-ALI 的分子机制。
1 材料与方法
1.1 网络药理学
1.1.1 凉膈散活性成分及靶点筛选 利用TCMSP 数据库及TCMID 数据库检索凉膈散中各中药的化合物成分,并根据药物动力学参数口服生物利用度(OB) ≥30%、类药性(DL) ≥0.18 为标准筛选活性成分及靶点,利用Unitprot数据库标准化靶点基因名,应用Cytoscape 3.7.2 软件构建成分-靶点网络。
1.1.2 AP-ALI 靶点筛选及网络构建 以 “acute pancreatitis” “acute lung injury” 为关键词,通过GeneCards数据库和DisGeNET 数据库检索与AP 和ALI 相关的疾病靶点,采用韦恩图获得凉膈散与AP-ALI 的交集靶点。利用Cytoscape 软件进一步筛选并构建成分-靶点网络。
1.1.3 PPI 网络构建及关键成分分析 利用STRING 数据库构建PPI 网络。将结果导入Cytoscape 软件后使用MCODE 插件筛选主要成分及关键靶点。
1.1.4 GO 功能及KEGG 通路分析 借助Metascape 数据库对关键靶点进行GO 和KEGG 分析,获得关键靶点参与的生物学过程及相关通路。
1.1.5 分子对接 通过PubChem 数据库下载化合物结构,使用AutodockTools 1.5.6 软件对化合物及靶点分别进行加氢、去水、计算电荷等处理,并利用Autodock Vina 1.1.2软件对接处理后的配体与受体,最后使用PyMOL 软件可视化主要活性成分和关键靶标对接结果。
1.2 动物实验
1.2.1 凉膈散制备 凉膈散由连翘15 g,黄芩、栀子、竹叶各10 g,甘草9 g,大黄、芒硝各12 g,薄荷10 g (后下)组成,购于大连同仁堂药房,经大连医科大学附属第一医院普外三科许才明医师鉴定为正品。每1 剂加水煎煮浓缩至192 mL,分2 次灌胃。
1.2.2 动物分组、造模和给药 30 只SPF 级雄性SD 大鼠,体质量(200±20) g,购于大连医科大学SPF 动物实验中心[实验动物生产许可证号SCXK (辽) 2018-0003,实验动物使用许可证号SYXK (辽) 2018-0007],动物实验经大连医科大学动物伦理委员会审查批准 (伦理号AEE19003)。大鼠随机分成对照组、模型组、凉膈散组,每组10 只。对照组仅作开腹、翻动胰腺数次后关腹处理;模型组采用胰胆管逆行注射5% 牛磺胆酸钠(50 mg/kg)的方法建立AP-ALI 模型[8];凉膈散组于造模后2、12 h 灌胃给予凉膈散(剂量为10 g/kg,质量浓度为0.46 g/mL)。
1.2.3 试剂与仪器 苏木素-伊红(HE) 染色试剂盒[生工生物工程(上海) 股份有限公司];大鼠白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH) 试剂盒(货号E-EL-R0015c、EEL-R2856c、E-BC-K025-M、E-BC-K030-M,武汉伊莱瑞特生物科技股份有限公司);髓过氧化物酶(myeloperoxidase,MPO) 试剂盒(货号A044-1-1,南京建成生物工程研究所);兔抗大鼠β-actin 抗体(货号AP0060,南京巴傲得生物科技有限公司);兔抗前列腺素内过氧化物合酶2(PTGS2)、兔抗肿瘤蛋白P53、兔抗血红素加氧酶1 (HO-1)抗体(货号A1253、A19585、A19062,武汉爱博泰克生物科技有限公司);切割型半胱氨酸天冬氨酸蛋白水解酶-3(cleaved caspase-3) 抗体 (货号ab2302,英国Abcam 公司);TUNEL 试剂盒(批号G1501-50T,武汉赛维尔生物科技有限公司)。石蜡切片机(德国徕卡公司);酶标仪(美国Thermo Fisher Scientific 公司)。
1.2.4 标本采集 造模24 h 后,各组随机选取6 只大鼠,麻醉后开腹,经腹主动脉取血约5 mL,部分全血制备血浆,通过血气分析仪检测PaO2和PaCO2值;部分全血分离血清,待测。剪取部分胰腺及肺组织,于4%多聚甲醛中固定,剩余部分肺组织于-80 ℃冰箱保存,待测。取右上完整肺叶测定肺湿/干重比。
1.2.5 血清淀粉酶活性和TNF-α、IL-6 水平检测 严格按照ELISA 试剂盒说明书操作,以标准品相应的吸光度值建立标准曲线,根据标准曲线检测TNF-α、IL-6 水平;利用全自动生化分析仪检测各组血清淀粉酶活性。
1.2.6 肺组织MDA、GSH 水平及MPO 活性检测 严格按照试剂盒说明书检测肺组织MDA、GSH 水平和MPO 活性。
1.2.7 胰腺、肺组织病理学观察及病理评分 取固定的胰腺、肺组织,制备切片,HE 染色后,于光镜下观察各组胰腺、肺组织病理变化并对病理损伤进行评分。胰腺病理以腺泡坏死(0 分为无坏死;1 分为坏死面积<15%;2 分为坏死面积15%~35%;3 分为坏死面积>35%)、炎症细胞浸润(0 分为无炎性浸润;1 分为轻度血管周围浸润;2 分为中度血管周围和轻度弥漫性浸润;3 分为大量弥漫性浸润)、出血(0 分为无出血;1 为1~2 个出血灶;2 分为3~5 个出血灶;3 分为>5 个出血灶) 和水肿(0 分为无水肿;1 分为片状叶间隙增宽;2 分为弥漫性叶间隙增宽;3 分为弥漫性腺泡间隙增宽) 进行评分;肺组织以肺泡间隔增宽、炎性细胞浸润和出血进行评分(0 分为正常肺;1 分为<25%肺部受累;2 分为25%~50%肺部受累;3 分为50%~75%肺部受累),每个参数的评分为0~3 分。
1.2.8 大鼠肺组织TUNEL 染色检测 石蜡切片按照试剂盒说明书操作,分析TUNEL 阳性表达结果。
1.2.9 肺组织PTGS2、cleaved caspase-3、HO-1、P53 蛋白表达检测 取各组肺组织150 mg,加入RIPA 蛋白裂解液及研磨珠后于冰上研磨,离心取上清后测定蛋白浓度,以每孔75 μg 蛋白上样,电泳,转膜,封闭,洗膜后加一抗4 ℃孵育过夜,次日洗膜后,常温孵育二抗120 min,ECL发光液显影及曝光,分析各条带灰度值。
1.2.10 统计学分析 通过SPSS 24.0 软件进行处理,计量资料以(±s) 表示,满足正态分布和方差齐性时,组间比较采用单因素方差分析,两两比较采用LSD-t法;不符合正态分布或方差不齐时进行变量转换,若仍不符合正态分布或方差不齐,采用Kruskal-Wallis 法。P<0.05 表示差异具有统计学意义。
2 结果
2.1 凉膈散与AP-ALI 成分-靶点网络构建 基于TCMSP及TCMID 数据库获取凉膈散化合物957 个(矿物药芒硝未找到化合物信息,已删去),其中连翘150 个、栀子98 个、大黄92 个、竹叶30 个、薄荷164 个、黄芩143 个、甘草280 个。经过ADME 标准筛选并删去重复值后得到活性成分155 个,预测靶点311 个。利用Cytoscape 软件组建凉膈散的活性成分-靶点网络,见图1。利用GeneCards 和DisGeNET 数据库分别获取AP 及ALI 相关靶点,将相关靶点与凉膈散预测靶点取交集后获得257 个交集靶点,见图2A。借助STRING 数据库建立凉膈散治疗AP-ALI 的PPI 网络图,涉及257 个节点,2 205 条边。将PPI 数据导入Cytoscape 3.7.2 软件后,利用MCODE 插件进行模块分析,共得到41 个关键靶点,基于关键靶点筛选出活性成分并构建主要活性成分-关键靶点网络,见图2B。其中度值排名前十的靶点及成分见图2C、表1。
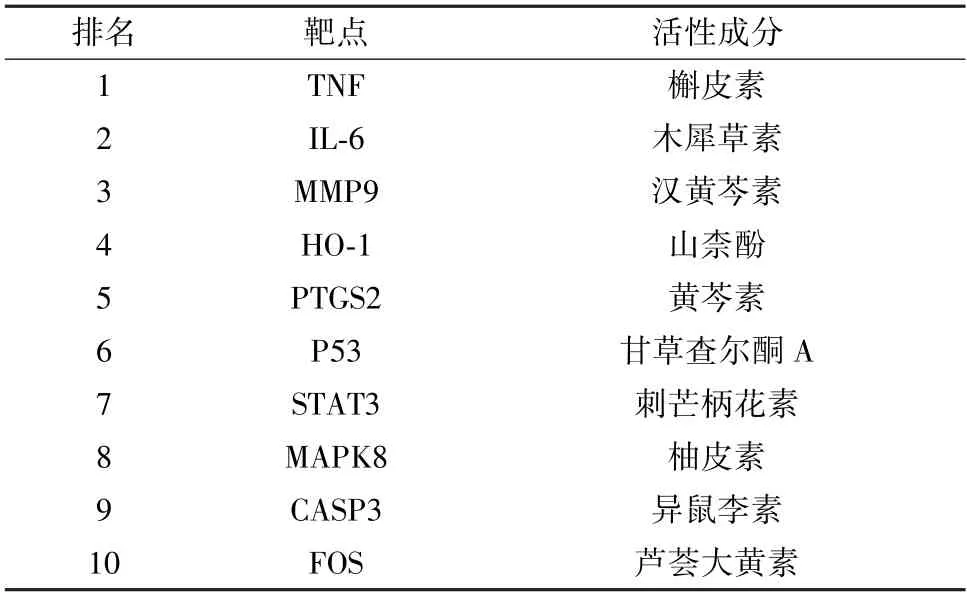
表1 凉膈散治疗AP-ALI 排名前十的靶点和活性成分

图1 凉膈散活性成分-靶点网络图
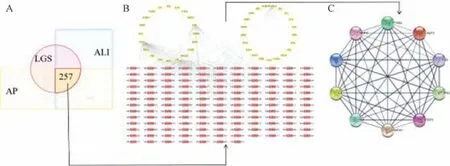
图2 凉膈散与AP-ALI 交集靶点网络
2.2 GO 功能与KEGG 通路富集分析 利用Metascape 数据库对41 个关键靶点进行功能富集分析。以P<0.05 为筛选标准,获得113 条生物过程(biological process,BP)、23条细胞组成 (cellular component,CC)、45 条分子功能(molecular function,MF),选取排名前十的功能信息进行注释,见图3A。其中凉膈散主要通过细胞外间隙、胞外区、细胞质液、核质参与RNA 聚合酶Ⅱ启动子转录的正调控、转录调控、对药物的反应、脂多糖介导的信号通路、NO 生物合成的正调控等生物学过程发挥酶结合、相同蛋白结合、转录因子结合、细胞因子活性调节等功能。以P<0.001 为筛选标准,排名前二十的信号通路见图3B,主要涉及TNF、丝裂原激活蛋白激酶 (mitogen-activated protein kinase,MAPK)、低氧诱导因子1 (hypoxia-inducible factor 1,HIF-1)、Toll 样受体(Toll-like receptos,TLRs) 和癌症等信号通路。

图3 关键靶点的GO 和KEGG 富集分析
2.3 分子对接分析 利用Autodock Vina 1.1.2 软件将排名前十的活性成分与排名前十的关键靶点进行分子对接,结果见图4A (横坐标代表化合物,纵坐标代表靶点)。通常认为结合能低于-5.0 kcal/mol (绝对值大于5.0) 表明分子之间具有良好的相互作用。由此可知,凉膈散主要活性成分与关键靶点皆具有良好的结合活性。其中,槲皮素与PTGS2 结合能为-9.5 kcal/mol,木犀草素与PTGS2 结合能为-9.6 kcal/mol,结果见图4B~4C。
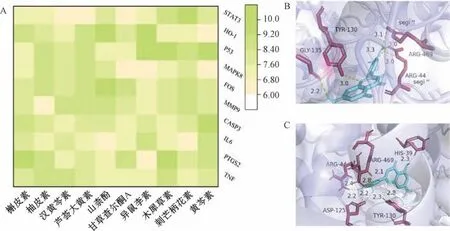
图4 活性成分与靶点的分子对接
2.4 凉膈散对AP-ALI 大鼠肺组织湿/干重比及PaO2、PaCO2值的影响 与对照组比较,模型组大鼠肺组织湿/干重比和PaCO2值升高(P<0.01),PaO2值降低(P<0.01);与模型组比较,凉膈散组大鼠肺组织湿/干重比和PaCO2值降低(P<0.01),PaO2值升高(P<0.01),见表2。
表2 凉膈散对AP-ALI 大鼠肺组织湿/干重比及PaO2、PaCO2 值的影响 (±s,n=6,1 mmHg=0.133 kPa)
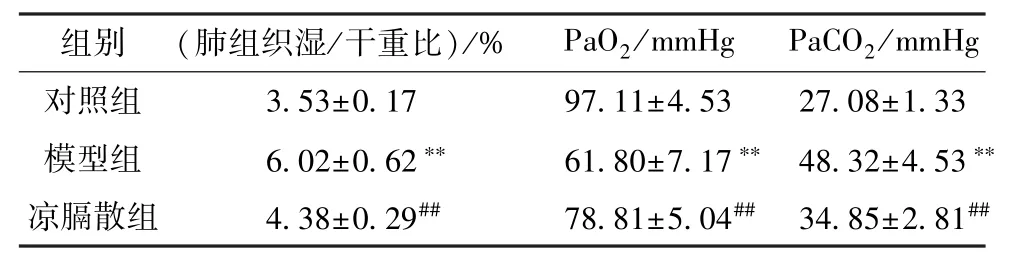
表2 凉膈散对AP-ALI 大鼠肺组织湿/干重比及PaO2、PaCO2 值的影响 (±s,n=6,1 mmHg=0.133 kPa)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01。
组别(肺组织湿/干重比)/%PaO2/mmHgPaCO2/mmHg对照组3.53±0.1797.11±4.5327.08±1.33模型组6.02±0.62**61.80±7.17** 48.32±4.53**凉膈散组4.38±0.29##78.81±5.04## 34.85±2.81##
2.5 凉膈散对AP-ALI 大鼠胰腺及肺组织病理变化的影响 对照组大鼠胰腺组织结构清晰完整,无出血及坏死,肺组织无病理变化;模型组大鼠可见胰腺组织水肿,腺小叶分隔,大片腺小叶溶解性坏死或缺失,间质弥漫性出血并伴有大量炎性细胞浸润,肺组织结构破坏,肺泡间隔增厚及炎性细胞浸润;凉膈散组大鼠胰腺组织损伤减轻,出血、坏死等情况缓解,肺组织病理损伤较模型组减轻,见图5A。病理评分如图5B 所示,与对照组比较,模型组大鼠胰腺、肺组织病理评分升高(P<0.01);与模型组比较,凉膈散组大鼠胰腺、肺组织病理评分降低(P<0.01)。
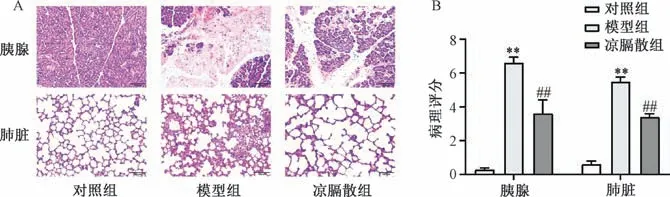
图5 凉膈散对大鼠胰腺和肺组织病理的影响(×200,±s,n=6)
2.6 凉膈散对AP-ALI 大鼠血清淀粉酶活性和炎症因子水平的影响 血清淀粉酶活性是临床诊断AP 的金标准,与对照组比较,模型组大鼠血清淀粉酶活性升高3 倍以上(P<0.05),表明模型建立成功,且炎症因子IL-6、TNF-α 水平均升高(P<0.01);与模型组比较,凉膈散组大鼠血清IL-6、TNF-α 水平和淀粉酶活性均降低(P<0.05,P<0.01),见表3。
表3 凉膈散对AP-ALI 大鼠血清淀粉酶活性和IL-6、TNF-α 水平的影响(±s,n=6)
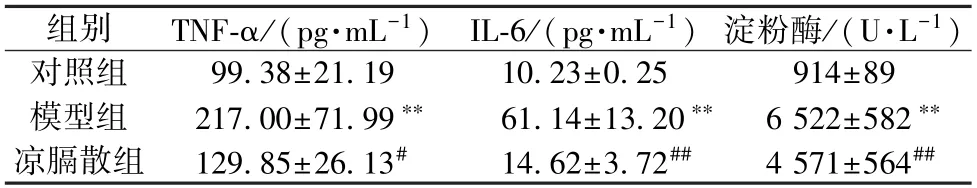
表3 凉膈散对AP-ALI 大鼠血清淀粉酶活性和IL-6、TNF-α 水平的影响(±s,n=6)
注:与对照组比较,** P <0.01;与模型组比较,#P <0.05,##P<0.01。
组别TNF-α/(pg·mL-1) IL-6/(pg·mL-1) 淀粉酶/(U·L-1)对照组99.38±21.1910.23±0.25914±89模型组217.00±71.99**61.14±13.20** 6 522±582**凉膈散组129.85±26.13#14.62±3.72##4 571±564##
2.7 凉膈散对AP-ALI 大鼠肺组织氧化应激标志物的影响 肺组织MPO 活性是中性粒细胞聚集指标,与对照组比较,模型组大鼠肺组织MDA 水平和MPO 活性升高(P<0.01),GSH 水平降低(P<0.01);与模型组比较,凉膈散组大鼠肺组织MDA 水平和MPO 活性降低(P<0.01),GSH水平升高(P<0.01),见表4。
表4 凉膈散对AP-ALI 大鼠肺组织MDA、GSH 水平和MPO 活性的影响(±s,n=6)

表4 凉膈散对AP-ALI 大鼠肺组织MDA、GSH 水平和MPO 活性的影响(±s,n=6)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01。
组别MDA/(μmol·g prot-1)GSH/(μmol·g prot-1)MPO/(U·g prot-1)对照组0.86±0.024.75±0.420.56±0.12模型组1.52±0.03**0.43±0.41**2.51±0.07**凉膈散组1.06±0.02##1.83±0.44##1.44±0.83##
2.8 凉膈散对AP-ALI 大鼠肺组织细胞凋亡的影响 与对照组比较,模型组大鼠肺组织细胞凋亡百分比增加(P<0.05);与模型组比较,凉膈散组大鼠肺组织细胞凋亡百分比降低(P<0.05),见图6。
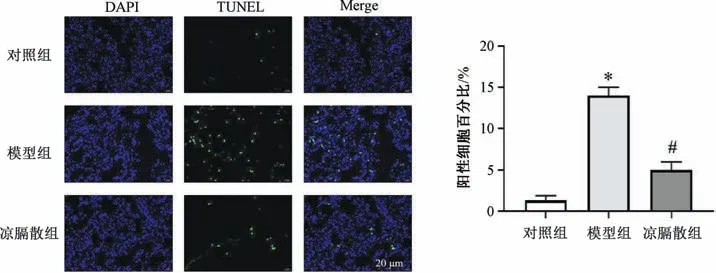
图6 凉膈散对AP-ALI 大鼠肺组织细胞凋亡的影响(±s,n=6)
2.9 凉膈散对AP-ALI 大鼠肺组织PTGS2、HO-1、P53 及cleaved caspase-3 蛋白表达的影响 与对照组比较,模型组大鼠肺组织PTGS2、HO-1、P53 及cleaved caspase-3 蛋白表达升高(P<0.05);与模型组比较,凉膈散组大鼠肺组织PTGS2、cleaved caspase-3、P53 蛋白表达降低(P<0.05),HO-1 蛋白表达升高(P<0.05),见图7。
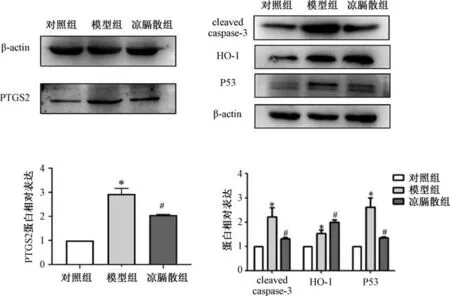
图7 凉膈散对AP-ALI 大鼠肺组织PTGS2、HO-1、P53 及cleaved caspase-3 蛋白表达的影响(±s,n=6)
3 讨论
AP 发展至ALI 时,炎症介质被大量释放引起全身炎症反应;肠道屏障损伤又可诱发菌群移位,内毒素入血,对机体造成致命打击[9]。中医认为里、实、热为AP 的主要病机,合并ALI 时应肺肠同治,以“通腑泻热” “清热解毒” 为主[10-11]。凉膈散中的大黄及芒硝行通里攻下之功,有助于缓解肠道屏障损伤;甘草生津润燥以缓二药峻下之力;连翘及黄芩清解胸膈肺热,缓解呼吸功能障碍。药理学研究发现凉膈散可改善机体微循环障碍、调节机体紊乱的炎症反应、拮抗肠道毒素对机体的损害[12-14]。肖婧等[15]发现凉膈散可降低AP 患者血清淀粉酶活性及住院时间。凉膈散还有助于改善AP 并发ALI 患者呼吸功能障碍并降低患者腹内压[5]。本研究发现,凉膈散给药后,大鼠胰腺及肺组织病理损伤减轻,血清淀粉酶活性、IL-6 和TNF-α 水平降低,肺组织水肿及呼吸功能障碍得到改善。因此,凉膈散可能是治疗AP-ALI 的有效复方,但其具体机制尚待阐明。
本研究构建了凉膈散-疾病靶点网络,最终获得活性成分155 个,药物靶点共311 个。药物与疾病交集靶点为257个,经MCODE 插件筛选后获得41 个关键靶点,包括排名前十的TNF、IL6、MMP9、HO-1、PTGS2、P53、STAT3、MAPK8、CASP3、FOS。PTGS2 是前列腺素合成的限速酶,在调节机体炎症和免疫功能中发挥关键作用。有研究表明PTGS2 与AP 引起肠道炎症和肠道屏障损伤密切相关[16]。一项临床研究报道PTGS2 抑制剂可将严重急性胰腺炎(SAP) 的发生率降低约50%[17]。本研究发现凉膈散主要活性成分与PTGS2 皆有良好的结合活性,动物实验结果显示PTGS2 在模型大鼠肺组织中表达升高,凉膈散可下调其表达,提示凉膈散对AP 及其ALI 的保护功能可能与抑制PTGS2 合成相关。HO-1 是一种抗炎、抗氧化的防御基因,诱导HO-1 表达可减轻SAP 早期的全身炎症反应及远端器官损伤[18]。本研究发现,模型组大鼠肺组织HO-1 蛋白表达升高,而凉膈散对HO-1 表达具有促进作用,这提示凉膈散可能通过促进HO-1 信号通路抑制AP-ALI 的氧化应激损伤。p53 基因是一种肿瘤抑制基因,其编码的蛋白P53 是重要的细胞凋亡标记蛋白。Zhou 等[19]发现p53 基因敲除可抑制小鼠AP 发展。caspase-3 是重要的凋亡蛋白酶,P53 可刺激胞质内无活性的caspase-3 裂解活化为cleaved caspase-3 形式,cleaved caspase-3 可直接反应细胞凋亡水平[20]。本研究发现,P53、cleaved caspase-3 在模型组大鼠肺组织中表达升高,表明AP 诱导的肺组织凋亡可能由P53/caspase-3 信号介导,凉膈散可能通过抑制P53 和cleaved caspase-3 表达削减凋亡通路的激活,从而减轻AP-ALI 损伤。
综上所述,凉膈散可有效改善AP-ALI 大鼠胰腺及肺损伤,其机制可能与促进HO-1 及抑制P53/caspase-3 通路有关。

