六安瓜片茶多酚大孔吸附树脂纯化工艺及其降血糖活性研究
刘龙云,何晓梅,赵良冰,李欣冉,王 燕,张珍林,宋锐修
(1.合肥职业技术学院生物工程学院,安徽 合肥 230000;2.皖西学院生物与制药工程学院,安徽 六安 237012;3.六安市农业技术推广中心,安徽 六安 237012)
茶叶Camelliasinensis(L.) O.Kuntze 是重要的经济作物,品类众多,具有抗氧化、抗炎、抗癌、降血糖、降血脂等作用[1-3],主要成分为黄烷醇、花色苷、黄酮、黄酮醇、酚酸等[4]。研究表明,多酚类物质是茶叶中的生物活性物质,具有显著抗氧自由基作用[5-6],在食品、农业、医药等领域有着广泛应用[7]。随着人们对茶多酚认识的加深,其市场需求量越来越大,但它主要通过提取纯化来获得,故相关工艺亟需优化改进以满足产业发展和社会需要。
目前,常用的提取纯化方法均存在一些不足[8],如微波辅助萃取操作可控性较低[9-10];金属离子沉淀法会造成重金属残留[11];膜过滤法成本高,规模小[12]。本实验利用大孔树脂选择性吸附的特点[13]来纯化茶多酚,有着精准、绿色、高效、安全的特点[14-15],对制备高纯度多酚具有重要意义[16]。
在六大茶类中,绿茶所含茶多酚含量最高[17-18],六安瓜片作为中国十大名茶中之一的绿茶,是六安市大别山一带非常重要的经济作物,故本实验对其所含的茶多酚进行大孔吸附树脂纯化,并探究其降血糖活性,以期为该品种开发利用提供依据。
1 材料
1.1 仪器 AE124 型电子分析天平(上海舜宇恒平科学仪器有限公司);RE-52AA 型旋转蒸发器(上海亚荣生化仪器厂);UV-5200 型紫外可见分光光度计(上海元析仪器有限公司);JK-500B 型超声波清洗器(合肥金尼克医疗科技有限公司);SHZ-D (Ⅲ) 型循环水真空泵(巩义市予华仪器有限责任公司);PHS-25 型PH 计(上海志荣电子科技有限公司);800A 型粉碎机(永康市红太阳机电有限公司);40 目筛(华丰五金仪器有限公司)。
1.2 试剂与药物 血糖试纸(江苏鱼跃医疗设备股份有限公司)。AB-8、NKA-9、LSA-21 型大孔吸附树脂(东鸿化工有限公司)。链脲佐菌素(STZ) (德国BioFroxx 公司)。绿茶茶多酚对照品(上海源叶生物科技有限公司)。酒石酸钾钠、硫酸亚铁、焦性没食子酸(邻苯三酚)、十二水合磷酸氢二钠、二水合磷酸二氢钠、三羟甲基氨基甲烷、柠檬酸、柠檬酸钠为分析纯 (国药集团化学试剂有限公司)。
1.3 药材 六安瓜片购自安徽省六安瓜片茶业股份有限公司。
1.4 动物 昆明小鼠,SPF 级,体质量18~22 g,雌雄各半,购于安徽医科大学实验动物中心,动物生产许可证号SCXK (皖) 2017-001。
2 方法
2.1 提取液制备及茶多酚含量测定
2.1.1 制备方法 称取六安瓜片2.0 g,粉碎后过40 目筛,置于烧杯中,加入50 mL 70% 乙醇,提取 (温度70 ℃,功率600 W) 40 min,冷却至室温,3 500 r/min 离心10 min,残渣用50 mL 70%乙醇再提取1 次,合并提取液,在旋转蒸发仪上浓缩,加水稀释,即得。
2.1.2 测定方法 采用福林酚比色法[19]测定。称取没食子酸对照品0.100 0 g,加水溶解后定容至100 mL,得1 000 μg/mL 母液,分别取1.0、3.0、5.0、7.0、9.0 mL 至100 mL 量瓶中,制成系列质量浓度,分别取1 mL 至试管中,加入10% 福林酚试剂5.0 mL,避光反应10 min,再加入7.5% Na2CO3溶液4.0 mL,充分混匀,50 ℃水浴10 min,冷却至室温,在765 nm 波长处测定吸光度。以对照品质量浓度为横坐标(X),吸光度为纵坐标(A) 绘制标准曲线,得方程为A=0.01X+0.041 7 (R2=0.999 7),在10~90 μg/mL范围内线性关系良好,再计算含量,公式为茶多酚含量=其中V为提取液体积(100 mL),d为稀释因子(1 mL 稀释至100 mL,则其稀释因子为100),SLOPESted为标准曲线斜率,m为样品质量。
2.2 分离纯化工艺研究
2.2.1 大孔吸附树脂筛选 称取等量AB-8、NKA-9、LSA-21 型树脂,置于无水乙醇中浸泡24 h,去离子水洗涤至无醇味,置于5%盐酸中浸泡24 h,去离子水洗至中性,置于5%NaOH 溶液中浸泡24 h,去离子水洗至中性,最后加入去离子水。分别称取3.0 g (湿重) 至100 mL 锥形瓶中,加入20 mL 提取液,保鲜膜密封,恒温(25 ℃)、100 r/min 振荡24 h,静置后过滤,按“2.1.2” 项方法测定茶多酚含量,再计算吸附量、吸附率,公式分别为吸附量=、吸附率=×100%,其中m为树脂质量,C0为提取液中茶多酚含量,C1为吸附液中茶多酚含量,V1为吸附液体积。
将吸附饱和的3 种树脂用一定体积去离子水冲洗,置于100 mL 锥形瓶中,加入80%乙醇20 mL,保鲜膜密封,恒温(25 ℃)、100 r/min 振荡24 h,静置后抽滤,按“2.1.2” 项下方法测定茶多酚含量,计算解吸率,公式为解吸率=×100%,其中C0为提取液中茶多酚含量,C1为吸附液中茶多酚含量,C2为解吸液中茶多酚含量,V1为吸附液体积,V2为解吸液体积。
2.2.2 静态吸附工艺优化
2.2.2.1 单因素试验 (1) 吸附时间:取预处理好的AB-8 型树脂3.0 g (湿重),转移至100 mL 锥形瓶中,加入20 mL 提取液(pH 值为6.0,含3.343 mg/mL 茶多酚),在25 ℃下吸附,每30 min 测定上清液中茶多酚含量,按“2.2.1” 项下方法计算吸附量。
(2) 吸附温度:取预处理好的AB-8 型树脂3.0 g (湿重),平行5 份,转移至100 mL 锥形瓶中,加入20 mL 提取液(pH 值为6.0,含2.866 mg/mL 茶多酚),分别在20、25、30、35、40 ℃下吸附2 h,测定上清液中茶多酚含量,按“2.2.1” 项下方法计算吸附量。
(3) 吸附pH 值:取预处理好的AB-8 型树脂3.0 g(湿重),平行7 份,转移至100 mL 锥形瓶中,加入20 mL提取液(含3.188 mg/mL 茶多酚),采用同体积酸碱试剂分别调节pH 值至3.0、4.0、5.0、6.0、7.0、8.0、9.0,在25 ℃下吸附2 h,测定上清液中茶多酚含量,按“2.2.1” 项下方法计算吸附量。
2.2.2.2 正交试验 在单因素试验基础上,以吸附时间(A)、吸附温度(B)、吸附pH 值(C) 为影响因素,茶多酚吸附量为评价指标,设计L9(33) 正交表,因素水平见表1。
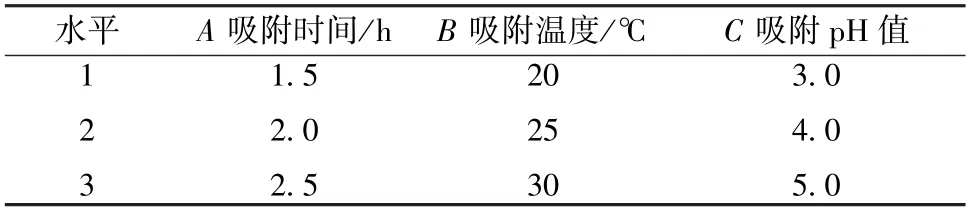
表1 静态吸附正交试验因素水平
2.2.3 静态解吸工艺优化
2.2.3.1 单因素试验 (1) 解吸时间:取吸附饱和的AB-8 型树脂3.0 g,去离子水冲洗除去表面残留液,抽滤后置于100 mL 锥形瓶中,加入20 mL 80%乙醇,在25 ℃下解吸,每30 min 测定上清液中茶多酚含量至解吸结束,测定解吸平衡液吸光度,按“2.2.1” 项下方法计算解吸率。
(2) 乙醇体积分数:取吸附饱和的AB-8 型树脂3.0 g,去离子水冲洗除去表面残留液,抽滤后置于100 mL 锥形瓶中,分别加入40%、50%、60%、70%、80%、90%乙醇各20 mL,在25 ℃下解吸2 h,测定解吸平衡液吸光度,按“2.2.1” 项下方法计算解吸率。
(3) 解吸温度:取吸附饱和的AB-8 型树脂3.0 g,去离子水冲洗除去表面残留液,抽滤后置于100 mL 锥形瓶中,加入20 mL 70% 乙醇,分别在20、25、30、35、40、45 ℃下解吸2 h,测定解吸平衡液吸光度,按“2.2.1” 项下方法计算解吸率。
2.2.3.2 正交试验 在单因素试验基础上,以解吸时间(A)、解吸温度(B)、乙醇体积分数(C) 为影响因素,茶多酚解吸率为评价指标,设计L9(33) 正交表,因素水平见表2。

表2 静态解吸正交试验因素水平
2.3 茶多酚纯度测定 将解吸后的树脂进行抽滤,收集滤液,适当浓缩后冷冻干燥,再分别制备50 μg/mL 对照品、纯化后样品溶液,在紫外-可见光谱下测定吸光度,计算纯度。
2.4 降血糖活性研究 60 只小鼠随机分为6 组,每组10只,分别为空白组、模型组、对照组、茶多酚低剂量组、茶多酚中剂量组、茶多酚高剂量组[20],适应性喂养3 d 后禁食不禁水12 h,除空白组外各组小鼠以0.1 mL/10 g 剂量腹腔注射1%链脲佐菌素,而空白组小鼠腹腔注射等剂量柠檬酸缓冲液[21],尾部取血,检测血糖值,以大于11 mmol/L为造模成功。空白组、模型组小鼠灌胃给予蒸馏水,对照组小鼠灌胃给予600 mg/kg 绿茶茶多酚对照品溶液,茶多酚低、中、高剂量组小鼠分别灌胃给予“2.1” 项下300、600、1 200 mg/kg 提取液,剂量均为0.1 mL/10 g,连续30 d,每3 d 称定1 次体质量,最后1 次给药后禁食,血糖监测仪检测血糖值,计算血糖下降率[22],公式为血糖下降率=小鼠脱臼处死,取心、肝、脾、肾、胸腺,称定质量,计算脏器指数[23],公式为脏器指数=
2.5 数据处理 采用Excel 软件进行处理,结果以(±s)表示。
3 结果
3.1 树脂筛选 由表3 可知,各树脂吸附能力依次为AB-8、LSA、NKA,解吸能力依次为AB-8、LSA、NKA-9,故选择AB-8 型树脂进行后续研究。

表3 不同大孔吸附树脂吸附、解吸能力比较
3.2 静态吸附工艺优化
3.2.1 单因素试验 由图1A 可知,茶多酚吸附量随着吸附时间延长先升高,2 h 后趋缓,表明吸附2 h 时已接近饱和,故以其为最佳吸附时间。

图1 静态吸附工艺单因素试验结果
由图1B 可知,茶多酚吸附量随着吸附温度增加先升高,在25 ℃时达到最大值,但继续增加时反而降低,这是因为当温度适当升高时分子运动速度加快,有利于树脂吸附;当温度进一步升高时可能会使得茶多酚与空气接触加剧而发生氧化反应,导致其含量降低,故以25 ℃为最佳吸附温度。
由图1C 可知,茶多酚吸附量随着吸附pH 值增加先升高,在4.0 时达到最大值,这是因为多酚类化合物含有较多羟基而容易电离出H+,从而呈弱酸性,如果抑制H+电离并保证该成分以分子形式存在,则有利于吸附;但继续增加时多酚离子化程度会加深,吸附效果降低,导致纯化效率反而下降,故以4.0 为最佳吸附pH 值。
3.2.2 正交试验 因素水平见表4,结果见表5,可知各因素影响程度依次为B>C>A,最优工艺为A3B2C2,为了节约时间和成本,本实验选择吸附时间为2 h。最终确定,最优工艺为吸附时间2 h,吸附温度25 ℃,吸附pH 值4.0。

表4 静态吸附工艺正交试验设计与结果

表5 静态吸附工艺正交试验方差分析
3.2.3 验证试验 按“3.2.2” 项下优化工艺进行3 批验证试验,测得茶多酚平均吸附量为15.25 mg/g,表明该工艺稳定可行。
3.3 静态解吸工艺
3.3.1 单因素试验 由图2A 可知,茶多酚解吸率随着解吸时间延长升高,在120 min 时达到最大值,但继续延长时反而略微降低,其原因可能是解吸出的茶多酚又重新吸附到树脂上,故以120 min 为最佳解吸时间。

图2 静态解吸工艺单因素试验结果
由图2B 可知,茶多酚解吸率随着乙醇体积分数增加升高,在70%时达到最大值,但继续增加时有降低趋势,故以70%为最佳乙醇体积分数。
由图2C 可知,茶多酚解吸率随着解吸温度增加升高,在35 ℃时达到最大值,但继续升高时反而降低,其原因可能是树脂内部分子运动随着温度增加先越来越活跃,使茶多酚更易被乙醇洗脱下来,但温度过高时树脂容易变性,乙醇容易挥发,导致解吸效果下降,故以35 ℃为最佳解吸温度。
3.3.2 正交试验 因素水平见表6,结果见表7,可知各因素影响程度依次为C>A>B,最优工艺为A1B2C2,即解吸时间1.5 h,解吸温度35 ℃,乙醇体积分数70%。
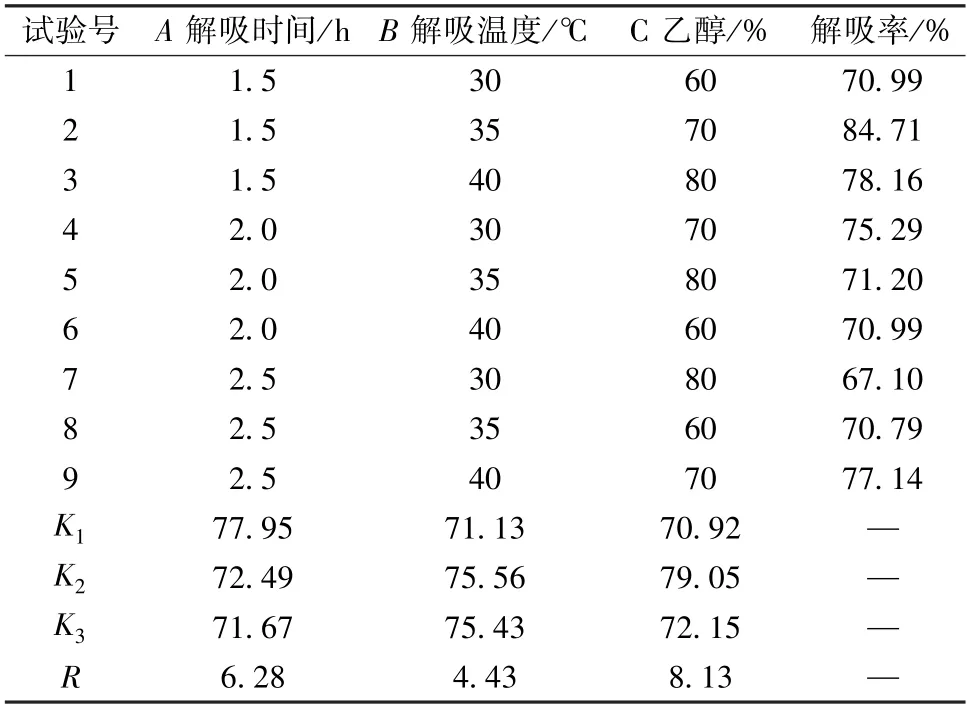
表6 静态解吸工艺正交试验结果
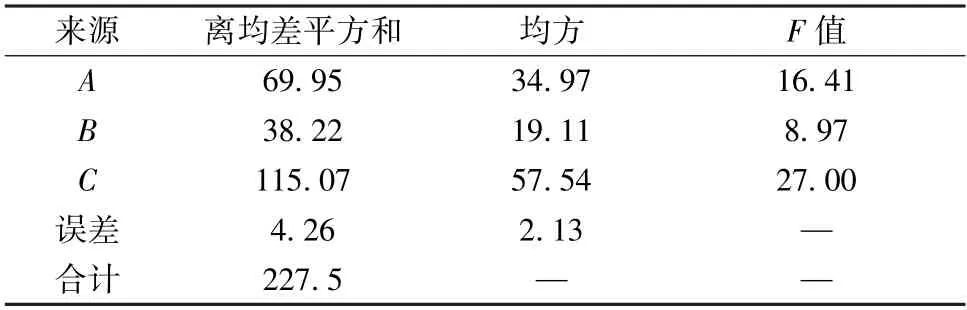
表7 解吸工艺正交试验方差分析
3.3.3 验证试验 按“3.3.2” 项下优化工艺进行3 批验证试验,测得茶多酚平均解吸率达84.91%,表明该工艺稳定可行。
3.4 茶多酚纯度测定 按“3.2.2” “3.3.2” 项下优化工艺纯化茶多酚,测得其纯度为78.64%。
3.4.1 血糖值 由表8 可知,与空白组比较,模型组小鼠血糖值升高(P<0.01),表明造模成功;与模型组比较,茶多酚各剂量组小鼠血糖值降低(P<0.05,P<0.01),并呈剂量依赖性。
表8 各组小鼠血糖值比较(±s,n=10)
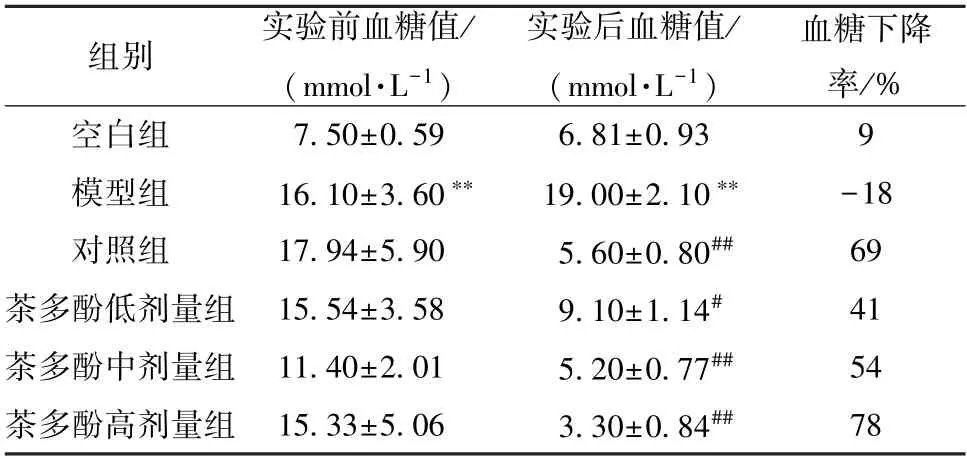
表8 各组小鼠血糖值比较(±s,n=10)
注:与空白组比较,**P <0.01;与模型组比较,#P <0.05,##P<0.01。
组别实验前血糖值/(mmol·L-1)实验后血糖值/(mmol·L-1)血糖下降率/%空白组7.50±0.596.81±0.939模型组16.10±3.60**19.00±2.10**-18对照组17.94±5.905.60±0.80##69茶多酚低剂量组 15.54±3.589.10±1.14#41茶多酚中剂量组 11.40±2.015.20±0.77##54茶多酚高剂量组 15.33±5.063.30±0.84##78
3.4.2 脏器指数 除空白组外,各组小鼠在实验开始时均会出现眼部细菌感染,灌胃给药一段时间后除模型组外均有所减轻。由表9 可知,与模型组比较,茶多酚各剂量组小鼠脏器指数均有不同程度的改善,以中剂量组更全面(P<0.05,P<0.01)。
表9 各组小鼠脏器指数比较(mg/g,±s,n=10)

表9 各组小鼠脏器指数比较(mg/g,±s,n=10)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01。
组别心肝脾肾胸腺空白组0.565±0.0784.848±0.4380.531±0.1781.516±0.1740.441±0.177模型组0.510±0.066*4.847±0.4140.504±0.1861.576±0.201*0.536±0.245*对照组0.516±0.1035.151±0.8330.659±0.348#1.679±0.215#0.232±0.101##茶多酚低剂量组0.596±0.013#4.826±0.3120.793±0.158##1.442±0.1560.347±0.096##茶多酚中剂量组0.603±0.080##4.290±0.358#0.373±0.128#1.328±0.151#0.362±0.101##茶多酚高剂量组0.498±0.0384.751±0.8350.403±0.060#1.466±0.1660.226±0.037##
4 讨论与结论
本实验在单因素试验基础上采用正交试验,得到AB-8型大孔吸附树脂纯化六安瓜片茶多酚的最优静态吸附工艺为温度25 ℃,pH 值4.0,吸附时间2 h,吸附量达15.25 mg/g;最优静态解吸工艺为解吸时间1.5 h,解吸温度35 ℃,乙醇体积分数70%,解吸率达84.91%,并且工艺环境友好,设备可靠,过程安全,经济有效,便于产业化。再进行3 批验证试验,发现上述工艺稳定可靠。
绿茶作为药食同源、食用更广的品种,其用量与药效的关系是研发中非常重要的参数。因此,本实验以链脲佐菌素建立高血糖小鼠模型,考察茶多酚对其血糖、脏器指数的影响,发现不同剂量该成分均能显著降低血糖,并且呈现剂量依赖性,并且中剂量组对脏器指数的影响更全面。上述结果可为其他茶叶产品的开发提供理论依据。

