3D-PDU胎盘及子宫动脉血流动力学参数与胎盘植入的相关性分析*
谢平,金晓倩,张乾泉,黄正敏
(贵州省人民医院 超声科,贵州 贵阳 550002)
胎盘植入指胎盘种植异常,主要为胎盘和子宫壁蜕膜减少,胎盘绒毛侵入子宫肌层所导致[1]。胎盘植入是较为严重的妊娠并发症,二胎、三孩政策的放开及剖宫产率的上升使得胎盘植入的发生率也大大提高[2]。当孕妇发生胎盘植入时,一方面会增加分娩难度,另一方面容易发生子宫出血、穿孔、继发性感染等,甚至需要切除子宫,严重威胁孕妇和胎儿的生命安全[3-4]。因此,在产前对胎盘植入进行诊断,并确定植入范围和程度对分娩方式的选择及避免大出血具有重要意义。目前,诊断胎盘植入主要是通过病理组织学、影像学、分子生物学检查等方法,病理组织学检查是金标准,但产前诊断难以获得[5];分子生物学检查可通过检测甲胎蛋白、肌酸激酶等非侵入性方式获得,但缺乏特异性,使临床应用受到限制[6];影像学检查较为常用,主要包括超声和磁共振检查,磁共振检查分辨率高、成像范围广,却存在扫描时间长、费用高等缺点,相比而言,三维能量多普勒超声(three-dimensional power doppler ultrasound,3D-PDU)和超声多普勒检查能够较好地评估胎盘植入的位置、范围及程度,而且敏感性和预测价值较高[7]。本研究旨在探讨3D-PDU胎盘及子宫动脉血流动力学参数与胎盘植入的相关性,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2021年3月—2022年3月贵州省人民医院收治的70例胎盘植入孕妇的临床资料,将其作为胎盘植入组,另选取同期无胎盘植入的70例孕妇作为无胎盘植入组。两组患者的一般资料的比较见表1。本研究经医院医学伦理委员会批准,患者及家属签署知情同意书。
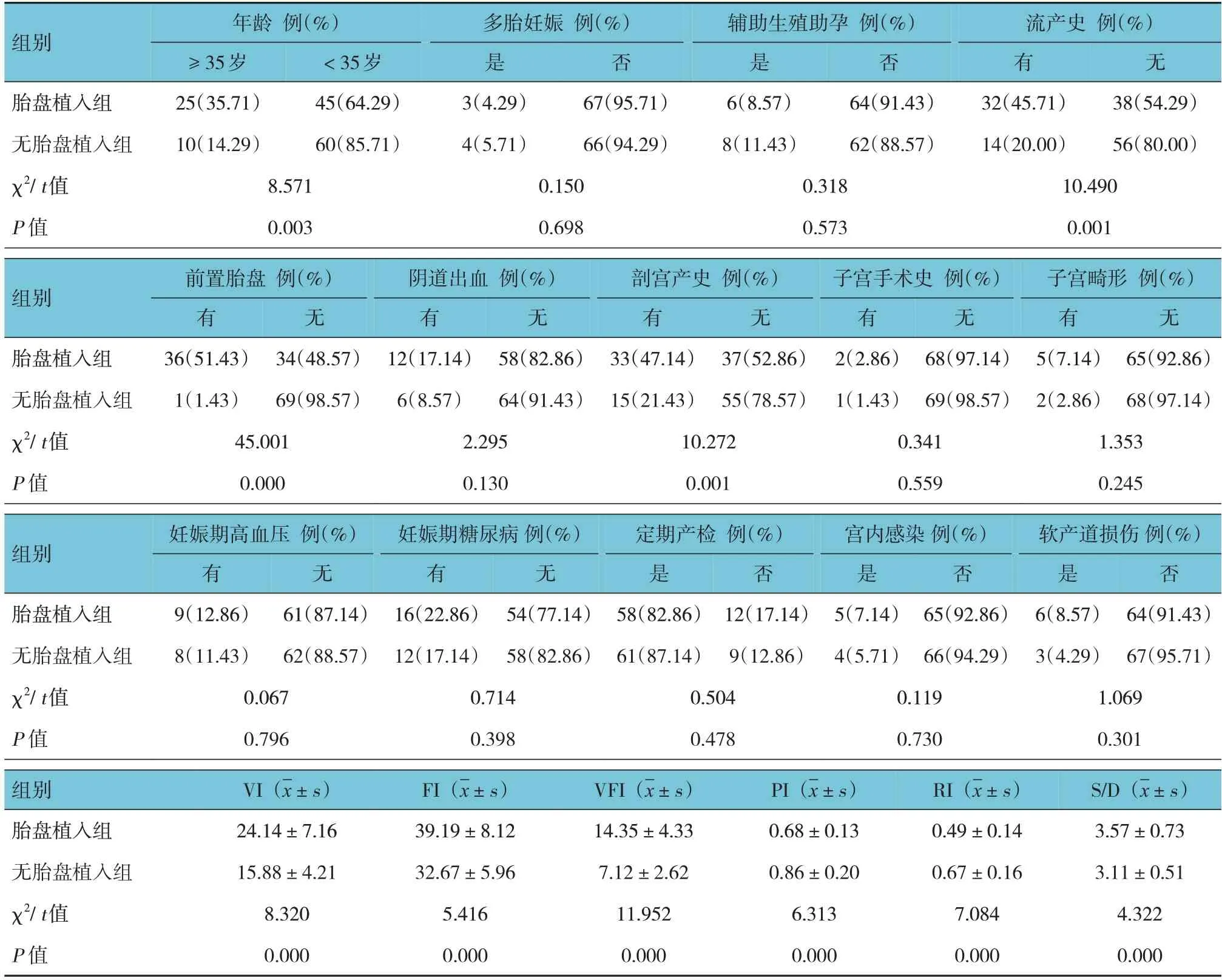
表1 胎盘植入发生的单因素分析 (n=70)
1.2 纳入与排除标准
纳入标准:①胎盘植入组符合《胎盘植入诊治指南(2015)》[8]的诊断标准,且术后经病理组织学检查确诊;②无胎盘植入组均为育龄期正常妊娠孕妇,且不存在胎盘植入;③孕周> 28周;④临床资料完整。排除标准:①胎儿发育不正常;②母体血管性疾病;③有3D-PDU检查禁忌证;④宫颈机能不全;⑤胎盘形态异常;⑥有活动性出血;⑦合并子宫肌瘤;⑧凝血功能异常;⑨语言障碍、听力障碍、精神障碍;⑩甲状腺功能亢进或减退。
1.3 临床资料收集
收集两组孕妇的年龄、多胎妊娠、辅助生殖助孕、流产史、前置胎盘、阴道出血、剖宫产史、子宫手术史、子宫畸形、妊娠期高血压、妊娠期糖尿病、定期产检、宫内感染、软产道损伤等一般资料。
1.4 3D-PDU检查
两组孕妇在产前1周行3D-PDU检查,采用美国GE公司生产的Vluson E8型及E10彩色多普勒超声诊断仪,设置频率4.0~8.0 MHz,应用3D-PDU模式扫描子宫壁和胎盘,调整各项参数,获得清晰的胎盘血流三维成像,使用三维超声体积自动测量技术对图像进行处理,以A平面为参考,旋转30°,以图像中心为主轮廓轴,控制取样光标距离约70 mm,描绘及测量所选区域的血管化指数(vascularisation index,VI)、流量指数(flow index,FI)、血管流量指数(vascularisation flow index,VFI),测量3次后取平均值。
1.5 子宫动脉血流动力学参数测量
孕妇取仰卧位,使用彩色多普勒超声探头探测腹股沟上方,设置探头频率2.0~5.0 MHz,打开彩色多普勒功能,获取两侧髂内动脉附近的子宫动脉血流,取样角度需< 30°,取样容积为2 mm,测量子宫动脉搏动指数(pulsatility index,PI)、阻力指数(resistance index,RI)、收缩期峰值/舒张末期流速(peak systolic velocity/end diastolic velocity,S/D),测量3次后取平均值。
1.6 统计学方法
数据分析采用SPSS 22.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以构成比或率(%)表示,比较用χ2检验;绘制受试者工作特征(receiver operating characteristic,ROC)曲线;影响因素的分析采用多因素Logistic逐步回归法。P<0.05为差异有统计学意义。
2 结果
2.1 胎盘植入发生的单因素分析
胎盘植入组与无胎盘植入组孕妇的多胎妊娠、辅助生殖助孕、阴道出血、子宫手术史、子宫畸形、妊娠期高血压、妊娠期糖尿病、定期产检、宫内感染及软产道损伤比较,经χ2检验,差异均无统计学意义(P>0.05);胎盘植入组与无胎盘植入组孕妇的年龄、流产史、前置胎盘、剖宫产史、VI、FI、VFI、PI、RI、S/D比较,经χ2或t检验,差异均有统计学意义(P<0.05);胎盘植入组中年龄≥ 35岁、有流产史、前置胎盘、剖宫产史的孕妇占比高于无胎盘植入组,VI、FI、VFI、S/D高于无胎盘植入组,PI、RI低于无胎盘植入组。见表1。
2.2 VI、FI、VFI、PI、RI、S/D预测胎盘植入发生的效能分析
ROC曲线分析结果显示,VI、FI、VFI、PI、RI、S/D预测胎盘植入发生的曲线下面积分别为0.853、0.756、0.771、0.850、0.765和0.747(P<0.05),敏感性分别为70.0%、75.7%、65.7%、81.4%、64.3%和61.4%,特异性分别为90.0%、68.6%、84.3%、75.7%、84.3%和78.6%。见表2。
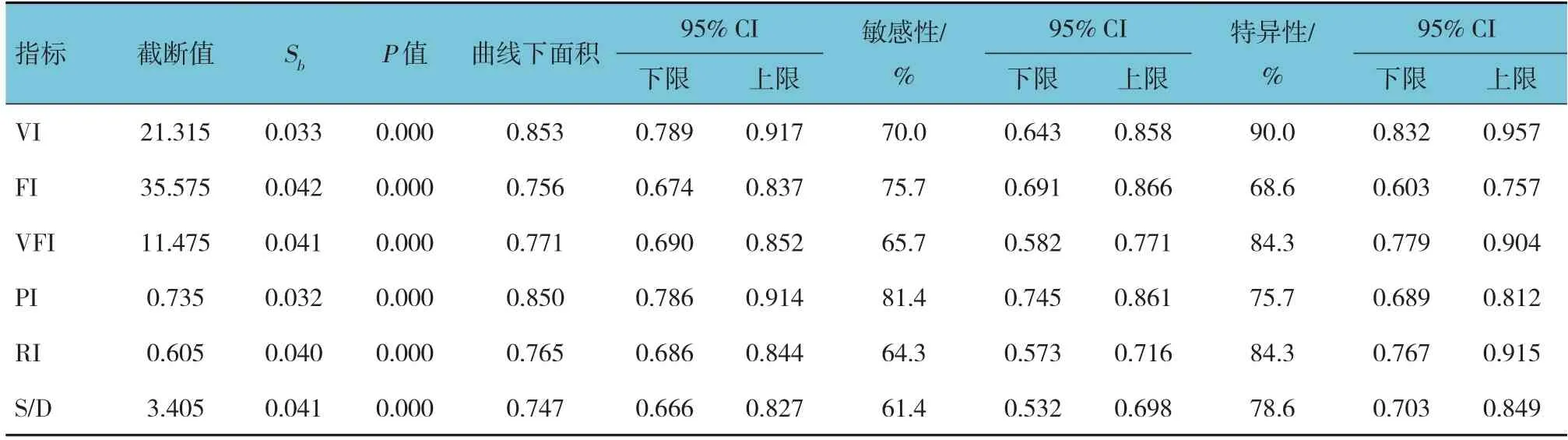
表2 VI、FI、VFI、PI、RI、S/D预测胎盘植入发生的效能分析
2.3 胎盘植入发生的多因素Logistic逐步回归分析
以胎盘植入发生为因变量,以年龄、流产史、前置胎盘、剖宫产史、VI、FI、VFI、PI、RI、S/D为自变量,赋值见表3,进行多因素Logistic逐步回归分析(α入=0.05,α出=0.10),结果显示:年龄≥ 35岁[=3.459(95% CI:1.721,6.952)]、流产史[=3.023(95% CI:1.511,6.048)]、前置胎盘[=4.878(95% CI:2.215,10.743)]、剖宫产史[=3.436(95% CI:1.517,7.783)]、VI ≥ 21.315[=3.244(95% CI:1.624,6.480)]、FI ≥ 35.575 [=3.105(95% CI:1.347,7.157)]、VFI ≥ 11.475 [=2.994(95% CI:1.471,6.094)]、PI ≤ 0.735 [=3.843(95% CI:1.678,8.801)]、RI ≤ 0.605 [=3.111(95% CI:1.319,7.338)]、S/D ≥ 3.405 [=3.486(95% CI:1.677,7.246)]是胎盘植入发生的危险因素(P<0.05)。见表4。

表3 量化赋值表

表4 胎盘植入发生的多因素Logistic逐步回归分析参数
2.4 胎盘植入的预测模型建立及预测胎盘植入发生的ROC分析
根据多因素Logistic逐步回归分析结果,将VI、FI、VFI、PI、RI、S/D纳入胎盘植入的预测模型,Logit(P)= -35.687 + 1.177XVI+ 1.133XFI+ 1.097XVFI+1.346XPI+ 1.135XRI+1.249XS/D。ROC曲线分析结果表明,胎盘植入预测模型预测胎盘植入发生的曲线下面积为94.9%(95% CI:0.913,0.984),敏感性为90.0%(95% CI:0.829,0.962),特异为88.6%(95%CI:0.819,0.923)(P<0.05)。胎盘植入预测模型敏感性优于各项指标单独预测。见图1。
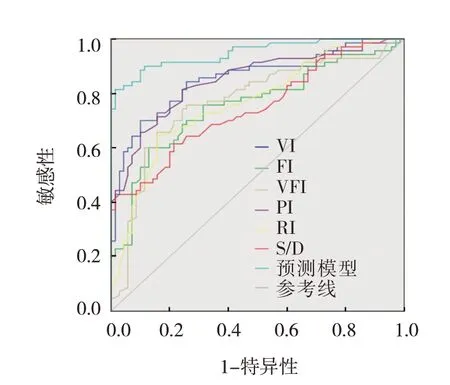
图1 胎盘植入预测模型预测胎盘植入发生的ROC曲线
3 讨论
常用的诊断胎盘植入的影像学检查为超声检查,二维、三维、彩色多普勒超声在胎盘植入的诊断中敏感性和特异性也不尽相同,二维超声无法预测胎盘植入的深度[9]。彩色多普勒超声操作简单、安全无创、检查范围广,可反复多次重复检查,且检查费用较低,在胎盘植入的诊断中应用也较多,但缺乏特异性[10]。新型超声技术3D-PDU同时具有三维和能量多普勒超声的优点,对于血管分布和血流情况的呈现立体、直观的特点[11],观察及评估新生血管和血管侵袭程度的效果较好,同时对低速血流也较为敏感,无角度依赖性,能够通过不同的角度显示胎盘低流速、低流量血流情况[12-13]。目前关于3D-PDU胎盘血管化指数及子宫动脉血流动力学参数联合用于胎盘植入的相关研究缺少报道,因此,本研究将3D-PDU及彩色多普勒超声联合应用于胎盘植入的诊断,主要探讨胎盘血管化指数及子宫动脉血流动力学参数与胎盘植入的相关性。
本研究结果显示,胎盘植入组年龄≥35岁、有流产史、前置胎盘、剖宫产史的孕妇占比高于无胎盘植入组。多项研究表明[14-16],年龄与女性生理变化显著相关,女性体内的胶原纤维随年龄增长而渐渐增多,胶原蛋白替代了子宫平滑肌,导致动脉硬化,胎盘供血不足,为汲取更多营养,胎盘代偿性增加并迁移到子宫颈内口,增加了胎盘植入风险;高龄孕妇还存在基础代谢率下降的问题,容易因肥胖而造成胎盘病理损伤,引起胎盘植入。人工流产及剖宫产等宫腔操作能够损伤子宫内膜及肌层,引发子宫内膜炎,可影响再次妊娠时底蜕膜的发育,导致血管生理性重塑障碍,供血不足,胚胎发育需求不能被满足,为汲取更多营养,子宫肌层受到滋养细胞的大量侵袭,使胎盘向上迁移,因此增加胎盘植入、前置胎盘等并发症的发生风险[17]。有研究发现[18],人工流产或剖宫产次数越多,内膜组织损伤越严重,也越容易发生胎盘植入。前置胎盘是指胎盘位置异常,低于胎先露的情况,其具体机理尚不明确,但前置胎盘和胎盘植入的发生机制相似,主要原因是胎盘绒毛侵入子宫肌层[19]。一方面,蜕膜发育不全,血供不足,胎盘代偿性增大形成前置胎盘;另一方面胎盘附着于子宫下段,子宫下段肌层受到拉伸,并且底蜕膜较薄,胎盘绒毛极易因为吸收养分而导致底蜕膜被穿透,进而引发胎盘植入[20]。研究表明[21],当妊娠孕妇既存在前置胎盘,又有剖宫产史时,胎盘组织附着于瘢痕位置会使得胎盘植入的发生率大大提高。也有研究显示[22],胎盘位置可显著影响胎盘植入的严重程度,胎盘位置偏低的患者更有可能发生严重胎盘植入。
3D-PDU通过分析多普勒信号振幅成像,无须依赖角度,只由红细胞散射能量决定是否显示,因此低流量、低速度的血流也可以显示,其能直接、清晰地反映血管的空间位置和完整的血管网[23]。3D-PDU在乳腺、心脏、肾脏等多个领域均有应用,也可以用来评估子痫前期、宫内生长受限、胎盘灌注等[24]。3D-PDU评估血流的参数主要有VI、FI、VFI,VI为感兴趣区彩色体素在所有体素中的占比,是血管稀疏程度的体现;FI为指定区域所有彩色体素的平均值,是血流信号平均强度的体现;VFI是VI乘FI得到的数值,为血管和血流的灌注情况[25]。本研究结果显示,有胎盘植入的孕妇VI、FI、VFI高于无胎盘植入的孕妇,说明胎盘植入导致相应位置的血管数增多,血管化程度较高,胎盘植入与胎盘血管化指数相关。
子宫动脉在子宫血液循环中起重要作用,监测PI、RI、S/D等子宫动脉血流动力学参数可用于妊娠情况的判断及妊娠结局的预测[26]。虽然目前没有研究明确证实PI、RI、S/D与胎盘疾病的关系,但子宫动脉血流动力学参数改变可能预示胎盘受损,武轶伦等[27]研究表明,处于妊娠中晚期而且合并有前置胎盘的孕妇PI、RI、S/D出现异常下降。CHO等[28]研究也认为,与单纯前置胎盘孕妇相比,合并胎盘植入的前置胎盘孕妇PI值更低。韩瑞征[29]等在研究前置胎盘孕妇子宫弓状动脉血流时发现,发生胎盘植入的孕妇PI、RI低于无胎盘植入的孕妇,而动脉收缩期峰值流速较高,子宫动脉血流动力学参数对胎盘植入的诊断具有一定价值。与本研究中胎盘植入组S/D高于无胎盘植入组,PI、RI低于无胎盘植入组的结果相近,分析原因可能与滋养细胞过度侵袭子宫动脉、血管壁弹性和血流阻力降低、血流速度加快等改变影响胎盘侵袭肌层的深度相关。
另外,本研究通过绘制ROC曲线得出VI、FI、VFI、PI、RI、S/D预测胎盘植入发生的曲线下面积分别为0.853、0.756、0.771、0.850、0.765和0.747,临界值分别为21.315、35.575、11.475、0.735、0.605和3.405,并建立预测模型,将各项指标代入Logit(P)= -35.687 + 1.177XVI+ 1.133XFI+ 1.097XVFI+1.346XPI+ 1.135XRI+ 1.249XS/D中,经ROC分析证实其敏感性高于各项指标单独预测,监测VI、FI、VFI、PI、RI、S/D等指标对于胎盘植入的诊断具有较好的参考价值。同时为探讨胎盘植入的危险因素,本研究进行了多因素Logistics逐步回归分析结果证实,年龄≥ 35岁、流产史、前置胎盘、剖宫产史、VI ≥ 21.315、FI ≥ 35.575、VFI ≥ 11.475、PI ≤0.735、RI ≤ 0.605、S/D ≥ 3.405是胎盘植入发生的危险因素。也有研究认为阴道出血、多胎妊娠、子宫手术史、妊娠期疾病等因素也会导致胎盘病理损伤、生理功能下降,从而引发各种妊娠期并发症[30],但本研究中这些患者数量较少,因此没有表现出明显差异,后续还可增加这些类型的患者例数,扩大研究,以提高胎盘植入的确诊率。此外,本研究属于回顾性分析,无法验证预测模型的效果,后续可开展前瞻性研究验证其预测价值。
综上所述,年龄、流产史、前置胎盘、剖宫产史、VI、FI、VFI、PI、RI、S/D与胎盘植入的发生关系密切,临床需关注这些因素提高胎盘植入的检出率。

