不同月经稀发程度多囊卵巢综合征患者AMH、FSH、LH、E2水平观察*
朱念念,冯小凤,许舒晴
[安徽医科大学附属滁州医院(滁州市第一人民医院) 妇产科,安徽 滁州 239001]
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种病因不明且临床呈现高度异质性的生殖内分泌疾病,约5%~10%育龄期妇女受累,在不排卵的不孕症病例中约占30%~60%,以月经失调、雄激素过多、卵巢多囊样改变等为主要临床特征[1]。PCOS发病机制较为复杂,可能与遗传因素、胰岛素抵抗、高雄激素血症、慢性炎症、肠道菌群、内分泌异常、代谢异常等机制有关[2-3]。研究表明,PCOS作为一种可反映不同潜在病因与临床表现的异质性疾病,月经模式多样,主要表现为月经频发(月经周期< 21 d)、月经规律(月经周期21~35 d)、月经稀发或闭经(月经周期>35 d)及不规则子宫出血(经期明显延长且经间期发生出血情况)[4]。近年来尽管有报道分析PCOS患者月经周期异常与糖脂代谢、胰岛功能的关系,认为相较于月经频发和月经规律PCOS患者,月经稀发或闭经PCOS患者糖脂代谢及胰岛功能异常程度更高,发生胰岛素抵抗、高脂血症的风险也更高,但关于不同月经稀发程度PCOS患者代谢及性激素水平变化及可能存在的临床意义仍缺乏高质量的临床研究[5]。为此,本研究探究不同月经稀发程度PCOS患者代谢和性激素水平变化及其临床意义,旨在分析月经稀发程度与糖脂代谢和性激素的相关性,为该病诊治提供参考。
1 资料与方法
1.1 研究对象
选取2018年1月—2022年5月安徽医科大学附属滁州医院收治的240例PCOS患者,根据患者月经不同稀发程度分为A组(月经周期36~90 d)150例、B组(月经周期91~180 d)56例和C组(月经周期>180 d)34例。纳入标准:①满足PCOS诊断标准[6];②育龄期女性,18~45岁,月经稀发或闭经;③临床资料齐全。排除标准:①重要脏器严重疾病;②肾上腺、甲状腺等内分泌疾病或其他可诱发排卵障碍的疾病;③全身炎症疾病、血管异常性疾病、恶性肿瘤;④围绝经期;⑤入组半年内接受过PCOS有关治疗或使用过影响内分泌指标的药物;⑥精神障碍。本研究经医院医学伦理委员会审核批准(伦理批号:2018-03号),患者及家属签署知情同意书。
1.2 研究方法
1.2.1 基线资料收集 收集所有PCOS患者基线资料,包括年龄、体质量指数(body mass index,BMI)、腰臀比等。
1.2.2 代谢指标检测 采集所有PCOS患者月经第2~5天的空腹静脉血,离心处理后检测代谢指标。空腹血糖(fasting blood glucose,FBG)采用葡糖氧化酶法(试剂盒购自浙江夸克生物科技有限公司)检测,空腹胰岛素(fasting insulin,FINS)采用化学发光法(试剂盒购自潍坊市康华生物技术有限公司)检测,总胆固醇(total cholesterol,TC)、甘油三酯(Triglyceride,TG)采用酶定量法(试剂盒购自浙江福康生物技术有限公司)检测,血尿酸(uric acid,UA)水平采用尿酸酶法检测(试剂盒购自宁波天康生物科技有限公司),并以稳态模型法评估胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR),计算公式:HOMA-IR=FBG×FINS/22.5,检测仪器为日本日立公司的7600型全自动生化分析仪。患者B超提示未见明显卵泡发育时,可直接采集空腹静脉血检测以上代谢指标。
1.2.3 性激素指标检测 采集所有PCOS患者月经第2~5天的空腹静脉血,离心处理后检测性激素指标。血清抗米勒管激素(antimüllerian hormone,AMH)水平采用酶联免疫吸附试验(试剂盒购自美国R&D Systems公司)检测,检测仪器为7600型全自动生化分析仪;卵泡刺激素(ollicle-stimulating hormone,FSH)、促黄体生成素(luteinizing hormone,LH)、雌二醇(Estradiol,E2)、睾酮(Testosterone,T)、泌乳素(Prolactin,PRL)、性激素结合球蛋白(sex hormone-binding globulin,SHBG)水平均采用电化学发光法(试剂盒购自德国罗氏诊断有限公司)检测,同时计算游离雄激素指数(free androgen index,FAI),计算公式:FAI=T/SHBG×100%,检测仪器为德国西门子公司的ADVIA Centaur XP型全自动化学发光免疫分析仪。患者B超提示未见明显卵泡发育时,可直接采集空腹静脉血检测以上性激素指标。
1.3 统计学方法
数据分析采用SPSS 25.0统计软件。计量资料以均数±标准差(±s)表示,多组比较用方差分析,进一步两两比较行LSD-t检验;计数资料以构成比或率(%)表示,比较用χ2检验;相关性分析采用Spearman法。P<0.05为差异有统计学意义。
2 结果
2.1 3组基线资料比较
3组年龄、腰臀比、多毛占比,经方差分析或χ2检验,差异均无统计学意义(P>0.05)。3组BMI比较,经方差分析,差异有统计学意义(P<0.05)。A组BMI低于B组和C组(P<0.05),B组BMI低于C组(P<0.05)。见表1。

表1 3组基线资料比较
2.2 3组代谢指标比较
3组TC比较,经方差分析,差异无统计学意义(P>0.05)。3组HOMA-IR、TG、UA比较,经方差分析,差异均有统计学意义(P<0.05)。A组HOMAIR、TG、UA低于B组和C组(P<0.05);B组HOMAIR、TG、UA低于C组(P<0.05)。见表2。
表2 3组代谢指标比较 (±s)
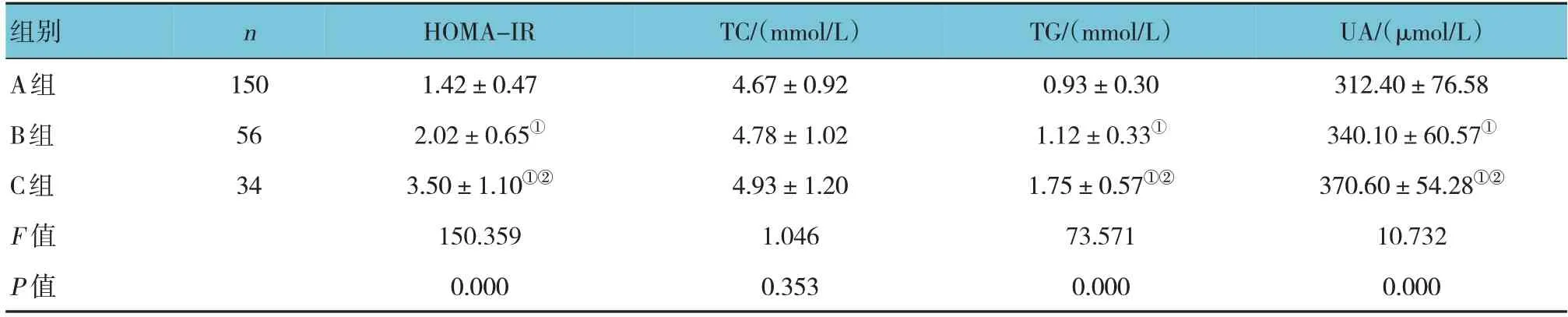
表2 3组代谢指标比较 (±s)
注:①与A组比较,P <0.05;②与B组比较,P <0.05。
组别A组B组C组F 值P 值UA/(μmol/L)312.40±76.58 340.10±60.57①370.60±54.28①②10.732 0.000 n 150 56 34 HOMA-IR 1.42±0.47 2.02±0.65①3.50±1.10①②150.359 0.000 TC/(mmol/L)4.67±0.92 4.78±1.02 4.93±1.20 1.046 0.353 TG/(mmol/L)0.93±0.30 1.12±0.33①1.75±0.57①②73.571 0.000
2.3 3组性激素指标比较
3组AMH、FSH、E2、PRL比较,经方差分析,差异均无统计学意义(P>0.05)。3组LH、T、FAI比较,经方差分析,差异均有统计学意义(P<0.05)。A组LH、T、FAI低于B组和C组(P<0.05),B组LH、T、FAI低于C组(P<0.05)。见表3。
表3 3组性激素指标比较 (±s)
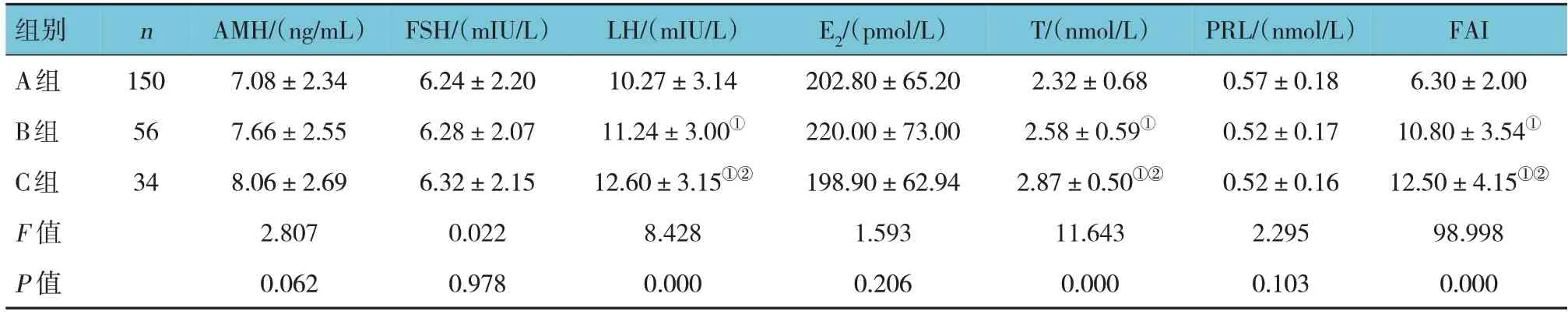
表3 3组性激素指标比较 (±s)
注:①与A组比较,P <0.05;②与B组比较,P <0.05。
组别A组B组C组F 值P 值FAI 6.30±2.00 10.80±3.54①12.50±4.15①②98.998 0.000 n 150 56 34 AMH/(ng/mL)7.08±2.34 7.66±2.55 8.06±2.69 2.807 0.062 FSH/(mIU/L)6.24±2.20 6.28±2.07 6.32±2.15 0.022 0.978 LH/(mIU/L)10.27±3.14 11.24±3.00①12.60±3.15①②8.428 0.000 E2/(pmol/L)202.80±65.20 220.00±73.00 198.90±62.94 1.593 0.206 T/(nmol/L)2.32±0.68 2.58±0.59①2.87±0.50①②11.643 0.000 PRL/(nmol/L)0.57±0.18 0.52±0.17 0.52±0.16 2.295 0.103
2.4 PCOS患者月经稀发程度与代谢及性激素指标的相关性分析
PCOS患者月经稀发程度与HOMA-IR、TG、UA、LH、T和FAI均呈正相关(rs=0.764、0.560、0.558、0.650、0.512和0.678,均P<0.05)。
3 讨论
PCOS作为一种发病机制较为复杂的高度异质性代谢性综合征,遗传因素被认为是其发病的主要原因,同时还与雄激素代谢异常、胰岛素抵抗、慢性炎症、内分泌和代谢异常等因素有关,已成为了女性高雄激素、月经失调及排卵障碍性不孕的重要诱因[7-8]。PCOS以排卵功能障碍、高胰岛素血症/胰岛素抵抗、高雄激素血症、LH/FSH比例失衡等为主要临床症状,若治疗不及时,不仅可诱发冠心病、高血压病等心血管疾病,还会引发肥胖症、血脂异常、不育、子宫内膜功能障碍、子宫内膜癌等情况,因此重视PCOS并及时诊断与治疗尤为重要[9-10]。研究表明,PCOS患者月经失调主要表现为月经稀发或闭经,通常由无排卵或稀发排卵所致,此种情况通常在围青春期可见,受累女性月经初潮稍微延后或正常,随后不规律月经周期出现;部分患者最初月经周期可能看似规律,但随后存在月经不规则且体重增加情况[11]。近年来尽管有报道证实PCOS患者月经周期与内分泌代谢失调有关,但研究对象多侧重于月经规则、月经稀发及闭经PCOS患者,关于不同月经稀发程度PCOS患者代谢及性激素水平变化及其可能存在的临床意义尚未明确[12-13]。因此,本研究对此方面展开初步探究。
本研究结果显示,A组HOMA-IR、TG、UA、LH、T、FAI低于B组和C组,而B组HOMA-IR、TG、UA、LH、T、FAI低于C组,提示月经稀发程度与代谢和性激素水平异常有关。研究表明,诸多PCOS患者伴有促性腺激素的分泌动力学异常情况(主要表现为血清LH水平升高、LH脉冲频率及幅度也明显升高),同时还存在血清雄激素水平升高情况(主要表现为血清T水平升高);而与月经规律患者相比,月经稀发或闭经患者生殖内分泌异常现象更为明显,更易合并高雄激素血症和高LH,并且糖脂代谢紊乱与胰岛素抵抗程度更为严重[14-15]。还有研究表明,虽然PCOS患者不同月经模式通常由排卵障碍所致,但各月经模式的不同意味着糖脂代谢异常、高雄激素之间的相互作用机制亦不同;相较于月经规律PCOS患者,月经稀发及闭经PCOS患者在性激素、糖脂代谢水平与胰岛功能方面呈现出明显差异性,极易出现高雄激素血症和高LH,且糖脂代谢紊乱与胰岛素抵抗程度更为明显[16-17]。而月经稀发程度较严重的PCOS患者,其性激素及代谢水平异常情况更为明显,推测这可能与PCOS患者月经异常的发生机制(包括代谢异常、下丘脑-垂体-卵巢-肾上腺轴异常等机制)有关。
本研究结果显示,PCOS患者月经稀发程度与HOMA-IR、TG、UA、LH、T、FAI均呈正相关,进一步证实月经稀发程度与性激素及代谢水平异常有关。研究表明,月经稀发程度越严重的PCOS患者存在着更为严重的内分泌激素紊乱与代谢功能异常情况,包括慢性炎症反应、高胰岛素血症、胰岛素抵抗等,其可能通过影响下丘脑-垂体-卵巢轴功能等介导PCOS的发生、发展[18-20]。PCOS以血清胰岛素水平上升、胰岛功能下降为重要病理生理改变,通常高胰岛素血症会导致卵巢过度分泌性激素,并刺激垂体分泌大量LH,致使卵巢生物合成增加,抑制肝脏SHBG合成,促使游离雄激素明显升高且活性强化,导致FAI升高,最终致使卵泡闭锁,引发排卵障碍,诱发月经稀发。此外,高雄激素可诱导腹壁与内脏脂肪大量蓄积,刺激儿茶酚胺不断分解脂肪,致使血浆中游离脂肪酸增加,诱发脂代谢紊乱,导致胰岛素抵抗加剧,最终构成恶性循环。因此,PCOS患者月经稀发程度越严重,其内分泌激素紊乱与代谢功能异常情况越明显,而分泌激素紊乱与代谢功能异常也会导致下丘脑-垂体-卵巢轴功能受到影响,从而促使PCOS进展,加剧月经稀发程度。后续在PCOS的诊治过程中临床不仅要关注月经稀发患者排卵障碍表现,还应重视其代谢水平监测,针对不同特点予个体化治疗。
综上所述,不同月经稀发程度PCOS患者的性激素和代谢水平存在明显差异,月经稀发程度越严重,性激素和代谢水平异常更为明显,临床诊治过程中应密切监测患者性激素和代谢水平,以便及时采取相应治疗措施。

