人釉原蛋白在不同pH值下体外自组装及矿化能力的研究
钟 秀,田 鲲
(1.西藏自治区人民政府驻成都办事处医院口腔科,四川 成都 610041;2.西南医科大学口腔医学院,四川 泸州 646000;3.四川省医学科学院·四川省人民医院口腔科,四川 成都 610072)
釉基质蛋白包括釉原蛋白(amelogenin,AM)和非釉原蛋白[1,2],全程参与釉质矿化的调控[3,4]。AM占釉基质蛋白的90%[5,6],在釉质发育时,其单体分级自组装形成纳米球、纳米链及纳米网状结构,形成引导羟基磷灰石(hydroxyapatite,HA)晶体生长的矿化骨架。牙釉质一经损害难以再生,目前临床治疗方法大多采用各种人工替代材料进行修复,但均难再现天然牙釉质的外观、精妙结构和各种性能。故研究者们将目光投向“仿生矿化”领域,致力于利用生物分子模板在体外引导牙釉质再生,其中AM备受关注。在AM调控晶体矿化的过程中影响因素众多,其中pH值是主要影响因素[7]。本研究着重探寻在人AM诱导HA晶体成核、生长的过程当中pH值的影响。
1 材料与方法
1.1 材料于2019年6月至2020年2月,收集正畸患者因治疗要求拔除的处在釉质发育阶段的下颌第三磨牙牙胚,全部取样均征得患者及其监护人同意,均由四川省医学科学院·四川省人民医院齿槽外科提供。Trizol RNA分离试剂、质粒提取试剂盒、pET-28a(+)载体、大肠杆菌BL21plys(赛默飞世尔科技有限公司)、SDS-PAGE凝胶配制试剂盒、Western Blot试剂盒(上海生工生物工程有限公司)、PBS、HCl、NaOH(天津市福晨化学试剂厂)、磷酸钨(河南锐欣实验用品有限公司)、Tris-HCl、MgCl2、CaCl2·H2O 、KH2PO4、KCl、NH4Cl、HEPES、NaF(武汉德晟生化科技公司)。透射电子显微镜(日本JEOL公司)、台式扫描电子显微镜(phenom公司)、X射线衍射仪(日本Rigaku公司)。本研究获得我院伦理委员会审批。
1.2 重组AM的表达从收集到的第三磨牙牙胚中提取出牙胚细胞的总RNA,设计AM引物如下。AM上游引物序列:5′-CGCGGATCCATGGGGACCTGGATTTT-3′,下游引物序列:5′- CGAGCTCTTAATCCACTTCCTCCCGC-3′。通过RT-PCR反转录、扩增得到AM的cDNA片段,与pET-28a(+)载体进行质粒构建后转入大肠杆菌BL21plys诱导表达,SDS-PAGE检测、Western Blot验证后纯化得到AM蛋白。
1.3 蛋白储备液及人工唾液的配制蛋白储备液:将纯化后的1 ml 0.5 mg/ml的AM溶于0.25 ml预冷pH=3.5的5 mM PBS中,配制成2 mg/ml的AM储备液,调节初始pH=3.5,4 ℃下溶解24 h以确保蛋白完全溶解,4 ℃下离心20 min去除灰尘和微粒杂质,-80 ℃冻存备用。人工唾液:含MgCl20.2 mM,CaCl2·H2O 1 mM,KH2PO44 mM,KCl 16 mM,NH4Cl 4.5 mM,HEPES 20 mM,预冷的0.1 M HC1和0.1 M NaOH分别调整人工唾液pH至6.4、7.4、8.4、9.4、10.4,使用前加入300 ppm NaF。
1.4 AM不同pH值下的体外自组装实验取20 μl pH=3.5的2 mg/ml AM储备溶液,用60 μl 5 mM PBS(pH分别等于5、6、7、8、9)稀释,调节溶液pH分别为5、6、7、8、9,添加5 mM PBS(pH分别等于5、6、7、8、9)定容为200 μl,得到200 μg/ml的不同pH值的AM溶液。分别取出20 μl蛋白溶液滴到碳支持膜正面,室温下分别孵育5、30 min。取出碳支持膜吸干水分,磷酸钨染色2.5 min。透射电镜下观察碳支持膜上AM的自组装情况。
1.5 AM在不同pH值下诱导HA晶体生成取20 μl 2 mg/ml的AM储备液加60 μl 50 mM Tris-HCl溶液(pH=7.4)稀释,用pH=8.0的50 mM Tris-HCl溶液调节pH=7.4,再加入pH=7.4的50 mM Tris-HCl定容到200 μl,得到最终浓度为200 μg/ml、pH=7.4的AM溶液。实验分组如下:①空白组:细胞爬片取出后不做任何处理,置于24孔板的2 ml pH=7.4的人工唾液中,密封后于37 ℃恒温培养箱孵育。②对照组:细胞爬片取出后,吸取20 μl 50 mM Tris-HCl溶液(pH=7.4)涂布于细胞爬片表面,室温下孵育30 min后转移至24孔板的2 ml pH=7.4的人工唾液中,密封后于37 ℃恒温培养箱孵育。③实验组:细胞爬片取出后,吸取20 μl 200 μg/ml、pH=7.4的AM溶液涂布于细胞爬片表面,室温下孵育30 min后分别转移至24孔板的2 ml pH=6.4(实验组1)、7.4(实验组2)、8.4(实验组3)、9.4(实验组4)、10.4(实验组5)的人工唾液中,密封,37 ℃恒温培养箱孵育。以上实验组每天更换新鲜人工唾液,4天后取出牙片,ddH2O反复清洗3次,室温自然干燥。
1.6 扫描电镜及X射线衍射分析采用台式扫描电镜观察孵育4天后的各组细胞爬片上沉积物的形貌,操作步骤为:吹净表面杂质,导电胶固定样品,喷金60 s,放入扫描电镜真空室进行观察并拍照。选择诱导结果最佳的实验组矿化产物进行X射线衍射分析,即采用X射线衍射仪对pH=7.4时AM诱导4天生成的晶体进行结构测试。
2 结果
2.1 蛋白表达结果纯化后的目的蛋白经过SDS-PAGE电泳分析,在23 kDa左右的位置出现了明显蓝色条带,与AM蛋白理论分子量相符,初步确定表达纯化了目的蛋白。Western Blot检测在23 kDa左右的位置也出现了相应条带,进一步说明目的蛋白为AM。见图1。

图1 目的蛋白表达检测结果 a:目的蛋白的SDS-PAGE分析图;b:目的蛋白的Western Blot检测图
2.2 AM在不同pH值下的自组装结果AM在pH=5的PBS溶液中孵育5 min后,AM单体形成的多聚体独立分布于溶液中(图2A红色箭头);继续孵育25 min,多聚体排列形成 “单链网状”结构(图2B白色框)。

图2 AM在不同pH值下自组装的透射电镜结果 a、b:pH=5; c、d:pH=6; e、f:pH=7; g、h:pH=8; i、j:pH=9
AM在pH=6的PBS溶液中孵育5 min,多聚体均匀散在分布,直径约为10 nm(图2C红色箭头);继续孵育25 min,有“双链网状”结构(图2D红色框)生成,边界较5 min时颜色更深更清晰(图2D白色箭头)。
AM在pH=7的PBS溶液中孵育5 min后,多聚体大部分散在均匀分布,少部分进一步聚集,有形成纳米球趋势(图2E红色箭头);继续孵育25 min,纳米球结构不明显,但多聚体的聚集趋势比pH=6时大,有“多链网状”结构(图2F红色框)生成,边界较5 min时颜色更深更清晰(图2F白色箭头)。
AM在pH=8的PBS溶液中孵育5 min后,单体形成的多聚体大部分散在均匀分布,边界较pH=7和pH=6时光滑清晰(图2G红色箭头),少部分有进一步聚集趋势(图2G红色框);继续孵育25 min,可见非常明显的纳米球生成,直径约50 nm(图2H白色框)。这些纳米球进一步聚集形成更大的球形多聚物(图2H红色框)、“串珠状” 结构(图2H蓝色框)等,并且有进一步组装成网状趋势(图2H黑色框)。
AM在pH=9的PBS溶液中孵育5 min后,部分多聚体仍然单独分布,另一部分有聚集形成纳米球趋势(图2I红色箭头);继续孵育25 min,有明显直径较大的“纳米球”结构生成,约100~150 nm(图2J红色框),大部分散在分布,少部分进一步聚集成“球状”(图2J黑色框)或“串珠状” (图2J白色框)。见表1及图2。

表1 AM在不同pH值下的自组装结果
2.3 AM在不同pH值下的矿化结果
2.3.1空白组及对照组的矿化结果 空白组细胞爬片仅可见无结构的片状、板状矿化物沉积;对照组细胞爬片可见由矿物离子形成的圆形的钙化球沉积,排列散乱无规则。与HA晶体及釉柱的针状、棒状结构完全不同。见图3。

图3 空白组及对照组矿化4天后的扫描电镜结果 a、b:空白组;c、d:对照组
2.3.2AM在不同pH值的人工唾液中的矿化结果 AM在pH=6.4的人工唾液中矿化4天后,诱导生成了直径为0.4~0.6 μm的粗大柱状矿化产物(图4A、B白色箭头),柱状晶体内无针状纤维的分级结构,与HA晶体的分级构造不同。同时可见散在的圆球形钙化小球(图4B红色框)。

图4 AM在不同pH值的人工唾液中矿化4天后的扫描电镜结果 a、b:pH=6.4; c、d:pH=7.4; e、f:pH=8.4; g、h:pH=9.4; i、j:pH=10.4
AM在pH=7.4的人工唾液中矿化4天后,生成了直径为100~150 nm,长度为2~2.5 μm的针状晶体(图4D白色箭头),针状晶体进一步接近平行地捆绑聚集成直径为0.5~2 μm的晶体束(图4C、D红色方框)。这种由纳米级微纤维进一步组装成更粗的晶体束纤维的过程与牙釉质七级结构中HA晶体纳米到微米级结构的组成过程十分相符。
AM在pH=8.4的人工唾液中诱导矿化4天后,生成了“花蕾状”结构(图4E、F红色框),由直径约为80~100 nm,长度约为300~500 nm的针状晶体聚集而成(图4F白色箭头),相互之间成角大。
AM在pH=9.4的人工唾液中诱导矿化4天后生成的晶体相对无序,虽然生成了“针状”纳米级纤维,但直径仅为50~90 nm,长度100~400 nm(图4H白色箭头),少部分聚集捆绑成“花蕾状”结构(图4G红色框),大部分呈“丛状”(图4H白色框)。
AM在pH=10.4的人工唾液中诱导矿化4天后,生成的晶体较前几组更短更细,直径约为20~40 nm,长度仅约80~100 nm(图4J白色箭头),排列疏松且无明显取向,呈“丛状”(图4J白色框),也有较小的“仙人球状” 结构(图4K红色框),与HA晶体近似平行排列的取向差别较大。
2.4 X射线衍射结果AM在pH=7.4的人工唾液中矿化4天后所得沉积物的X射线衍射光谱在2 θ衍射角为 25.8°,31.8°,33°和46.7°时出现衍射峰,与HA晶体(002)、(211)、(300)和(222)的特征峰一致,表明新沉积的矿物质是HA晶体。见图5。
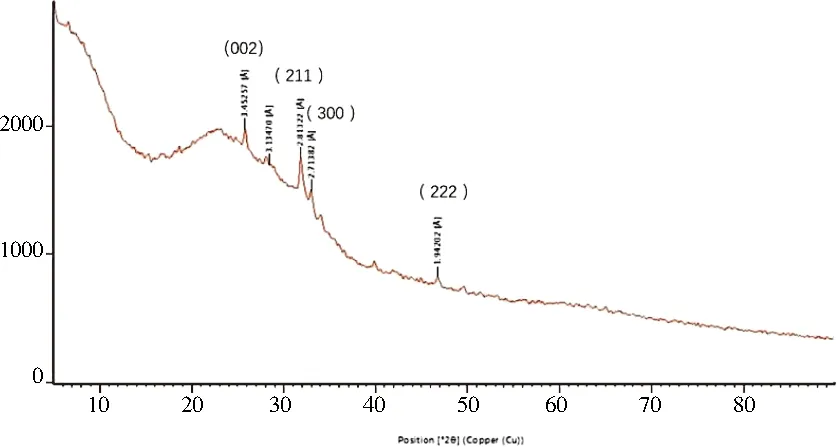
图5 AM在pH=7.4时矿化产物的X射线衍射结果
3 讨论
AM主要由疏水性N末端、疏水性中央区域和亲水性C末端三部分组成[8,9],其中C末端以及N末端高度保守,是AM的主要功能域。AM自组装形成纳米球、微带和纳米链[10],被认为是引导HA晶体形成的关键驱动力[11],而其钙结合基序-N端16位丝氨酸的磷酸化可以提高结合钙离子的能力,C末端结构域带高电荷,以有利的方式自身定位,允许其与HA晶体表面的离子相互作用,引导晶体形成[12]。
AM的自组装特性高度依赖pH值[13],在溶液中以pH依赖的方式自组装成超分子结构[14]。低pH值与AM的等电点相差甚远,酸性氨基酸侧链可以大部分被质子化,而其C端肽具有高浓度的酸性氨基酸,可通过带负电和带正电的氨基酸之间的静电相互结合相互作用,C端肽酸性氨基酸的质子化可能会影响蛋白质-蛋白质、蛋白质-矿物质的相互作用和自组装模式,从而影响AM的自组装及其对矿物质形成的调节作用[15]。
近年来,研究者们尝试使用AM作为仿生矿化模板体外诱导HA晶体的生成,对AM的结构、功能和作用的研究已经取得了重大进展。Fan等[16]发现重组猪AM rP172在pH=4.8,37 ℃条件下诱导生成了纳米棒状结构;Uskokovic等[17]使用重组人AM rH174在pH=7.4、37 ℃条件下诱导生成了片状晶体;Ruan等[18]发现重组猪AM rP172-壳聚糖水凝胶在300 ppm F-、pH=7.0、37 ℃条件下生成了形态接近HA晶体的针状纳米结构;Prozorov[19]研究表明重组鼠AM rM179在pH=7.4、37 ℃条件下可生成弯曲的条状晶体。些许实验条件的差异得到形貌各异的晶体结构,说明在AM调控晶体矿化的过程中影响因素众多,如诱导温度、F-强度、pH值、磷酸化等。其中,pH值是主要影响因素,但影响细节仍然存在争议,且矿化模板大多使用动物蛋白,其蛋白的分泌轨迹、组装方式以及作用机制与人AM有所区别。故本研究在体外表达了人的AM全长,并依据人AM在不同pH值下的体外自组装行为设置pH梯度,观察人AM在不同pH值下的体外矿化能力。
自组装实验表明AM在酸性条件下无明显聚集趋势,在中性、碱性条件下有典型纳米球结构生成。当pH=7时,聚集趋势变明显,直至pH=8时出现典型的自组装过程,但在这区间自组装行为变化的临界点并不清晰。故在设计进一步AM的体外矿化实验时:①摈弃过低的pH值(pH=5、6);②在pH值7~8选择pH=7.4(体内釉质发育分泌期的生理性pH);③设置梯度为1;④设置略偏酸性的pH=6.4增加容错率;⑤碱性条件设置几个pH值(碱性条件仍可见纳米球生成)。最终设计AM矿化实验的pH梯度为6.4、7.4、8.4、9.4、10.4。
AM在pH=6.4时诱导生成的柱状晶体内无针状纤维的分级结构,与HA晶体的分级构造不同,这与AM在酸性条件下自组装过程不明显的结果相符。AM在pH=7.4时在细胞爬片上诱导生成了直径为100~150 nm,长度为2~2.5 μm的针状晶体,这些针状晶体接近平行地进一步捆绑聚集成直径为0.5~2 μm的晶体束。这种由纳米级微纤维进一步组装成更粗的晶体束纤维的过程与牙釉质七级结构中HA晶体纳米到微米级结构的组成过程十分相符,同时与自组装实验预测在pH=7上升至pH=8之间出现AM典型功能性自组装过程的结论一致。AM在pH为8.4、9.4、10.4的碱性环境下,生成的针状晶体直径逐渐变小,长度也逐渐变短,且排列取向逐步趋向散乱,与HA晶体的排列差别较大,这与碱性条件下AM自组装形成的纳米球大部分散在分布的结果一致。
综上所述,AM的自组装过程和矿化能力对pH值非常敏感,在pH=7~8开始出现典型的多级自组装行为,在pH=7.4时可以成功诱导出与天然牙釉质相似的HA晶体。这一研究结果能为设置AM体外诱导牙釉质再矿化的最佳条件奠定基础。

