约氏疟原虫P.y17XL感染小鼠长链非编码RNA表达谱特征分析
吕荫宜,吴 双,田 爽,廖国艳,杜云婷,陈 光
世界疟疾报告指出,2021年约有2.47亿人感染疟疾,其中约619 000人死于严重并发症[1]。尽管使用了包括青蒿素在内的抗疟药物,严重疟疾患者的死亡率仍然很高[2-3]。更深入的了解疟疾感染宿主免疫系统和其他生理功能的平衡,对于制定有效干预措施以减少疟疾相关发病率和严重并发症至关重要[4]。然而,宿主与寄生虫之间的相互作用和共同进化为安全有效的疫苗设计和预防耐药提供了重要的背景知识。
长期研究发现,宿主体内所涉及的免疫信号通路以及疾病预后等过程中复杂的寄生虫-宿主相互作用途径和方式是感染性疾病防控的基础[5]。高通量测序技术恰恰提供了获得大量、全面、系统的病原体-宿主相互作用信息,从而使系统研究病原体-宿主相互作用以获得对其整体理解成为可能。长链非编码RNA (lncRNA) 长度大于200个核苷酸,虽然不编码蛋白质,但其可以调节基因表达。目前,转录组学领域中lncRNAs 在宿主防御中的作用机制研究尚少。仅有的部分研究表明,lncRNAs参与了宿主免疫功能和抗感染能力的调节[6]。关于疟原虫感染宿主细胞时lncRNAs表达谱的变化特征无相关报道。
本研究利用二代测序技术分析了鼠源致死性约氏疟原虫P.y17XL(Plasmodiumyoelii17XL)感染诱导的lncRNAs表达谱特征改变及其对疟疾感染宿主免疫调节的影响,探讨lncRNAs表达谱变化与疟疾感染进程和结局的相关性,确定疟原虫-宿主相互作用调控抗疟免疫的潜在机制。
1 材料与方法
1.1 实验动物、试剂来源及分组 6~8周龄的雌性BALB/c小鼠购自动物研究所(中国北京)。动物在 22 ℃~24 ℃和(50±5)% 湿度下保持12 h明暗循环。鼠源致死性约氏疟原虫(Plasmodiumyoelii17XL,P.y17XL)由Motomi Torii 博士(日本爱媛大学医学院分子寄生虫学系)提供。所有实验均按照当地动物伦理委员会的要求进行。将小鼠随机分为正常组和P.y17XL感染组。腹腔感染1×106P.y17XL寄生红细胞,动态进行小鼠尾静脉采血,制备薄血膜,Giemsa染色,监测原虫血症水平及生存率。固定时间点用异氟醚(0.6~0.8 L/min)麻醉小鼠取出脾脏,然后通过颈椎脱臼法处死所有小鼠。所有动物实验均经台州学院动物实验委员会批准(批准文号:TZXY2019-501)。所有动物均按照《实验动物管理条例》(1988.11.1)处死和人道对待。
1.2 LncRNA测序生物信息学分析
1.2.1 生物信息学分析流程 小鼠脾脏的RNA分离、文库制备和测序在北京诺禾致源公司完成,流程如图1。
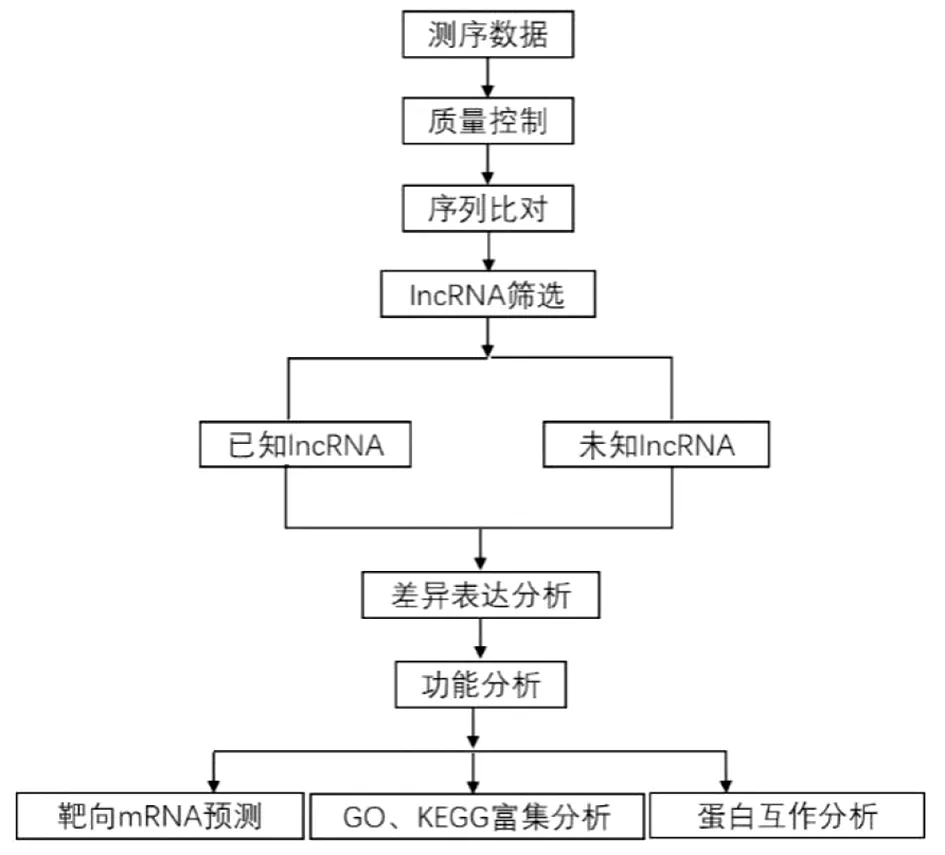
图1 生物信息学分析流程Fig.1 Process of bioinformatics analysis
1.2.2 LncRNAs差异表达谱及聚类分析 差异表达分析使用ballgown。从统计学意义的角度上考虑,将不同类型转录本 (lncRNA, TUCP和mRNA)整体进行差异分析,若分析中包含数据库注释的lncRNA,进一步将 lncRNA分为已知Annotated_lncRNA 和未知Novel_lncRNA。使用Bioconductor 软件包,进行层次聚类分析,调整后的P<0.05或P<0.05的转录本被指定为差异表达,不同颜色的区域代表不同聚类分组信息,同组内表达模式相近,可能具有相似的功能或参与相同的生物学过程。
1.2.3 LncRNA 共表达靶向mRNA预测 LncRNAs没有编码基因的潜力,它们通过调节相关基因发挥作用。目前,lncRNA与mRNA相互作用的潜在机制尚不清楚,lncRNA的生物学功能是通过其与蛋白质编码基因的共定位和共表达来预测的。采用Pearson相关系数法分析样本间lncRNAs与mRNAs的相关性,取相关性绝对值大于0.95的mRNAs基因进行功能富集分析预测lncRNAs的主要功能。
1.2.4 差异表达 lncRNAs 靶基因GO和KEGG通路富集分析 LncRNAs通过调控mRNAs的表达来实现其功能。目前,lncRNAs与mRNAs相互作用的机制尚未明确,我们通过其与蛋白编码基因的共表达相关性(co-expression)预测 lncRNAs的生物学功能。将与共表达中差异表达的lncRNAs基因分别进行GO和 KEGG富集分析和蛋白网络互作分析。GoSeq R包用于差异表达基因或lncRNAs靶基因的GO富集分析,以纠正基因长度偏差[7]。P<0.05的GO基因被认为在差异表达基因中显著富集。
1.3 统计学分析 本实验采用SPSS17.0进行统计学分析。使用Bioconductor软件包,进行层次聚类分析,调整后的P<0.05或P<0.05的转录本被指定为差异表达。采用Pearson相关系数法分析数据,检验水准为α=0.05。
2 结 果
2.1P.y17XL感染BALB/c小鼠的感染率和生存率 如图2所示,P.y17XL感染的BALB/c小鼠于感染后第6 d原虫血症水平高达39%~49%,所有小鼠均死亡(图 2A、2B)。

图2 P.y17XL感染小鼠红细胞感染率(A)与小鼠生存率(B)Fig.2 Parasitemia (A) and survival rate (B) of P.y17XL-infected BALB/c mice
2.2P.y17XL感染的BALB/c小鼠LncRNAs表达谱差异分析 我们使用火山图分析了lncRNAs的差异表达(图3A)。与正常对照组相比,P.y17XL感染的BALB/c小鼠中lncRNAs的表达上调132个,下调159个。本实验采用聚类分析确定不同转录物的表达模式,将不同实验组中不同转录本的FPKM值作为表达水平,进行层次聚类分析。不同颜色用于表示来自不同实验组的分组信息,同一组内相似的表达模式可能具有相似的功能或参与相同的生物学过程,在本研究中,与正常对照组小鼠相比,P.y17XL感染后 lncRNAs表达谱发生显著性差异表达(图3B)。
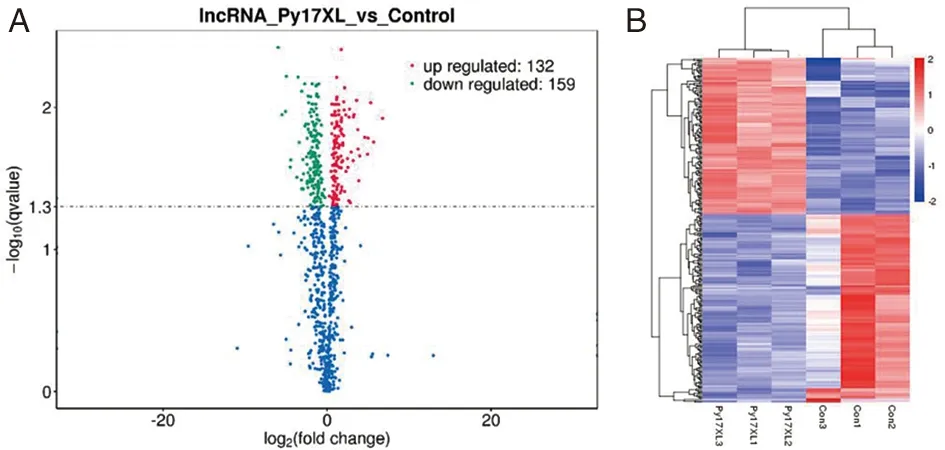
图3 火山图(A)和热图(B)分析P.y17XL感染的BALB/c小鼠lncRNAs差异表达Fig.3 Differential expression of lncRNAs in BALB/c mice infected with P.y17XL, displayed as a volcano plot and heatmap
2.3 LncRNAs 靶向mRNAs预测 我们通过对lncRNAs共表达的mRNAs基因进行功能富集分析,预测了疟原虫感染相关的差异lncRNAs的主要功能(表1)。
2.4 差异表达lncRNAs靶基因的GO和KEGG富集分析 GO分析发现12个差异表达 lncRNAs的富集,主要参与了“生物过程”、“细胞成分”和“分子功能”,且在“生物过程”和“细胞成分”中富集更为显著,如分子功能的正向调节、磷代谢过程的调节和囊泡的调节(图4A)。KEGG通路富集分析进一步确定上述差异表达lncRNAs的潜在生物学功能,预测相关免疫学信号通路和分子相互作用。气泡图显示了富集途径,其中包括疟疾、TGF-β信号通路和细胞因子-细胞因子受体相互作用(图 4B)。

图4 P.y17XL感染的BALB/c小鼠差异表达lncRNA靶基因的GO(A)和KEGG(B)富集分析Fig.4 GO and KEGG enrichment analysis of differentially expressed lncRNA target genes in BALB/c mice infected with P.y17XL
2.5 差异表达的lncRNAs靶向免疫相关信号通路分析 根据KEGG分析结果,我们发现12个差异表达的lncRNAs与总富集于疟疾、TGF-β信号通路、TNF信号通路和Toll样受体信号通路的蛋白编码基因共表达。为了进一步阐明12个差异表达的lncRNAs 在疟疾中的调控功能,我们确定了通路图中差异表达基因的分布(图 5)。这些结果提示12个差异表达的lncRNA靶基因通过调节免疫相关信号通路参与疟疾感染的发生发展。
3 讨 论
疟原虫在宿主体内难以清除主要与逃避人体免疫系统,并利用宿主的反应作为生理信号来调节生命周期,使其迅速适应宿主环境密切相关[8]。因此,寄生虫和宿主之间的相互作用对于寄生虫在生命周期的各个阶段建立感染和毒力是至关重要的。LncRNAs参与了多个物种之间的相互作用,例如载体-宿主-病原体相互作用。 LncRNAs 既可以是载体/宿主衍生的,也可以是由病原体编码的[9]。LncRNAs 作为基因表达的关键调节因子,参与大多数细胞过程。为了探究疟疾感染中lncRNAs表达谱特征,我们采用RNA-seq方法分析了P.y17XL感染的BALB/c小鼠差异表达的lncRNAs。结果发现132个上调和159个下调的lncRNAs与疟原虫感染相关(图3)。作为广泛调节细胞信号转导和基因表达的新兴介质,lncRNAs越来越受到关注。研究中检测到了一部分寄生虫感染后参与调控免疫相关基因的lncRNAs。LncRNAs在寄生虫入侵宿主过程中具有关键的调节作用。LncRNAs调节寄生虫和宿主中的基因转录、mRNA稳定性和翻译以及免疫反应[10]。我们预测了这些差异表达lncRNAs的潜在靶向mRNAs,以便通过与蛋白质编码基因的共表达来分析lncRNAs的生物学功能。 GO和KEGG富集分析显示,差异表达的lncRNAs参与了宿主免疫反应、细胞增殖、代谢和疾病相关转录物表达的调控,其中我们发现与疟疾感染中TGF-β信号通路、TNF信号通路和Toll样受体信号通路相关的明显差异表达的lncRNAs包括3个已知的和9个未知的lncRNAs,分别是ENSMUST00000146154.1、ENSMUST00000181191.1、ENSMUST00000202081.1、LNC_000258、LNC_000871、LNC_000962、LNC_002093、LNC_004354、LNC_006284、LNC_004518、LNC_004350和LNC_003730。虽然我们鉴定的一些lncRNAs可能是由其他因素诱导的,但它们仍然有可能成为疟原虫感染诱导免疫过程中的关键因素。
研究发现,疟原虫感染诱导的lncRNAs差异表达通过免疫相关信号通路改变了疟疾感染后宿主的免疫反应特征(图5)。寄生虫和宿主之间蛋白质-蛋白质相互作用是寄生虫持续存在于宿主体内的前提条件[11]。在长期的协同进化过程中,寄生虫可以通过复杂的通信来调控宿主免疫系统,从而使寄生虫能够控制宿主的生理功能和免疫稳态,有利于寄生虫在宿主体内的生存[12]。
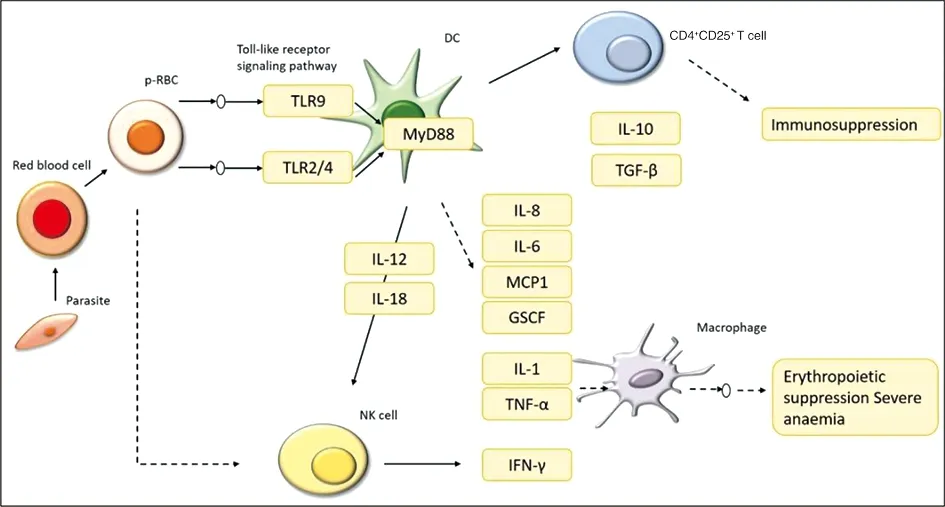
图5 P.y17XL感染小鼠的差异表达lncRNAs基因分布Fig.5 Distribution of differentially expressed lncRNA genes in P.y17XL infected mice
LncRNAs在免疫学领域研究是一个新兴的热点,有限的研究发现,lncRNAs作为一种新型调节剂,参与调节免疫系统中的相关基因表达。LncRNAs通过一种高度谱系特异性的方式调节免疫细胞功能和分化特征来调控染色质、RNA和蛋白质的作用[13]。本研究结果表明,疟原虫感染显著改变了宿主lncRNAs的表达谱特征,可能与疟疾感染过程和感染结局密切相关。因此,lncRNAs是疟原虫与宿主免疫系统交流的桥梁。在后续研究中,我们需要验证与免疫学相关基因表达相关的特定lncRNAs在疟疾感染中的特异性功能。
利益冲突:无
引用本文格式:吕荫宜,吴双,田爽,等.约氏疟原虫P.y17XL感染小鼠长链非编码RNA表达谱特征分析[J].中国人兽共患病学报,2023,39(8):733-738. DOI:10.3969/j.issn.1002-2694.2023.00.079
——“零疟疾从我开始”

