布鲁氏菌病M5、S2疫苗免疫血清半抗原-琼脂扩散试验方法检测评价
刘丽娅,剡文亮,张子荣, 宋 洁,郑 莹,马晓菁,叶 锋,谷文喜,易新萍,李 岩
布鲁氏菌是一种兼性胞内寄生菌,宿主范围广、对环境抵抗力较强,可以通过多种途径感染动物和易感人群[1-2],对畜牧业可持续发展和社会公共卫生安全造成巨大威胁。据世界卫生组织(WHO)报道,每年布病新增病例数超过50万[3]。人感染布病主要是通过接触患病动物及其动物产品。做好畜间布病防控,对于控制人间布病至关重要。疫苗接种是控制畜间动物布病的有效手段。目前应用于动物布病防控的疫苗主要为弱毒活疫苗,给人和动物带来一定的生物安全风险[4]。从病原学角度来说,核酸探针分子斑点杂交技术、聚酶链式反应(PCR)、巢式PCR方法、荧光探针实时定量PCR等方法可鉴别布鲁氏菌疫苗株与自然感染菌株[5-6]。但在免疫学层面目前尚无检测区分自然感染抗体与疫苗免疫抗体的方法,难以对布病自然感染动物进行准确诊断,有效剔除传染源[7]。
半抗原-琼脂扩散试验(NH-AGID)是基于脂多糖(S-LPS)和半抗原多糖(NH)的免疫原性差异建立的一种鉴别诊断方法[8-9]。国外研究报道,NH-AGID方法中NH抗原对布鲁氏菌疫苗Rev.1株和S19株的免疫抗体多呈阴性反应,检测特异性>90%,据此,应用NH-AGID方法可鉴别诊断布鲁氏菌疫苗Rev.1株和S19株的免疫抗体与感染抗体[10-11]。本研究拟使用我国羊用布病疫苗M5株和S2株免疫羊,在抗体持续期内应用NH-AGID方法进行检测,评估该方法区分M5和S2疫苗免疫抗体和感染抗体的特异性,以期为我国布病防控诊断提供技术支撑。
1 材料与方法
1.1 材 料
1.1.1 试剂与疫苗 布病活疫苗(M5株)购自天康生物制药有限公司(批号2021004);布病活疫苗(S2株)购自天康生物制药有限公司生产(批号2021031)。布病虎红平板凝集和试管凝集试验抗原购自青岛中创汇科生物科技有限公司;布病抗体琼扩法检测试剂盒,包含NH、LPS混合抗原、布鲁氏菌病阳性对照血清、21孔琼脂板等,购自青岛瑞尔唯特生物技术有限公司(批号 2112002)。均在有效期内使用。
1.1.2 实验动物 选取3~5月龄且健康状况良好的绵羊羔羊74只,免疫前采血,分离血清,经布病虎红平板凝集试验(RBT)和试管凝集试验(SAT)检测结果均为阴性。
1.2 方 法
1.2.1 分组免疫 将74只实验羊随机分为3组,即M5组24只、S2口服组25只、S2皮下组25只。按照M5、S2疫苗说明书规定的用法与剂量进行免疫。分组情况见表1。

表1 免疫分组情况Tab.1 Immunization groups
1.2.2 血清采集 免疫后7 d、14 d、21 d、30 d、60 d、90 d、120 d、150 d采血分离血清,并置于-20 ℃冰箱保存备用。
1.2.3 检测 按照国标GB 18646-2018,应用RBT方法对免疫血清样品进行初筛,阳性血清再经SAT方法进行确诊。确诊的免疫抗体阳性血清置于4 ℃备用。
1.2.4 NH-AGID试验 应用NH-AGID方法对确诊的免疫阳性血清进行检测。待检血清仅出现一条LPS沉淀线、未出现NH沉淀线,表明该动物检测LPS抗体阳性,NH抗体阴性,判定为免疫动物;出现NH和LPS两条沉淀线,表明该动物检测LPS抗体和NH抗体均为阳性,动物机体内布鲁氏菌为活动期或排菌期,判定为布鲁氏菌感染动物。LPS沉淀线和NH沉淀线位置见图1。

注:1为布鲁氏菌病阳性对照感染动物;4为免疫动物。图1 NH-GD方法结果显示图Fig.1 Result display diagram of the MH-Gd method
1.2.5 NH-AGID方法对M5和S2疫苗免疫抗体与感染抗体的鉴别诊断特异性 应用公式计算:特异性(Sp)=未检测出NH抗体血清数/疫苗免疫血清总数[12]。
2 结 果
2.1 疫苗免疫抗体阳性率 免疫后7 d~150 d内,对M5、S2疫苗组免疫羊进行采血并分离血清,应用RBT初筛、SAT确诊检测。SAT检测结果表明布鲁氏菌S2疫苗和M5疫苗免疫组的免疫抗体消长规律趋势基本一致。M5和S2株免疫绵羊14 d后均可检测到免疫抗体,且抗体阳性率最高;免疫60 d后免疫抗体阳性率呈现递减趋势。S2株疫苗口服组免疫动物在150 d时免疫抗体的血清学反应均为阴性,约12%的M5株和S2株疫苗皮下注射接种动物在150 d时免疫抗体血清学反应仍为阳性。SAT方法确诊的免疫阳性血清结果见表2。

表2 布病M5和S2株疫苗免疫羊血清SAT检测结果Tab.2 SAT test results for sheep serum immunized with the M5 and S2 strains of Brucella
2.2 M5疫苗免疫组NH-AGID试验结果 应用NH-AGID方法对M5疫苗免疫后7 d~150 d内经SAT确诊为阳性的免疫血清样品检测结果表明:免疫后7 d~150 d内NH-AGID方法对布鲁氏菌M5株疫苗免疫阳性血清的LPS抗体检出率为100%;NH抗体检出率为8.3%~29.2%,表明M5株疫苗免疫羊免疫后7 d~150 d一直存在免疫动物排菌情况,其中免疫后14 d达最高为29.2%,近70%的免疫动物此时处于排菌状态。该结果显示绵羊对M5株疫苗有较强的免疫应答。结果见表3。
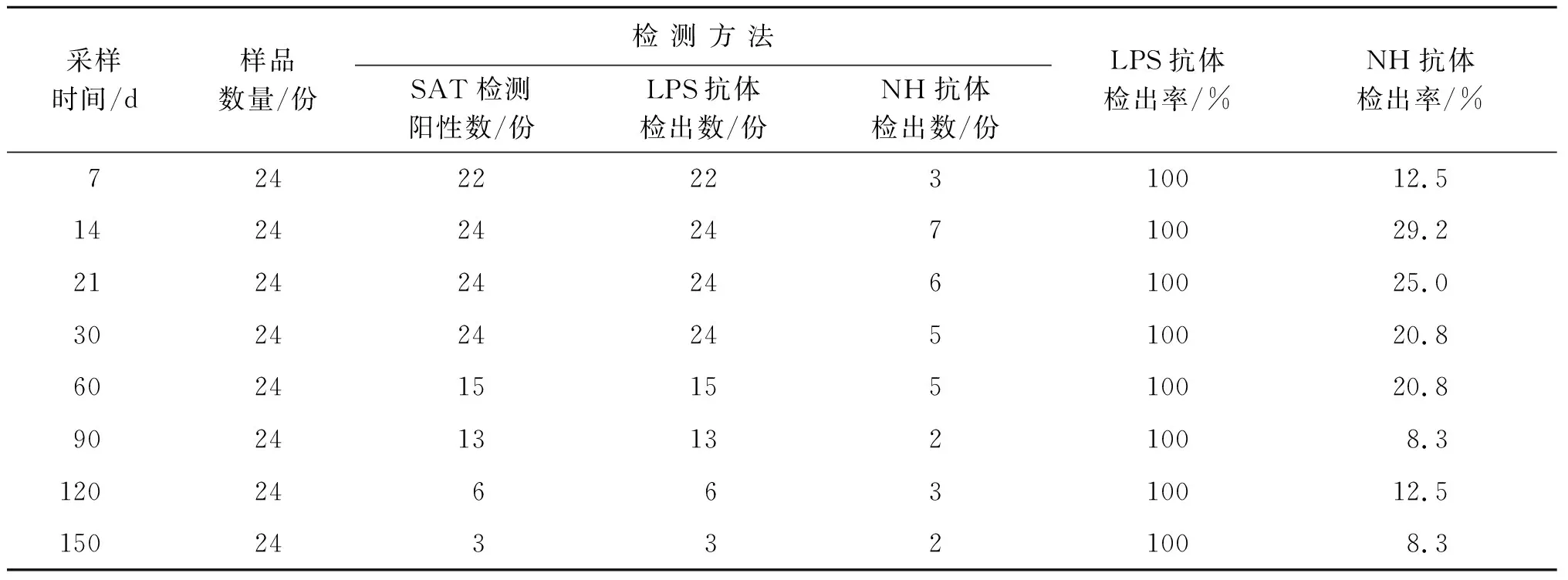
表3 布病M5株疫苗免疫羊血清NH-AGID检测结果Tab.3 NH-AGID test results for sheep serum immunized with the M5 strain of Brucella
2.3 S2疫苗免疫组NH-AGID试验结果 应用NH-AGID方法对S2疫苗免疫后7 d~150 d内经SAT确诊为阳性的免疫血清样品检测结果表明:布鲁氏菌S2株灌服免疫组免疫阳性血清与NH抗原呈阴性反应,检测特异性为100%。LPS抗体检出率为31.2%~66.7%,其中免疫后21 d LPS的检出率最低仅为31.2%,近65%的S2免疫动物未检出LPS抗体。
布鲁氏菌S2株皮下注射免疫组免疫后60 d内,免疫阳性血清的NH抗体检出率为4.5%~20%,表明S2株疫苗皮下注射组免疫后60 d内存在免疫动物排菌现象;免疫后90~150 d NH抗体检出率为0。LPS抗体检出率为45.4%~100%。结果见表4。
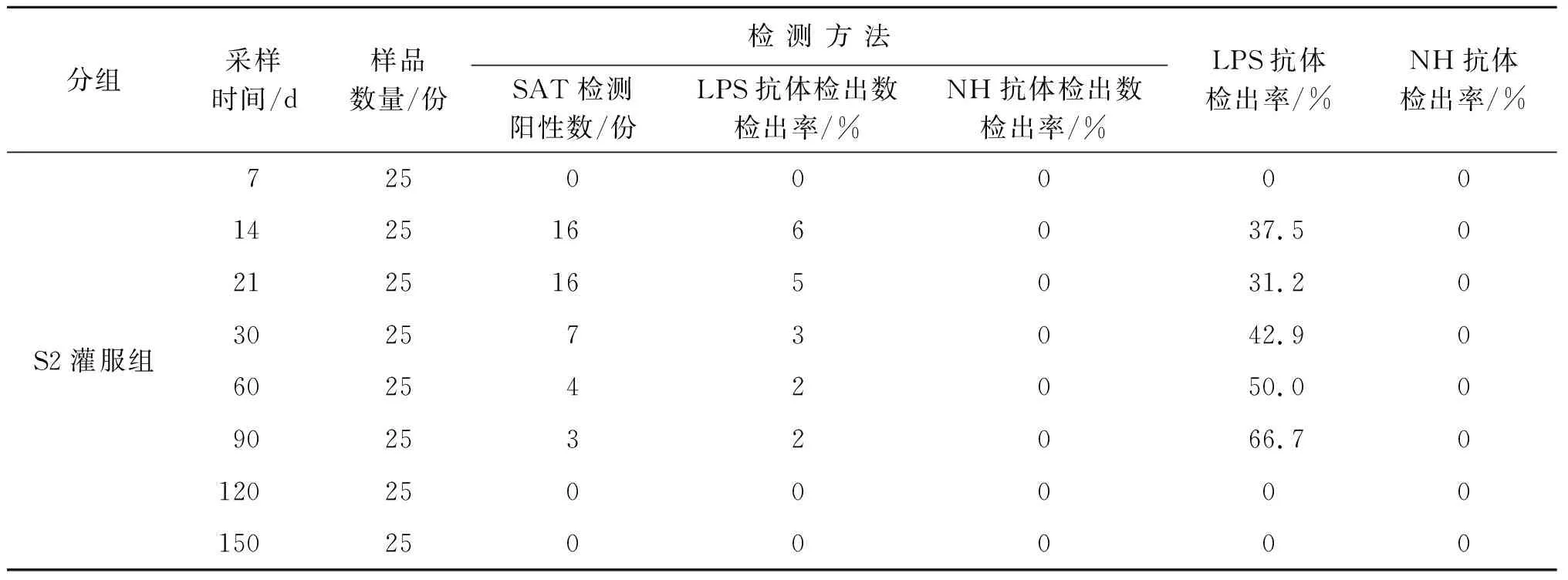
表4 布病S2株疫苗免疫羊血清NH-AGID检测结果Tab.4 NH-AGID test results for sheep serum immunized with the S2 strain of Brucella
2.4 NH-AGID方法特异性 共检测M5疫苗免疫抗体阳性血清192份,检出NH抗体血清数为33份,NH-AGID方法检测M5疫苗免疫抗体与感染抗体的鉴别诊断特异性为82.8%。检测S2疫苗免疫抗体阳性血清400份,检出NH抗体血清数为14份,NH-AGID方法检测S2疫苗免疫抗体与感染抗体的鉴别诊断特异性为96.5%。
3 讨 论
生产实践中因无法区分布鲁氏菌病自然感染动物和免疫动物,造成部分假阳性动物误杀,真阳性动物漏杀,不仅带来巨大的经济损失,还严重阻碍了布鲁氏菌病的净化进程。世界动物卫生组织(World Organization for Animal Health,OIE)《陆生动物诊断试验和疫苗手册》指出,NH-AGID方法适用于布病免疫地区反刍动物的鉴别诊断。应用该方法可甄别出畜群中的布鲁氏菌病自然感染动物,为布鲁氏菌病防控提供技术支撑。该方法中光滑型LPS抗原和天然半抗原(NH)大多从牛种和羊种布鲁氏菌中获得,是布鲁氏菌抗原中的两种重要检测标识物[13]。LPS抗原免疫原性强,光滑型布鲁氏菌均能刺激机体产生LPS抗体。NH抗原因缺少LPS的免疫核心位点使得其免疫原性较弱[14],布鲁氏菌病感染动物在布鲁氏菌活动期或排菌期可持续刺激机体产生NH抗体。NH-AGID方法应用LPS抗原和NH抗原检测血清中的抗体,由于LPS抗原分子量大、扩散慢,在靠近中央抗原孔出现沉淀线;NH抗原分子量小、扩散快,靠近被检血清孔出现沉淀线。据此,可根据抗原扩散速度差异而形成沉淀线位置不同来鉴别布鲁氏菌感染抗体和疫苗免疫抗体。本研究应用NH-AGID方法对M5株疫苗免疫阳性血清进行检测,LPS检出率为100%,NH抗原对M5疫苗的免疫抗体部分呈阳性反应,NH抗体检出率介于8.3%~29.2%。研究表明NH抗体的产生与布鲁氏菌排出情况密切相关[15]。部分免疫M5株疫苗血清检出NH抗体,可能与M5疫苗毒力较强有关[16]。NH-AGID是否适用于M5疫苗抗体与感染抗体的鉴别诊断,尚需对该疫苗菌株的毒力、免疫途径、免疫剂量等方面进一步研究。本研究结果显示该方法应用于M5疫苗免疫后的鉴别诊断特异性为82.8%。
通过灌服、皮下注射两种不同免疫方式和免疫剂量对适龄羔羊进行S2疫苗免疫接种,获得S2疫苗免疫阳性血清,应用NH-AGID方法进行检测,表明其对S2株疫苗免疫血清的鉴别诊断特异性为96.5%。S2疫苗灌服免疫后阳性血清与NH抗原呈阴性反应,其鉴别诊断特异性达100%。但与文献报道NH-AGID方法能够鉴别S2免疫背景下布病感染抗体和疫苗免疫抗体不同的是[17],S2疫苗皮下注射组免疫后部分阳性血清与NH抗原呈阳性反应,NH抗体检出率为4.5%~20%。NH-AGID方法对S2疫苗两种不同免疫方式获得的阳性血清LPS抗体检出率均低于M5疫苗免疫阳性血清的LPS抗体检出率,究其原因,推测S2疫苗与牛、羊布鲁氏菌的LPS抗原反应原性可能存有差异。NH-AGID方法仅适用于反刍动物,LPS和NH抗原主要提取自光滑型牛、羊种布鲁氏菌。该方法对猪种布鲁氏菌S2疫苗中的LPS和NH抗体的反应原性,以及猪种S2株跨宿主感染后的鉴别诊断特异性尚待进一步研究证实。
本文研究结果表明,NH-AGID方法对我国现阶段应用的羊用布鲁氏菌疫苗M5株和S2株的鉴别诊断应用还存在一定缺陷。由于NH-AGID方法对免疫抗体与自然感染抗体的鉴别诊断能力与不同疫苗的免疫背景、疫苗毒力、免疫剂量、免疫途径或其他等多方面因素相关,因此还需进一步研究并明确该方法在我国现有S2、M5疫苗免疫背景下的适用范围和条件。NH-AGID方法可鉴别出布病感染且处于布鲁氏菌活动期或排菌期的动物,有助于及时清除畜群中的布病传染源,有效促进动物布病的防控与净化。同时布病防控应采取多法并存、相互补充,以“One Health”为理念[18],从动物无疫、人类健康和环境生物安全角度出发,切实推进我国布病防控工作的顺利进行。
利益冲突:无
引用本文格式:刘丽娅,剡文亮,张子荣,等.布鲁氏菌病M5、S2疫苗免疫血清半抗原-琼脂扩散试验方法检测评价[J].中国人兽共患病学报,2023,39(8):766-771. DOI:10.3969/j.issn.1002-2694.2023.00.083

