伤寒沙门菌hns基因缺失株的构建及其对毒力基因表达的影响
顾丽萍,丁 超,徐国新,朱婉秋, 陈 龙
伤寒沙门菌(Salmonellaentericaserovar Typhi,S.Typhi)属于肠杆菌科沙门菌属,是一种革兰阴性杆菌,常通过污染的食物或水进入人体消化道,侵袭回肠与盲肠的肠道上皮细胞,破坏肠屏障,经肠壁淋巴组织进入肠系膜淋巴组织。伤寒沙门菌能逃避巨噬细胞杀伤,在巨噬细胞中存活,并经淋巴及血液循坏扩散至全身组织,引起系统性感染[1-2]。鼠伤寒沙门菌等其他沙门菌属细菌感染人体仅产生消化道症状,伤寒沙门菌独特的致病机制是由其基因组决定的,后者通过基因的水平转移(horizontal gene transfer, HGT)获得了大量的毒力基因,包括致病岛1(SalmonellaPathogenicity Island 1,SPI-1)、致病岛2(SPI-2)等沙门菌属普遍携带的毒力基因[3],以及致病岛7等伤寒沙门菌特有的毒力基因[4]。
HNS(histone-like nucleoid-structuring protein)是一种拟核结构蛋白,其编码基因hns大小414 bp,广泛存在于多种革兰阴性杆菌中,参与细菌基因组装配并调控多种基因转录表达,通过水平转移的毒力基因往往被HNS抑制[5-6]。基因的水平转移赋予了致病菌新的毒力、耐药与代谢方式[7]。但外源性毒力基因的过度表达会破坏细菌代谢平衡,不利于细菌生长[8-9]。HNS等负向调控因子通过沉默毒力基因,抑制其表达,从而缓冲这些基因过分表达带来的不利影响[10]。鼠伤寒沙门菌中的研究显示,敲除hns基因后,致病岛1和致病岛2上的毒力基因表达上调[11-12]。hilA、invF和ssrB、ssaB分别是沙门菌属普遍存在的SPI-1和SPI-2上的毒力基因,在伤寒沙门菌致病过程中发挥重要作用;catB、pltB是伤寒沙门菌特有的SPI-7上的毒力基因,编码伤寒毒素(typhiod toxin)[13]。本研究中,我们拟敲除伤寒沙门菌hns基因,观察毒力基因表达差异,从而分析HNS对伤寒沙门菌毒力基因的调控作用。
1 材料与方法
1.1 材 料
1.1.1 菌株与质粒 伤寒沙门菌GIFU10007株(野生型,记为WT)、质粒pMGB151、pKD4、pKD46、pCP20均由本实验室保存。
1.1.2 试剂 Trizol试剂购自美国Invitrogen公司;限制性内切酶(BamH I、SalI、EcoR I)、T4 DNA连接酶、DNA标准参照物、逆转录试剂盒和荧光定量PCR试剂盒购自宝日医生物技术(北京)有限公司公司;热启动DNA聚合酶预混液购自美国Thermo Fisher Scientific公司;蛋白胨、琼脂粉和酵母提取物购自英国Oxoid公司;L-阿拉伯糖、蔗糖、卡那霉素、氨苄西林购自美国Sigma公司;质粒提取试剂盒和PCR产物纯化试剂盒购自德国Qiagen公司。
1.1.3 主要仪器 凝胶成像仪Gel Doc XR+、电转化穿孔仪Gene pulser Ⅱ、水平凝胶电泳仪与PCR扩增仪s1000购自美国BIO-RAD公司;超微量分光光度计Nanodrop与荧光定量PCR扩增仪ABI DX购自美国Thermo Scientific公司;分光光度计BioPhotometer D30购自德国eppendorf公司。
1.2 方 法
1.2.1 自杀质粒法敲除hns通过两轮PCR扩增得到缺失了部分hns编码序列的同源片段:煮沸法提取WT基因组,第1轮PCR以WT基因组(约20 ng/μL)为模板,上游引物hns-A、下游引物hns-B扩增hns编码序列上游同源臂,上游引物hns-C、下游引物hns-D扩增下游同源臂;第2轮PCR以hns上下游同源臂PCR扩增产物(约20 ng/μL)为模板,上游引物hns-A,下游引物hns-D,扩增得到缺失了部分hns编码序列的同源片段。同源片段与pMGB151质粒经BamH I酶切后,T4连接酶连接制备重组自杀质粒。
重组自杀质粒经电转化导入WT感受态,电转产物加入37 ℃温浴的LB肉汤,37 ℃复苏1 h后涂布于氨苄西林抗性平板,使用重组自杀质粒的氨苄西林抗性筛选得到阳性克隆。重组自杀质粒在蔗糖压力下会迫使其所携带的片段与细菌基因组发生同源重组。根据这一特性使用含5%蔗糖的LB平板进行阳性克隆传代,并使用引物hns-A/hns-D,经PCR进行重组鉴定。
1.2.2 RED重组法敲除hns质粒pKD46是一个温度敏感型质粒,高于37 ℃时易丢失,经阿拉伯糖诱导后表达Gam、Bet和Exo 3个λ噬菌体重组酶。pKD46导入WT获得受体菌,pKD4携带卡那霉素抗性基因盒,以质粒pKD4(约20 ng/μL)为模板,上游引物hns-RED-F、下游引物hns-RED-R,PCR扩增得到含卡那霉素抗性基因盒的hns同源打靶片段。
将含有pKD46的伤寒沙门菌受体菌接种,30 ℃培养过夜,1∶100转接于20 mL LB培养液中(氨苄西林浓度为100 mg/mL),30 ℃培养至D (600 nm)≈0.2时加入L-阿拉伯糖(30 mmol/L)继续培养诱导1 h,使得pKD46携带的重组酶充分表达。菌液冰上预冷后,离心收菌,10%甘油洗涤3遍,制备感受态细胞。
将同源打靶片段与感受态细胞混匀,利用电穿孔仪进行电转化。电击后加入37 ℃温浴的 LB肉汤,37 ℃复苏1 h后涂布于卡那霉素抗性平板(卡那霉素浓度50 mg/mL),37 ℃培养16 h后,使用上游引物hns-check-F、下游引物hns-check-R,PCR法鉴定长出的卡那霉素抗性克隆。
1.2.3 RED重组法敲除phoPQ-hnsphoPQ的敲除方法同上,以WT为模板,上游引物phoPQ-RED-F、下游引物phoPQ-RED-R,扩增同源打靶片段,与感受态细胞混合后进行电转化,转化产物涂布于卡那霉素抗性平板(卡那霉素浓度50 mg/mL),37 ℃培养16 h后,使用上游引物phoPQ-check-F、下游引物phoPQ-check-R,PCR法鉴定长出的卡那霉素抗性克隆。
卡那霉素抗性基因的消除:将质粒pCP20导入筛选出的抗性克隆,30 ℃培养8 h后,42 ℃培养过夜诱导pCP20表达FLP重组酶,FLP重组酶可识别FRT位点,删除同源打靶片段上FRT间的抗性片段。过夜培养菌液分别接种于无抗性平板与卡那霉素抗性平板,挑选无抗性的克隆,PCR方法进一步验证,得到无抗性的phoPQ缺失株(记为ΔphoPQ)。ΔphoPQ进一步使用RED重组法敲除hns,得到phoPQ与hns的双缺失株(记为ΔphoPQ-hns)。
1.2.4 细菌生长曲线测定 各挑取WT、ΔphoPQ和ΔphoPQ-hns的单菌落,分别接种于2 mL的LB肉汤中,37 ℃、250 r/min培养12~14 h后,将菌株种子液稀释到OD(600 nm)=1.0,取200 μL菌液1∶100转接到新鲜的20 mL的LB肉汤中,37 ℃ 250 r/min继续培养,每隔1 h检测一次OD(600 nm)值至12 h。以培养时间为横坐标,3次重复实验的OD(600 nm)平均值为纵坐标绘制生长曲线。
1.2.5 实时定量RT-PCRΔphoPQ与ΔphoPQ-hns保种液接种于LB肉汤培养,37 ℃、250 r/min培养12~14 h后,1∶100转接于新鲜的LB肉汤,37 ℃、250 r/min培养至OD(600 nm)≈0.4,收集菌体。使用Trizol提取细菌总RNA,N6随机引物逆转录成cDNA,使用ABI DX做实时定量RT-PCR分析,以5s为内参基因,利用经典的2-ΔΔCt进行相对定量分析。

表1 本研究所用引物Tab.1 Oligonucleotide primers used in this study
1.3 统计学分析 采用GraphPad Prism 5.0软件进行数据分析,t检验分析ΔphoPQ与ΔphoPQ-hns中的靶基因mRNA水平差异,P<0.05为差异有统计学意义。
2 结 果
2.1 自杀质粒法及RED重组法敲除伤寒沙门菌hns成功构建了含hns同源短片段的重组自杀质粒,并导入WT感受态细胞中,使用PCR法鉴定同源重组结果。结果如图1所示,5%蔗糖压力下传代3次以上,WT基因组带有的长片段与重组自杀质粒带有的同源短片段共存,显示阳性克隆在5%蔗糖压力下无法完成同源重组,表明伤寒沙门菌hns无法被替换敲除。

图1 自杀质粒法敲除hns阳性克隆筛选Fig.1 Positive clone screening for hns knockout with the suicide plasmid method
hns同源打靶片段经电转化导入RED重组WT感受态细胞后,涂布卡那霉素抗性平板,无克隆生长(重复3次以上),表明RED重组法也无法成功敲除伤寒沙门菌hns。
2.2 伤寒沙门菌phoPQ-hns双基因敲除 我们尝试利用RED重组法先敲除phoPQ,降低毒力基因表达的基础上,进一步敲除hns(图2A)。结果显示:phoPQ被成功敲除(记为ΔphoPQ),WT基因组phoPQ编码区域被较短的同源序列替换;以ΔphoPQ为受体菌,再行RED重组敲除hns,成功制备ΔphoPQ-hns双基因缺失株,WT基因组hns编码区域被较长的含有卡那霉素抗性基因的同源片段所替换(图2B)。经实时定量RT-PCR验证,与ΔphoPQ相比,ΔphoPQ-hns中检测不到hns的转录表达(图2C)。生长实验结果显示:与ΔphoPQ相比,ΔphoPQ-hns生长明显缓慢,WT与ΔphoPQ的生长曲线基本一致。表明,hns的缺失影响细菌生长(图3)。
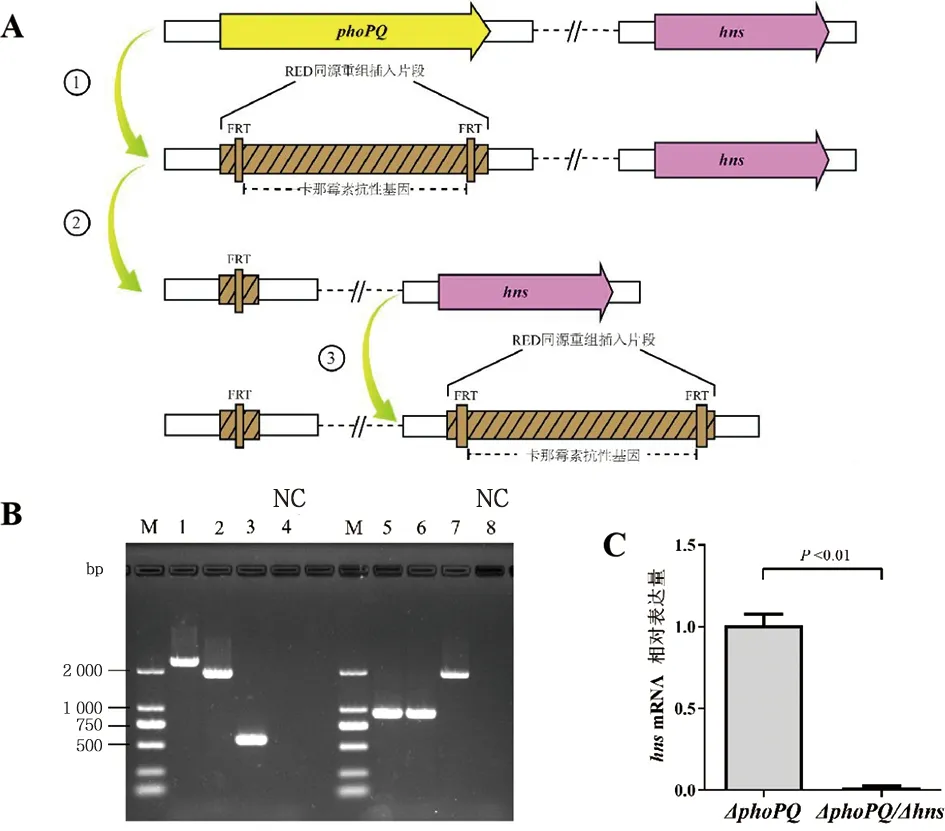
注:A.RED重组制备phoPQ-hns双基因敲除示意图,①phoPQ同源序列被卡那霉素抗性基因片段替换;②FLP重组酶识别FRT位点,消除卡那霉素抗性基因;③hns同源序列被卡那霉素抗性基因片段替换。B.验证phoPQ-hns双基因敲除。M. DNA分子量标准;1.WT; 2.phoPQ RED重组卡那霉素抗性克隆; 3.phoPQ RED重组消除抗性基因; 4.NC阴性对照; 5.WT; 6.ΔphoPQ; 7.hns RED重组卡那霉素抗性克隆; 8.NC阴性对照。C.实时定量RT-PCR检测ΔphoPQ与ΔphoPQ-hns的hns表达。图2 伤寒沙门菌phoPQ-hns双基因敲除的制备与验证Fig.2 Preparation and validation of phoPQ-hns double gene deletion in Salmonella Typhi

图3 伤寒沙门菌ΔphoPQ-hns生长曲线Fig.3 Growth curve of Salmonella Typhi ΔphoPQ-hns
2.3 HNS对伤寒沙门菌部分毒力基因表达的调控作用 实时定量RT-PCR结果显示,与ΔphoPQ相比,ΔphoPQ-hns中hilA、invF、ssrB、ssaB、cdtB、pltB等靶基因的mRNA水平出现明显升高,分别为19.97倍、16.12倍、64.89倍、71.41倍、133.25倍和650.5倍,见图4,表明HNS负调控以上毒力基因表达。
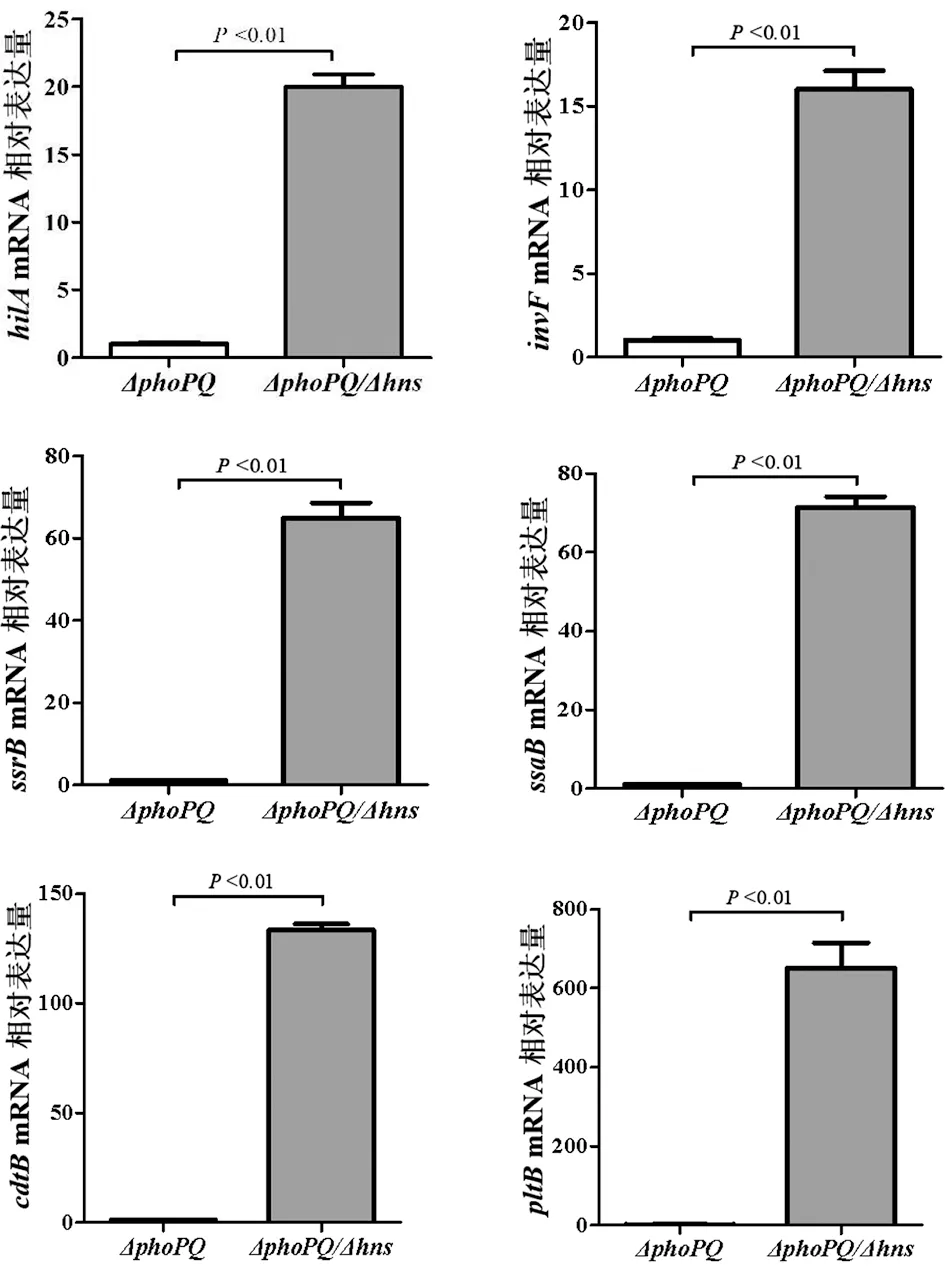
图4 ΔphoPQ与ΔphoPQ-hns的毒力基因mRNA表达差异Fig.4 Differences in mRNA expression of virulence genes between ΔphoPQ and ΔphoPQ-hns
3 讨 论
hns编码产物HNS,是一种拟核相关DNA结合蛋白,除具有压缩染色质、压实拟核的功能外,还参与多种基因表达调控。HNS可形成激活型二聚体,像钳子一样夹住DNA链,阻碍相关基因的转录,HNS对DNA的结合无序列特异性,优先结合GC%低的区域(富AT序列)[14]。本研究利用自杀质粒法与RED重组法敲除伤寒沙门菌hns,结果显示,两种方法均无法成功敲除hns。重组自杀质粒在蔗糖压力下,截短的hns编码序列短片段无法替换基因组同源序列;RED重组法中,携带卡那霉素抗性基因的hns同源打靶片段同样无法替换基因组同源序列。以上结果表明,伤寒沙门菌存在抵抗hns丢失的机制,hns可能对伤寒沙门菌的生长至关重要。
致病性革兰阴性杆菌通过“水平转移”获得了大量的外源毒力基因,这些基因GC%明显低于宿主菌基因组。外源基因赋予宿主菌独特的致病机制的同时也带来健康损害的代价,HNS通过沉默外源性毒力基因,降低了后者过度表达对细菌生长的损害。鼠疫耶尔森菌[15]、副溶血弧菌[14]、大肠埃希菌[16]中的hns均能被敲除。鼠伤寒沙门菌中,在突变RpoS以降低毒力基因表达的基础上,可成功敲除hns,hns缺失株传代30代后,出现致病岛1、致病岛2大片段的突变,表明鼠伤寒沙门菌通过突变毒力基因的方式抵消hns缺失带来的损害[10]。
与鼠伤寒沙门菌基因组相比,除了致病岛1、致病岛2等毒力基因外,伤寒沙门菌还具备独特的致病岛7,后者编码Vi荚膜、伤寒毒素(typhiod toxin)等致病因子[13]。PhoPQ是伤寒沙门菌重要的双组分调节系统,参与激活多种毒力基因[17]。本研究通过先敲除phoPQ,缓冲细菌健康损害的基础上,再敲除hns,实验结果显示,敲除phoPQ后,hns可被成功敲除。ΔphoPQ与ΔphoPQ-hns的生长实验,进一步证实hns对伤寒沙门菌生长的影响。
实时定量RT-PCR实验结果显示,HNS对毒力基因hliA、invF、ssrB、ssaB、pltB、cdtB都有抑制作用。hliA、invF、ssrB、ssaB是沙门菌属共有的毒力基因,其中hliA、invF位于致病岛1,编码产物是T3SS-1的重要组成部分,参与伤寒沙门菌侵袭宿主细胞、引起炎症等致病过程;ssrB、ssaB位于致病岛2,SsrB是重要的调节因子,SsaB是T3SS-2的重要组分[11-12];pltB、cdtB位于致病岛7,是伤寒沙门菌特有的毒力基因,编码产物生成伤寒毒素。表明HNS对伤寒沙门菌的毒力基因具有广泛抑制作用。
HNS通过与富AT序列结合,沉默外源性基因的非必要表达[6]。PhoPQ是肠杆菌科细菌广泛存在的双组分信号转导系统,由跨膜的组氨酸蛋白激酶PhoQ和胞内的反应调节蛋白PhoP组成,PhoQ感受到胞外信号(如低Mg2+、H+、抗菌肽等),激活PhoP磷酸化,调控下游基因表达[18]。磷酸化的PhoP可上调多种外源性毒力基因的表达,解除HNS对外源基因的沉默,从而形成“沉默-反沉默”的基因调控机制[19]。本研究在敲除phoPQ以降低毒力基因表达的基础上,成功敲除hns,为后续研究HNS的调控作用建立了基础。
利益冲突:无
引用本文格式:顾丽萍,丁超,徐国新,等.伤寒沙门菌hns基因缺失株的构建及其对毒力基因表达影响[J].中国人兽共患病学报,2023,39(8):727-732. DOI:10.3969/j.issn.1002-2694.2023.00.078

