2018-2019年福建省禽类外环境H5亚型禽流感病毒分子特征和遗传进化分析
吴晶晶,陈宏彬,林 琦,张炎华,鄢育青,翁育伟
禽流感是指由禽流感病毒(avian influenza virus,AIV)在家禽或野禽中传播引起的一类传染性疾病,但部分亚型也能跨越种属屏障和受体差异性,引起人类发病。目前已发现人感染AIV并导致高致死率的主要亚型为H5亚型和H7亚型。根据AIV致病力的大小,可将AIV分为高致病性禽流感病毒(highly pathogenic avian influenza virus,HPAIV)和低致病性禽流感病毒(Low pathogenic avian influenza virus,LPAIV)。H5N1 HPAIV于1996年在广东省鹅群中成功分离A/goose/Guangdong/1/1996(H5N1),并于1997年在香港感染人类而引发疫情[1]。由于其对禽类养殖行业的巨大冲击,以及人类感染的高发病率和高死亡率,H5亚型AIV引发了全球社会广泛关注。WHO/OIE/FAO等国际组织根据HA基因的进化程度,将H5亚型分为Clade 0~9主干支,并进一步分为多个亚系分支[2],其中Clade 2.3.4.4为国内近些年H5亚型的主要流行分支[3-4]。2014年,中国报道了归属于Clade 2.3.4.4进化分支的HPAIV H5N6,并逐渐取代H5N1 AIV流行株,在中国东部和南部地区家禽中引起广泛传播[5-6]。随后几年,Clade 2.3.4.4 新型H5N6或H5N8重组AIV不仅在亚洲,也在欧洲、美洲等全球范围内的家禽及野禽中传播,截止2021年5月,全球已报道29例经实验室确认的人感染该进化分支病例,包括了至少16例死亡病例[7]。福建省于2017年12月报道了人感染HPAIV H5N6(A/Fujian-Sanyuan/ 21099/2017-like(H5N6)),序列分析显示该病毒由不同地区的HPAIV H5N8、H5N6及 LPAIV H6N6基因重组而成[8],提示环境中不同亚型AIV可重组成HPAIV,并存在感染人类的可能性。为进一步了解福建省新型H5N6 AIV的流行特点,本研究对福建省禽类外环境H5亚型AIV的HA基因及NA基因进行分析,为疾病预防和控制提供相应参考。
1 材料与方法
1.1 标本来源 根据《福建省职业暴露人群血清学和环境高致病性禽流感监测实施方案(2012版)》的采样要求,选取本实验室保存的2018-2019年福建省禽类外环境标本。标本分别来自福建省设立的6个地市监测点(福州、厦门、泉州、三明(梅列区)、漳州(漳浦县)、南平(建瓯市);样本的采集场所为:城乡活禽市场、家禽规模养殖场(户)、家禽散养户集中的地区和家禽屠宰加工厂;样本类型为:笼具表面擦拭标本、宰杀或摆放禽肉案板表面擦拭标本、粪便标本、清洗禽类的污水、禽类饮用水及其他等6类环境标本。
1.2 标本核酸检测 根据“中国流感信息检测系统”中的禽类外环境标本的核酸检测结果,从本实验保存的2018-2019年福建省禽类外环境标本中筛选出H5单阳性标本,将筛选的标本冻融后充分振荡,使用天隆GeneRotex系列全自动核酸提取仪进行核酸提取,并使用H5亚型分型核酸测定试剂盒(购自上海之江),采用实时荧光定量PCR法进行H5亚型AIV的复核检测,并挑选出Ct值小于30的样本。
1.3 基因序列扩增与测序 使用甲型流感通用引物(Uni-12/Inf1:5′-GGGGGGAGCAAAAGCAGG-3′;Uni-12/Inf3: 5′-GGGGGGAGCGAAAGCAGG-3′;Uni-13/Inf1: 5′-CGGGTTATTAGTAGAAACAAGG-3′)进行RT-PCR靶向扩增AIV HA和NA基因片段,反应参数为:45 ℃ 60 min;94 ℃ 2 min;94 ℃ 30 s,44 ℃ 30 s,68 ℃ 3 min,5个循环;94 ℃ 30 s,57 ℃ 30 s,68 ℃ 3 min,31个循环;68 ℃ 7 min。配置1%琼脂糖凝胶,电泳检测扩增产物,并将符合目的条带大小的扩增产物纯化后送北京诺禾致源生物信息科技公司进行二代测序。使用CLC Genomics Workbench软件对测序数据进行拼接和分析。
1.4 HA和NA基因遗传进化和分子特征分析 将本研究获得的序列与NCBI、GISAID数据库进行序列比对,并下载国内外环境、禽类和人相关的H5和N6基因毒株序列,包括2020年最新被WHO列为H5流感病毒候选的9株Clade 2.3.4.4疫苗株序列:A/duck/Hyogo/1/2016(H5N6)、A/Sichuan/26221/2014(H5N6)、A/gyrfalcon/Washington/41088-6/ 2014(H5N8)、A/chicken/Viet Nam/NCVD-15A59 /2015-like(H5N6)、A/Guangdong/18SF020/2018-like(H5N6)、A/Hubei/29578/2016-like(H5N6)、A/Fujian-Sanyuan/21099/2017-like(H5N6)、A/chicken/Vietnam/RAHO4-CD-20-421/2020-like(H5N6)、A/Astrakhan/3212/2020-like(H5N8)。
使用MEGA 6.0软件,以基因开放阅读框为完整序列,采用Maximum Likelihood法绘制HA和NA基因遗传进化树,分析进化特点。使用MegAlign以及MEGA 6.0软件进行重要蛋白位点以及突变位点的分析。使用Net NGlyc 1.0 Server在线软件分析预测糖基化位点。
2 结 果
2.1 H5亚型AIV流行和测序情况 2018年和2019年福建省外环境AIV标本采样总数分别为853份和848份:检出A型流感病毒核酸阳性标本334份和352份,A型阳性率分别为39.16%和41.51%;检出H5单阳性标本32份和31份,H5单阳性率分别为3.75%及3.66%。经实时荧光定量PCR复核筛选,选出Ct值小于30的标本共15份,再经靶向扩增,根据琼脂糖凝胶电泳条带筛选并纯化后送测序样本共12份,送测序标本主要来源于城乡活禽市场。经序列拼接分析,分别获得12株HA基因及NA基因全长,所获基因测序覆盖度均为100%。12株HA基因的平均测序深度在3 735.45~30 676.61X,12株NA基因的平均测序深度在3 700.91~60 381.16X,所获全部序列已上传至GISAID数据库,登陆号及测序标本信息具体见表1。
2.2 序列比对和遗传进化分析 序列比对分析表明,本研究获得的12株病毒HA基因与数据库中比对的核酸序列最高一致性在98.59%~99.89%,分别与广东、福建、江西和湖南省家禽及环境样本分离的H5N6毒株一致性最高;12株病毒NA基因与数据库中比对的核苷酸序列最高一致性在98.19%~99.85%,分别与广东、福建、江西和江苏省家禽及环境样本分离的H5N6和H6N6毒株一致性最高,H5基因和N6基因的序列比对结果详见表2。

表2 2018-2019年福建省禽类外环境送测序样本序列比对结果Tab.2 Sequence alignment results of avain external environment sequencing samples in Fujian Province from 2018 to 2019

表3 H5基因和N6基因分子特征和关键氨基酸位点分析Tab.3 Molecular characteristics and key amino acid mutations of the H5 and N6 genes
构建系统进化发育树分析表明,2018—2019年福建省外环境H5亚型AIV均属于Clade 2.3.4.4h进化分支(图1),进一步可分为2个亚系:A/Env/Fujian/C18209018/2018(H5N6)单独为一个亚系(h2),其余11株同属于一个亚系(h1)。N6基因主要归属于欧亚谱系的H5N6和H6N6进化分支:10株属于H5N6进化分支,其余2株A/Env/Fujian/C19036006/2019(H5N6)以及A/Env/Fujian/C19035003/2019(H5N6)属于H6N6进化分支(图2)。
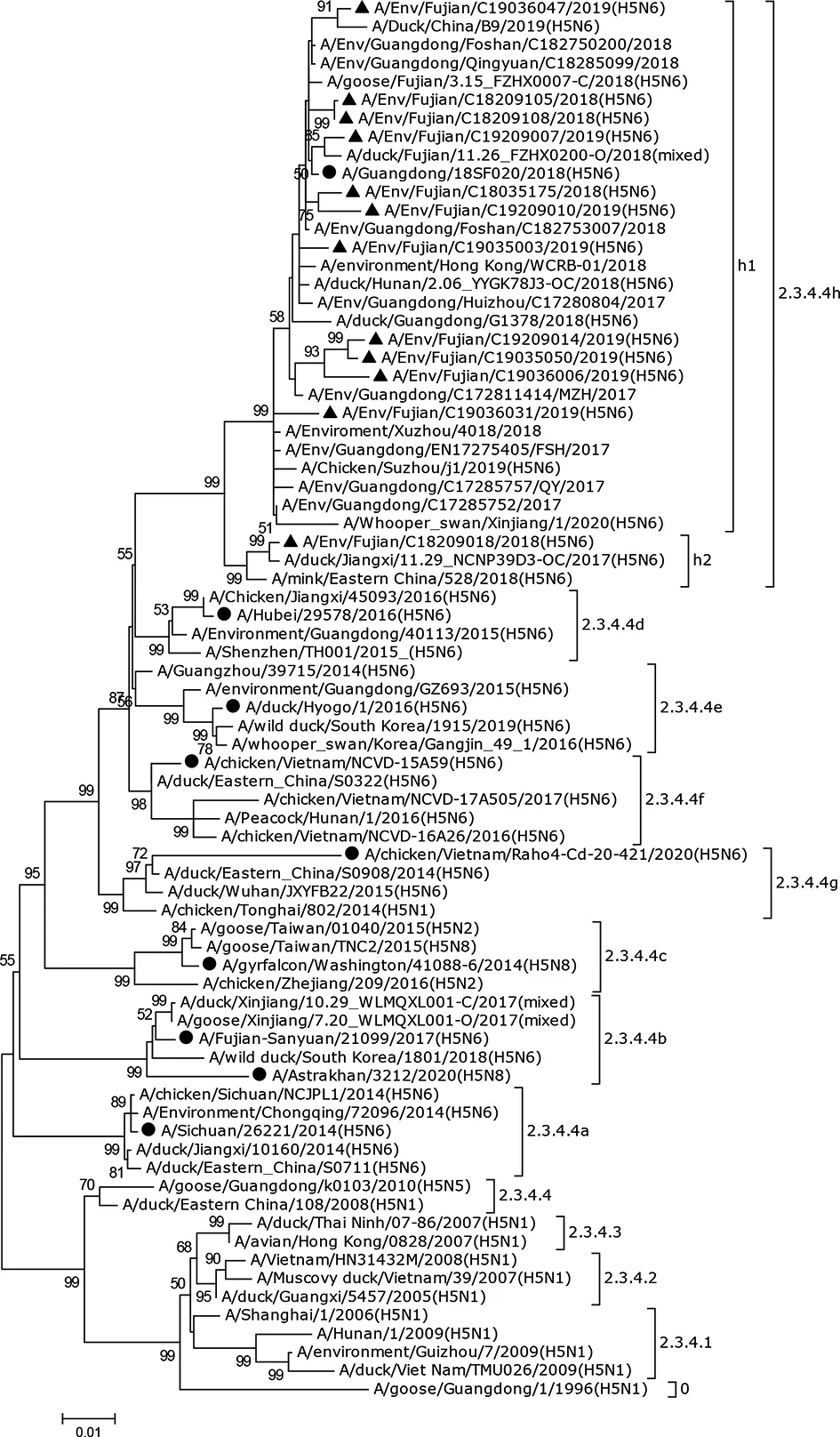
▲: represent strains from Fujian Province; ●: represent vaccine strains图1 2018-2019年福建省禽流感病毒HA基因进化树Fig.1 Phylogenetic tree of the HA genes of avian influenza virus in Fujian Province, 2018-2019

▲: represent strains from Fujian Province图2 2018-2019年福建省禽流感病毒NA基因进化树Fig.2 Phylogenetic tree of the NA genes of avian influenza virus in Fujian Province, 2018-2019
2.3 蛋白分子特征分析 12株H5亚型AIV 的HA蛋白裂解位点均为RERRRKR↓GLF,且多个碱性氨基酸位于该裂解位点处,是HPAIV的分子特征。所有毒株在HA蛋白受体结合位点Q226及G228(H3 计数)均未发生突变,保留了病毒对禽类受体SAα2, 3-Gal亲和力的特性[9-10];所有毒株在HA蛋白均发生S133A及T156A突变,研究表明该突变位点可以增强病毒对人类受体SAα2, 6-Gal的亲和力[9-10];所有毒株在HA蛋白126E发生氨基酸缺失,该缺失突变已被报道是归属于Clade 2.3.4.4h的H5N6 AIV常见的突变位点[5,11]。其余氨基酸突变及其生物学功能见表2。
HA蛋白糖基化位点分析显示,有10株病毒的糖基化位点相同,分别在11、23、54、124、164、192、285、482、541位,HA蛋白常见的154位糖基化位点(-NDTY)由于T156A突变而消失;而124位糖基化位点(-NHTS)由于126E缺失突变而新增。另外2株病毒(C19209014及C19036006)分别在214位(-NRSQ)以及235位(-NDTI)也由于氨基酸突变产生新的糖基化位点。
NA蛋白分子特征分析显示,11株NA蛋白在颈部59-69位发生11个氨基酸缺失突变,1株NA蛋白(C19209010)颈部59-68位发生10个氨基酸缺失突变,研究发现NA蛋白颈部缺失可提高和增强禽类、人类病毒感染的毒力;常见耐药位点274及292位(N2计数)均未出现突变,提示未改变毒株对奥司他韦(oseltamivir)和扎那米韦(zanamivir)抗流感药物的敏感性[8,12]。
3 讨 论
资料显示,2013-2017年福建省H5亚型AIV的平均阳性率为4.24%[13],与2018年、2019年H5亚型的阳性率较为相近,说明H5亚型AIV在福建省禽类环境如城乡活禽市场等一直长期流行。本研究通过比对HA及NA基因序列发现,H5基因、N6基因分别与福建省临近省份的序列相近,相似性在98.19%~99.89%,包含H5N6和H6N6的基因序列,显示出中国南方地区的序列在地域上具有一定高度同源性。
2017年,Lee等[14]根据H5亚型AIV的进化情况将HA基因划分为4个进化小组:Group A~Group D,其中亚洲地区的主要进化分支为Group C,且大部分感染人类的H5N6 AIV来源于该分支[15-16]。2020年1月,根据WHO/OIE/FAO等国际组织对H5亚型AIV系统发育的最新命名规则,Clade 2.3.4.4 H5Nx病毒HA基因被划分为8个亚进化分支(Sub-Clade):Clade 2.3.4.4a~2.3.4.4h,将原先的Group C细分为Clade 2.3.4.4d~2.3.4.4h,其中Clade 2.3.4.4h指主要来源于中国的野禽和家禽、老挝和越南家禽的H5亚型AIV,并且大多数HA基因与A/Guangdong/18SF020/2018相比,其氨基酸的差异小于10个氨基酸[17]。基因进化分析显示,本研究所测12株H5亚型AIV均是属于Clade 2.3.4.4h进化分支,与江苏、广东等中国南方地区同一时期家禽相关外环境H5亚型AIV的进化分支一致,该进化分支也是中国大陆南方地区近年来的主要流行分支[18-19]。在N6基因方面,有2株来源于H6N6进化分支,与另外10株归属于H5N6进化分支相独立开来,提示N6基因在进化上具有多样性,H5N6 AIV与H6N6 AIV曾发生重组。多项研究表明,不同亚型的LPAIV可通过重组成HPAIV,因此加强AIV的重组监测尤为重要[8,19-22]。
HA蛋白在识别宿主细胞的唾液酸受体,细胞膜融合,逃脱宿主免疫系统监视以及病毒粒子包装和出芽等方面发挥重要的生物学功能[23-24]。HA蛋白分子特征分析表明,本研究所测12株HA蛋白均为RERRRKR↓GLF裂解位点,包含多个碱性氨基酸,提示福建省环境中存在H5亚型HPAIV,该结果与福建省2017年的相关研究一致[8]。受体位点分析显示,2018—2019年福建省H5亚型为禽源受体,但常见重要蛋白位点S123P、S133A、I151T、T156A突变可增强病毒与人源受体的亲和力。在糖基化位点分析方面,有研究表明HA蛋白154位糖基化位点的缺失可使病毒更耐受高温环境,增强与宿主细胞的结合能力,提高了H5Nx毒株在自然界的流行能力[25],因此T156A突变导致154位糖基化位点缺失是Clade 2.3.4.4 H5Nx毒株的常见分子特征,也是该分支成为福建等中国南方地区主要流行株的原因之一。此外,HA蛋白新增124位、214位及235位糖基化位点,还尚未有研究能解释新增的糖基化位点对HA蛋白功能的影响。NA蛋白分子特征分析显示,本研究发现有一株NA蛋白颈部缺失10个氨基酸,不同于NA蛋白颈部常见的11个氨基酸缺失突变。现有研究表明,NA蛋白颈部11个氨基酸缺失突变可增强病毒对人类受体亲和力以及对禽类感染的毒力[1,26],但还尚未有报道比较颈部位置缺失不同数量而导致氨基酸功能的具体差异,不同数量氨基酸的缺失还是否会影响病毒传播能力和致病性还有待实验研究。
随着2013-2017年国内多次暴发人感染HPAIV H7N9疫情,政府等相关部门出台了严格管控措施,2017年禽类开始大规模的接种H5/H7双价疫苗,监测数据显示福建省外环境中H7亚型的阳性率在2018年之后显著降低[27],且2019年后国内未见有相关人感染H7N9病例的报道,不同研究也提示双价疫苗的使用在抑制H7N9 AIV人群中传播方面有显著的效果[28-29]。但在H5亚型方面,由于H5亚型在我国活禽市场长时间流行并持续发生变异,已出现由H5N1、H6N6及H9N2内部基因新型重组HPAIV H5N6,且流行株和疫苗株抗原发生偏离[30],可能降低双价疫苗对H5亚型AIV的保护效应。
根据本研究H5亚型的监测数据以及12株AIV H5、N6基因分子特征分析结果,福建省城乡活禽市场等禽类环境中仍流行一定数量的HPAIV H5N6。目前福建省禽类市场主要流行的AIV亚型为H9亚型[27],LPAIV可为H5亚型AIV提供内部基因,重组而成新型HPAIV H5N6,并且可能持续进化和变异,有潜在感染人类的风险。人感染AIV的主要途径是通过人与禽类或人与禽类相关环境的接触[31],因此对禽类外环境的监测和序列研究对人类感染AIV的防控意义重大。本研究通过分析福建省外环境中的H5亚型AIV序列的分子特征,也可对外环境AIV的防控和人感染AIV的研究提供一定参考和理论依据。
利益冲突:无
引用本文格式:吴晶晶,陈宏彬,林琦,等.2018-2019年福建省禽类外环境H5亚型禽流感病毒分子特征和遗传进化分析[J].中国人兽共患病学报,2023,39(8):750-757. DOI:10.3969/j.issn.1002-2694.2023.00.081

