积雪草酸对前列腺癌细胞DU145的作用研究
刘嘉,严宝飞,田朝晖,曾庆琪
前列腺癌是最常见的男性生殖系统恶性肿瘤,是发生在前列腺的上皮型恶性肿瘤。随着我国经济的快速发展,人民群众的生活方式日益改变,我国前列腺癌的发病率和死亡率持续上升,男性生命健康受到威胁[1]。现今临床上对于前列腺癌的诊疗方案包括手术、化疗等,但患者的生存率以及生活质量仍亟待改善[2]。祖国医学虽未记载“前列腺癌”病名,但基于患者症状和表现将其归属为“劳淋”、“尿血”、“积聚”、“癃闭”等范畴,并辨证其病因病机为虚实夹杂、病邪深在[1,3]。因此,采取中医药治疗前列腺癌具有一定潜力。
积雪草酸(asiatic acid,AA)属于五环三萜类化合物,为临床常用中药积雪草的有效成分,广泛用于医药、保健等多行业中[4]。研究证实,AA具有多种显著的药理活性,如抗炎、抗氧化、保肝、降血脂以及抗肿瘤等[5-6]。有研究证实,AA能够诱导肝癌、乳腺癌等肿瘤细胞凋亡,但其对前列腺癌的作用相关研究较少[6-7]。因此,课题组以人前列腺癌细胞DU145作为研究对象,探讨AA对前列腺癌细胞增殖和凋亡的影响,以期为其能够用于临床前列腺癌治疗提供研究基础。
1 材料与方法
1.1 细胞株
DU145细胞株(人前列腺癌)由武汉普诺赛公司提供,STR鉴定正确。
1.2 药物及试剂
AA(批号:A111379),纯度≥ 98%,购自上海阿拉丁公司;胎牛血清(批号:F8318)、DMEM培养基(批号:D6429)、四甲基偶氮唑蓝(MTT,批号:CT01-5)、Z-VAD-FMK(批号:V116-2MG)、BCA试剂盒(批号:BCA1-1KT),均购自德国默克公司;AnnexinV-FITC/PI双染试剂盒(批号:P-CA-201)购自武汉普诺赛公司;一抗:Bax(批号:A0207)、Bcl-2(批号:A11025)、Cleaved Caspase 3(批号:A2156)、Cyt-C(批号:A4912)、GAPDH(批号:AC001),均购自武汉爱博泰克公司;Hoechst 33258染液(批号:40729ES10),购自上海翌圣公司;Caspase 3活性检测试剂盒(批号:C1115),均购自上海碧云天公司;PVDF膜(批号:LC2002),购自美国Thermo公司。
1.3 主要仪器
TS2R型、TS100型显微镜系统,日本尼康公司;MultiskanMK3型酶联免疫检测仪,美国Thermo公司;MINI-PROTEAN TETRA小型垂直电泳系统,美国伯乐公司;CytoFLEX LX型流式细胞仪,美国BD公司。
1.4 MTT法检测细胞存活率
1.4.1 AA对DU145细胞存活率的影响 取对数生长期的DU145细胞,每孔100 μL(细胞浓度5×104/mL)接种于96孔板中,分别以1 μmol/L、2 μmol/L、5 μmol/L、15 μmol/L、25 μmol/L、50 μmol/L、70 μmol/L和150 μmol/L 的药物浓度AA干预24 h、48 h,每孔加入20 μL的MTT(5 mg/mL),37 ℃孵育4 h,弃去上清,每孔加入150 μL的 DMSO溶液,于492 nm检测波长处测定吸光值。细胞生存率(%)=(实验组吸光值/对照组吸光值)×100%。根据结果选择IC50附近的3个浓度进行后续实验。
1.4.2 Z-VAD-FMK干预后检测细胞生存率 细胞接种同1.4.1项。细胞分组为空白对照组(Control组),Z-VAD-FMK抑制剂组,AA 20 μmol/L、30 μmol/L、40 μmol/L组及AA 20 μmol/L、30 μmol/L、40 μmol/L+Z-VAD-FMK抑制剂组。细胞培养24 h后,AA+Z-VAD-FMK各组用以含10 μmol/L Z-VAD-FMK的培养基处理30 min,随后各组分别加入含有AA的培养基使其终浓度为20 μmol/L、30 μmol/L、40 μmol/L,Control组加入含0.1% DMSO的培养基Z-VAD-FMK抑制剂组以含10 μmol/L Z-VAD-FMK的培养基处理30 min后加入含DMSO的培养基(DMSO终浓度0.1%)。给药处理24 h后,细胞活力测定,测定及计算方法同1.4.1项。
1.5 DU145细胞形态学观察
取对数生长期的DU145细胞接种于24孔板中(细胞密度为2×103/mL),24 h后弃上清,加入含有浓度为20 μmol/L、30 μmol/L、40 μmol/L AA的培养基,空白对照组(Control组)加入不含AA的培养基(0.1% DMSO)。给药处理8 h后,显微镜镜检细胞情况并拍照。
1.6 Hoechst染色法检测细胞凋亡
对数生长期细胞接种于24孔板,细胞密度为5×104/mL,于37 ℃培养24 h后弃上清,分别加入500 μL浓度为20 μmol/L、30 μmol/L、40 μmol/L AA的培养基培养DU145细胞,Control组处理同1.5项。根据说明书处理细胞及加入Hoechst 33258工作液,室温避光孵育10 min,显微镜检测凋亡情况并拍照。
1.7 Annexin V/PI双染法检测细胞凋亡
对数生长期细胞接种于6孔板中,细胞数为2×105/mL,于37 ℃培养24 h弃去培养基,给予浓度为20 μmol/L、30 μmol/L、40 μmol/L AA的培养基处理细胞,Control组处理同1.5。根据说明书处理细胞及加入Annexin V/FITC与PI染液,流式细胞仪检测凋亡率。
1.8 Western Blot法检测线粒体凋亡相关蛋白表达
细胞分组及处理同1.7项。根据说明书处理细胞及提取各组总蛋白并定量。10% SDS-PAGE凝胶,80 V电压电泳25 min,120 V电压65 min转膜,5%脱脂奶粉封闭2 h,一抗(1∶1 000)4 ℃过夜孵育,TBST洗膜3次,二抗(1∶1 000)孵育2 h,TBST洗膜4次,ECL化学发光法显影。image J软件分析灰度值,以GAPDH为内参对照,以目的蛋白与其灰度值的比值为相对表达值。
1.9 试剂盒检测Caspase 3活性
细胞分组、处理同1.4.2项。根据说明书处理细胞和检测细胞中Caspase 3酶活性。
1.10 数据统计分析
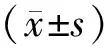
2 结果
2.1 AA对DU145细胞存活率的影响
结果见图1,AA处理DU145细胞后,其增殖能力被显著抑制,AA干预24 h、48 h后细胞的IC50值分别为37.75μmol/L、24.72 μmol/L,这些作用均呈现出浓度及时间的依赖性。
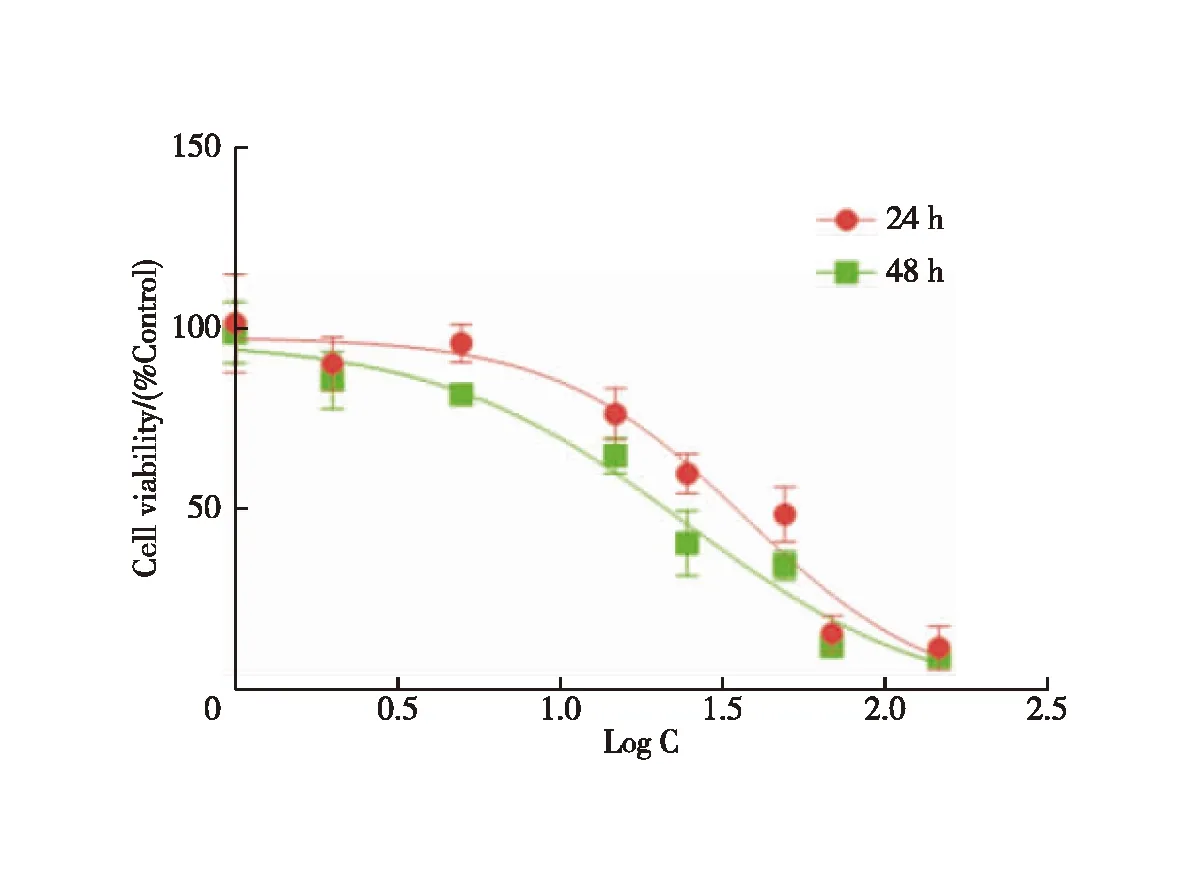
图1 AA对DU145细胞活力的影响
2.2 AA对DU145细胞形态学的影响
结果见图2,可知随着AA给药浓度的增加,部分细胞由梭形逐渐变圆,贴壁能力减弱,部分细胞胞体折光率降低,细胞正常形态缺失。

图2 AA对DU145细胞形态的影响
2.3 AA对DU145细胞凋亡的影响
结果见图3,未干预的DU145细胞的细胞核呈现的蓝色荧光均匀,仅有少量凋亡细胞,而AA干预组细胞的细胞核出现致密的蓝色颗粒状荧光,且随着给药浓度增加,凋亡细胞增多,即AA可促进DU145细胞凋亡。

图3 AA对DU145细胞凋亡的影响
2.4 AA对DU145细胞凋亡率的影响
结果见图4,与空白组比较,AA干预后各组的细胞凋亡率升高,差异有统计学意义(P<0.01),且药物浓度与凋亡率呈正相关,表明AA可浓度依赖性诱导DU145细胞凋亡。
注:与空白组比较,**P<0.01图4 AA对DU145细胞凋亡率的影响
2.5 AA对DU145细胞线粒体凋亡蛋白表达的影响
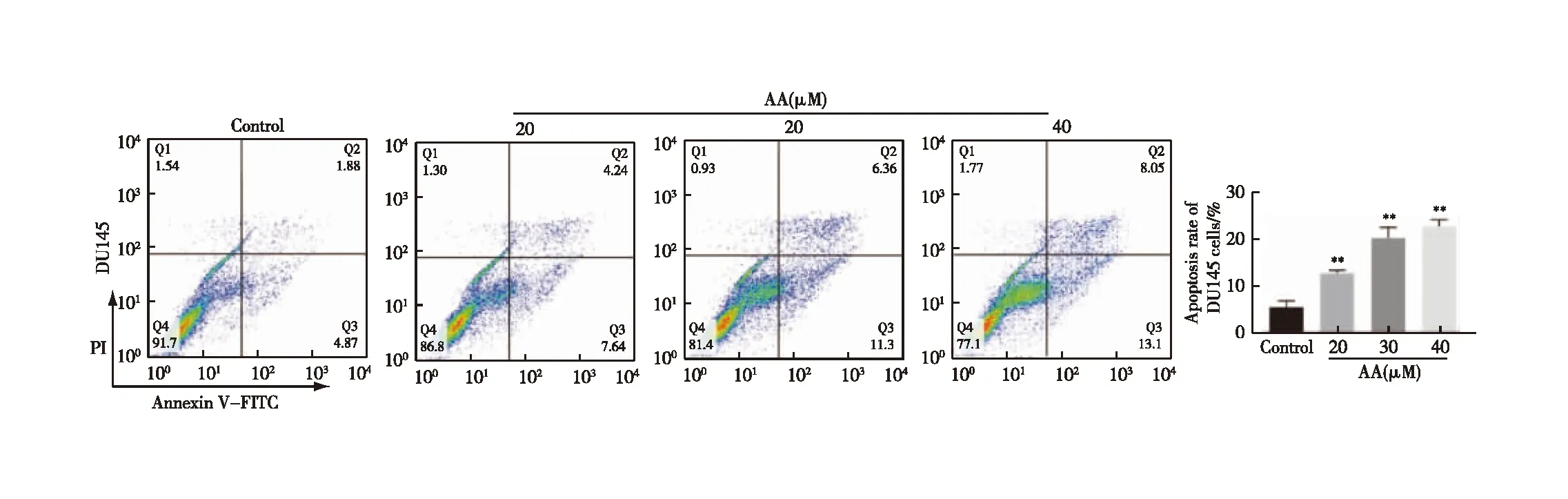
结果见图5,与空白组比较,AA干预后DU145细胞的Bax、Cleaved Caspase 3、Cyt-C蛋白表达显著增加,而Bcl-2表达显著降低(P<0.05,P<0.01);与空白组比较,30 μmol/L及40 μmol/L AA干预后的DU145细胞的Bax/Bcl-2的比值明显升高(P<0.01),且这些变化趋势与AA浓度呈正相关。以上结果表明,AA能够浓度依赖性诱导DU145细胞线粒体凋亡相关蛋白表达。
注:与空白组组比较,*P<0.05,**P<0.01图5 AA对DU145细胞Bcl-2、Bax、Cleaved Caspase 3、Cyt-C蛋白表达的影响
2.6 AA及Z-VAD-FMK对DU145细胞Caspase 3活性的影响
结果见图6,与空白组比较,AA干预后DU145细胞Caspase 3的活性显著升高(P<0.05,P<0.01);而与对应浓度的AA组比较,各浓度AA与Caspase 3抑制剂Z-VAD-FMK混合处理组的细胞Caspase 3活性显著降低(P<0.05)。
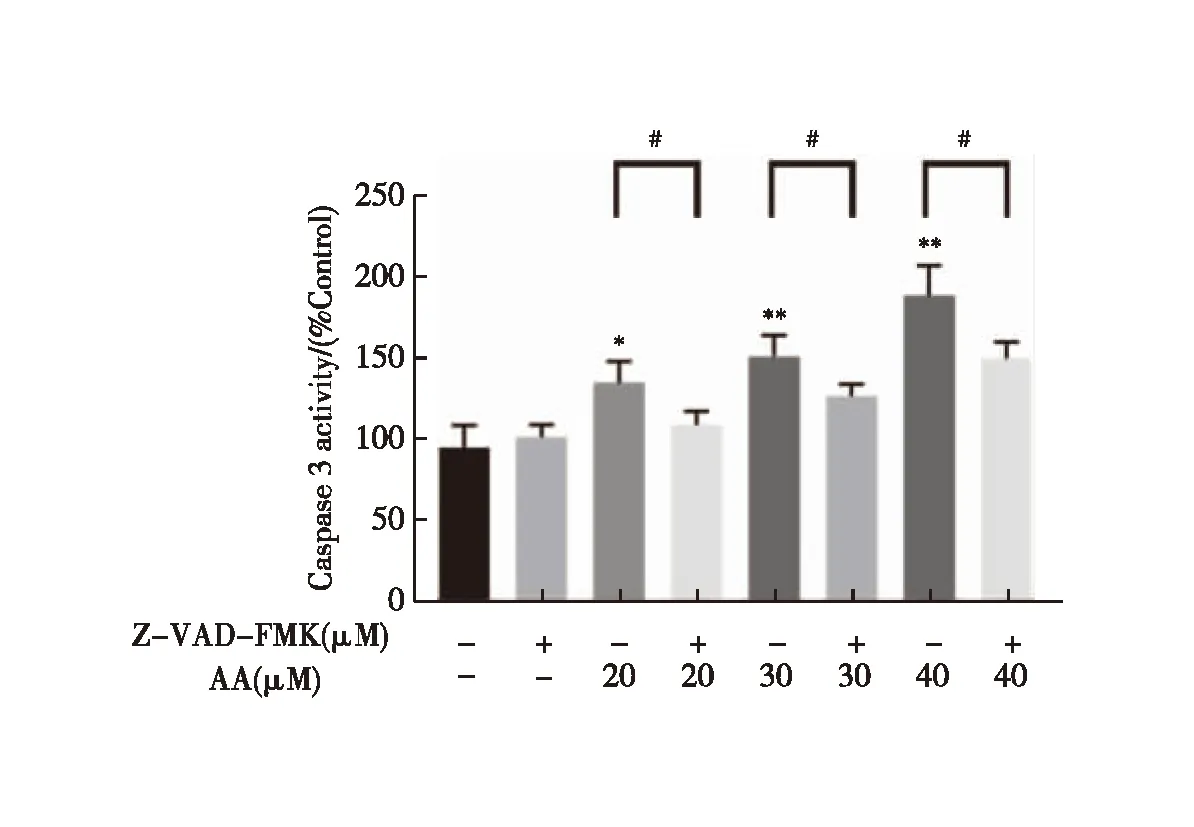
注:与相应对照组比较,#P<0.05与各相应浓度给药组比较,*P<0.05,**P<0.01图6 AA对DU145细胞Caspase 3活性的影响
2.7 AA及Z-VAD-FMK对DU145细胞存活率的影响
结果见图7,与各相应浓度的AA组比较,AA与Caspase 3抑制剂Z-VAD-FMK混合处理组的细胞存活率显著升高(P<0.05,P<0.01)。而Z-VAD-FMK单独干预组细胞生存率与空白组无差异。以上结果表明,Z-VAD-FMK能够逆转AA诱导的DU145细胞死亡。
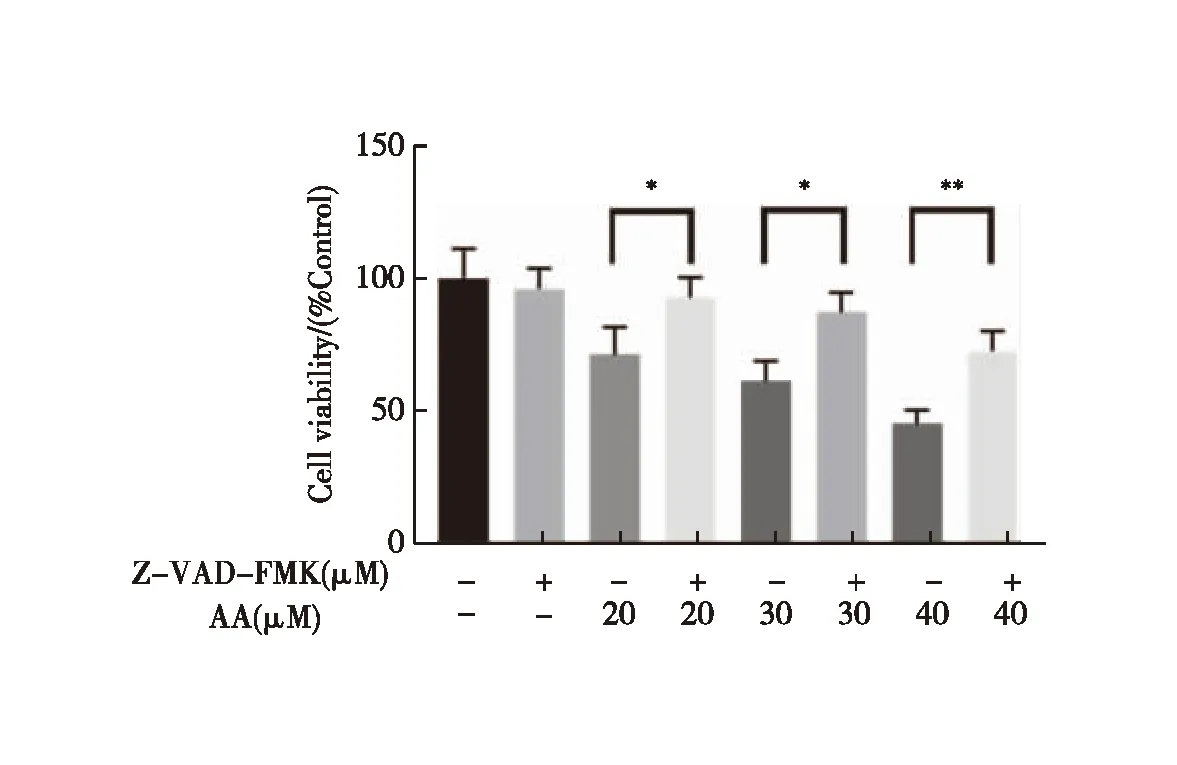
注:与相应对照组比较,*P<0.05,**P<0.01图7 Z-VAD-FMK对DU145细胞的影响
3 讨论
不受控制的细胞增殖是恶性肿瘤最突出的特征之一,能否有效抑制肿瘤细胞增殖是研发抗肿瘤药物的重要标尺[8]。本研究中,AA能够改变前列腺癌DU145细胞的正常形态,并能够以浓度及时间依赖性方式抑制其增殖,提示AA具有较好的抗前列腺癌潜力。
细胞凋亡是细胞在生理或病理状况时,受多种基因调控自发结束细胞生命的程序性死亡过程,在胚胎发育、组织器官形成及衰老和病态细胞的清楚中具有积极意义[9]。然而,因各种因素致使细胞出现凋亡逃逸,是恶性肿瘤进展的关键。因此,恢复或诱导肿瘤细胞发生凋亡的能力被认作杀伤肿瘤细胞的有效策略,这亦是包括化疗药在内的多数药物遏制肿瘤的重要机制[10]。本研究中,AA能够诱导DU145细胞凋亡,且诱导的凋亡率与其浓度呈正相关,进一步提示AA的抗前列腺癌的能力。
Bcl-2家族成员中,Bax作为凋亡的诱导蛋白,而Bcl-2则是凋亡的抑制蛋白,这两种蛋白可调控线粒体途径的细胞凋亡,而二者比值的变化则一定程度上反映了细胞凋亡的进程,在凋亡过程中发挥至关重要的作用[11-12]。线粒体中的Cyt-C也是调控凋亡的关键蛋白[13]。Cyt-C由线粒体释放至胞质后,激活了Caspase的活性,这一过程受Bcl-2家族调控[14],而凋亡的发生即为Caspase家族成员介导的酶促级联反应,而其过程的最终执行蛋白则为Caspase 3[15]。随着Caspase 3的激活,细胞进入不可逆凋亡状态。本研究中,AA能够显著上调细胞中Bax、Cleaved Caspase 3、Cyt-C的蛋白表达,下调Bcl-2蛋白表达。此外,AA能够诱导DU145细胞中Caspase 3的活化,而Caspase抑制剂Z-VAD-FMK能够逆转DU145细胞的Caspase 3活化和增殖抑制。以上结果表明AA能够诱导DU145细胞发生线粒体途径凋亡。
综上,AA能够通过增殖抑制及诱导线粒体途径凋亡发挥抗前列腺癌作用。但本研究仅对前列腺癌DU145细胞进行了体外初步论证,存在一定的局限性,后续将纳入其余前列腺癌PC-3等细胞系及设计体内实验,进一步确认AA的抗前列腺癌作用。

