局部麻醉下肺肿瘤微波消融术中疼痛的影响因素分析
周坚,谈谈
国家癌症中心发布的数据显示,我国恶性肿瘤中发病率及死亡率均位列第一的是原发性肺癌[1]。原发于其他部位的恶性肿瘤转移至肺部也很常见[2]。在当前的治疗模式中,电视辅助胸腔镜手术(video-assisted thoracoscopic surgery,VATS)仍是治疗早期肺肿瘤或预后较好的肺部转移瘤的主要方法。但对于部分影像学特征考虑为原发性肺肿瘤或肺部孤立性转移瘤的患者,往往因为高龄、心肺功能受限及其他严重合并症等原因,无法行外科手术治疗;或对于已经历过肺切除术的患者,再次行VATS肺切除术可能使患者损失更多的肺功能,患者术后出现呼吸衰竭的风险更大[3]。因此,这类患者需要有更适合的替代治疗方案,如立体定向体部放射治疗(stereotactic body radiotherapy,SBRT)、热消融法或冷冻消融法等,其中射频消融(radiofrequency ablation,RFA)和微波消融(microwave ablation,MWA)属于热消融。MWA具有更加微创化、麻醉要求低、肺组织或肺功能损失小、可重复等优点,已逐渐成为肺肿瘤的热门替代治疗方案[4]。有研究发现,对于早期肺癌患者,VATS与MWA的5年生存率差异无统计学意义[5];而对于中晚期肺肿瘤患者,合理地应用MWA也可明显减轻患者的肿瘤负荷,或缓解因肿瘤导致的疼痛,进而延长生存期和提高生活质量[6]。在实际临床观察中发现,疼痛是MWA治疗肺部肿瘤术中及术后常见的不良反应,且患者对局部浸润麻醉的反应不一[7]。本研究选取行局部浸润麻醉CT引导下经皮行肺肿瘤MWA手术的患者,研究其术中疼痛的相关影响因素,为临床治疗和护理过程中减轻患者疼痛提供依据。
1 资料与方法
1.1 一般资料
选取2021年7月至2022年9月在南京医科大学附属老年医院胸外科进行MWA手术的肺肿瘤患者50例。纳入标准:①病理检查明确为肺恶性肿瘤,但患者不能耐受VATS肺切除术或拒绝行手术切除;②治疗后复发的单发病灶或遗留的病灶;患者无法耐受手术或拒绝再次手术;③孤立的肺结节,经影像学形态分析提示为高危结节;或具有高风险的肺结节且经多学科会诊同意实施MWA治疗;④既往有其他系统(如肾、结直肠、乳腺、肝等)恶性肿瘤病史且肺内结节高度怀疑为转移灶。排除标准:①单次多个病灶消融;②单个病灶多次消融;③全麻或静脉麻醉。
1.2 方法
1.2.1 术前准备 对入院的所有患者进行病史采集和体格检查。根据患者特点积极完善术前必要的辅助检查,包括但不限于血常规、凝血功能、肝肾功能、电解质、心电图、肺功能、心脏彩超及胸部CT、头颅MRI等。初步确定患者符合MWA适应证;术者根据病灶部位、直径、深度等因素设定穿刺及消融方案。
1.2.2 利用CT引导的经皮肺肿瘤穿刺MWA术 物品准备:无菌单若干、消融用设备(一次性微波消融针、消融机器购自南京亿高医疗设备有限公司),便携式心电监护仪,各型号注射器及输液器若干,500 ml生理盐水,5%葡萄糖溶液若干,麻醉药物(2%利多卡因),相关药物(镇痛类、止咳类、止血类、扩血管类、降压及升压类),吸氧设备,胸腔闭式引流术所需设备(胸腔引流管或一次性猪尾导管、胸穿包、一次性胸腔闭式引流瓶等),其他抢救药品及设备。患者准备:对准备行MWA的患者行术前教育,包括对消融术的认识,行呼吸训练及气道管理,心理准备及指导如何进行术中配合等;局部麻醉前4 h对患者禁食、禁水;常规建立静脉通道;术区皮肤清洁;术前半小时左右使用1次中枢性镇咳剂和阿片类镇痛药物,必要时使用镇静类药物。治疗准备:制定术前治疗计划,主要包括:①确定病变区域;②体位选择;③穿刺路径及测量“靶皮距”等。消融过程:①CT引导下定位肺肿瘤体表穿刺点;②常规消毒铺巾;在穿刺点附近实施局部浸润麻醉(麻醉药物为2%利多卡因),必要时采用长针头,严格无菌操作;③将微波消融针从体表定位点开始沿着穿刺路径分步进针,动态调整,直至消融针尖到达预定的消融靶区;术中同步开始经静脉通道使用非甾体类镇痛药物用;④根据肺肿瘤的特点,如性质、大小等为依据制定消融机器的参数,包括功率、时间、循环等;消融结束前需进行针道消融;⑤在整个消融手术的过程中,需动态扫描CT,以监测消融针是否脱靶、消融范围是否覆盖肺肿瘤,以及术中是否发生了相关并发症(如出血、气胸)。在整个手术过程中,利用便携式监护仪监测患者的生命体征,包括心率、血压、血氧饱和度、呼吸等;时刻关注患者主诉及出现的症状,如疼痛、胸闷、咯血等,必要时予对症处理;在此过程中收集并记录患者的疼痛视觉模拟评分(visual analogue scale,VAS)评分;⑥即刻疗效评价:术后再次扫描CT,主要目的如下:观察消融效果,如果要达到完全消融,消融后靶区周围的磨玻璃影至少要大于消融前病变区域边界5 mm,再次观察有无并发症,如气胸、胸腔积液、咯血等,术后监测生命体征,复查胸片、胸部CT等,观察有无并发症并予以对症处理。
1.2.3 研究指标的获取 ①患者的一般资料:年龄、性别、吸烟史、有无肺部慢性疾病病史等;②肺肿瘤相关参数:肺肿瘤位置、肺肿瘤最大径、性质;③消融相关参数:消融针尖距胸膜垂直距离、肺肿瘤对应的胸膜腔有无局部气胸产生、消融次数以及消融功率等;④VAS:于患者行消融术中最疼痛时评分。本研究对VAS评分稍加改良如下:0分为无痛;1~3分为轻度疼痛,完全可以忍受疼痛并能完成消融过程;4~6分为中度疼痛,尚可忍受疼痛,觉得自己能坚持继续消融;7~10分为重度疼痛,逐渐难以忍受并感觉自己不能再坚持完成消融过程。依据VAS评分中位数,将本组50例患者分为两组:0~4分为轻度疼痛组(28例),5~10分为中重度疼痛组(22例)。
1.3 统计学方法
运用SPSS 23软件对研究数据进行统计学分析。计量资料以均数±标准差表示,计数资料以例(%)表示,两组比较采用卡方检验。多因素分析采用Logistic回归模型。采用Pearson相关分析消融术中VAS评分与消融针尖距胸膜垂直距离、年龄的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料分析
50例患者中,男23例,女27例,年龄35~82(67.6±12.0)岁;吸烟者18例,不吸烟者32例;结节位于左肺26例,位于右肺24例;无肺部基础疾病或肺部治疗史者7例,有肺部基础疾病或肺部治疗史者43例。19例为纯磨玻璃成分,31例为部分实性或实性成分结节;结节直径平均(13.60±6.64)mm;在消融过程中15例患者因穿刺原因导致结节对应胸膜下位置产生气胸,15例未产生气胸;消融针尖距胸膜垂直距离平均(26.31±11.93)mm;11例仅行1次消融,39例行2次及以上消融。30例消融功率≤40 W,20例消融功率>40 W。术中患者VAS评分(4.38±2.32)分。4例患者术后出现了大量的气胸,后经胸腔闭式引流后好转;1例患者出现中等量的咯血,予止血等保守治疗后好转。
2.2 患者疼痛的因素分析
轻度疼痛组与重度疼痛组的年龄、气胸、消融针尖距胸膜垂直距离差异有统计学意义(表1)。以P<0.4的指标为潜在影响因素,将年龄、吸烟史、结节性质、气胸、消融针尖距胸膜垂直距离及消融功率等因素纳入Logistic回归模型,结果显示:消融针尖距胸膜垂直距离为引起疼痛的独立影响因素(P=0.002,表2);进一步行Pearson相关性分析显示,消融术中消融针尖距胸膜垂直距离与VAS评分呈高度负相关(r=-0.803,P<0.001,图1);年龄与VAS评分无相关性(r=-0.063,P=0.659,图2)。
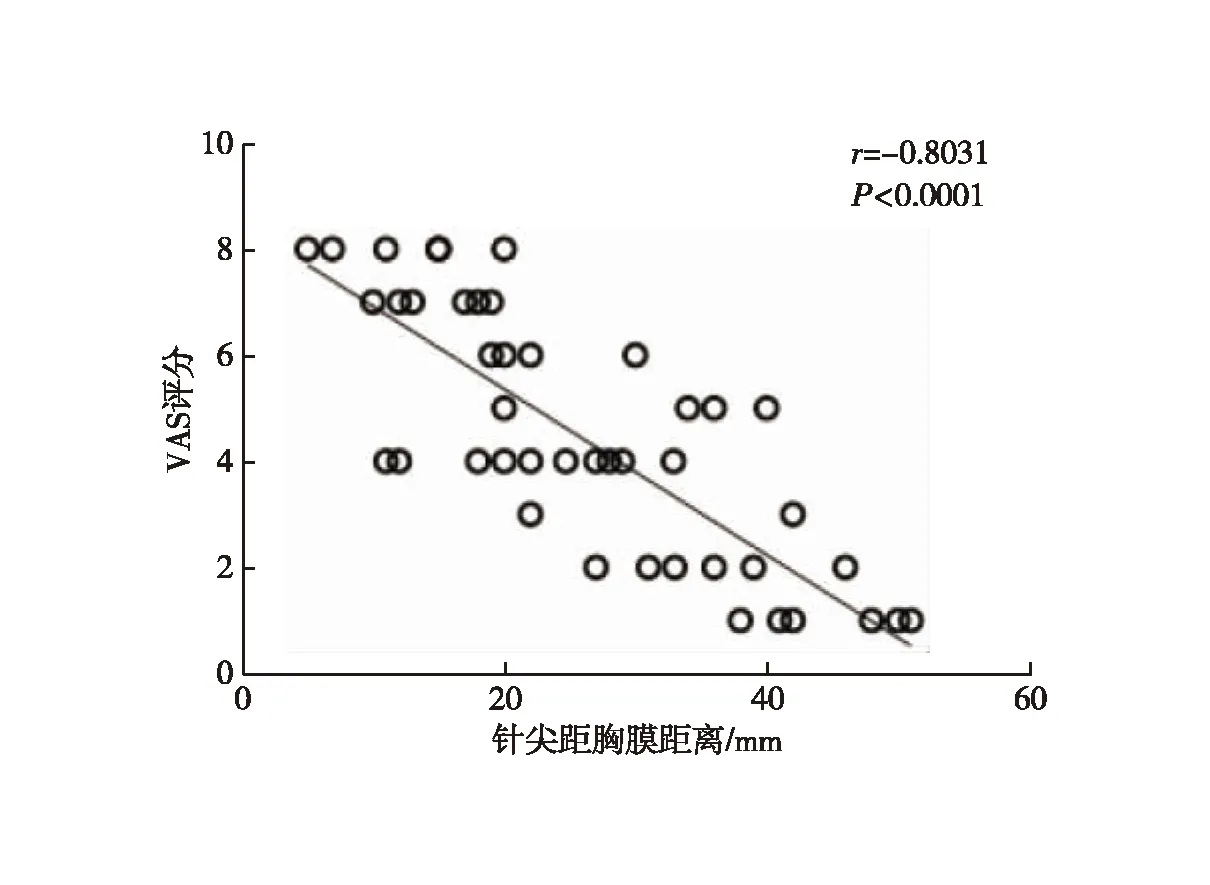
图1 患者消融针尖距胸膜垂直距离与VAS评分的相关性
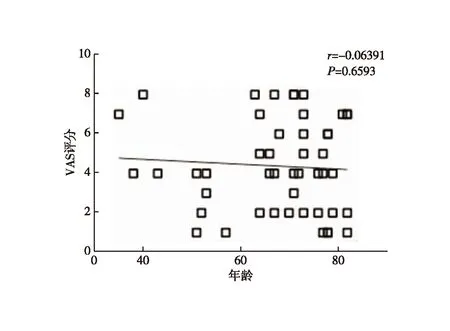
图2 患者年龄与VAS评分的相关性
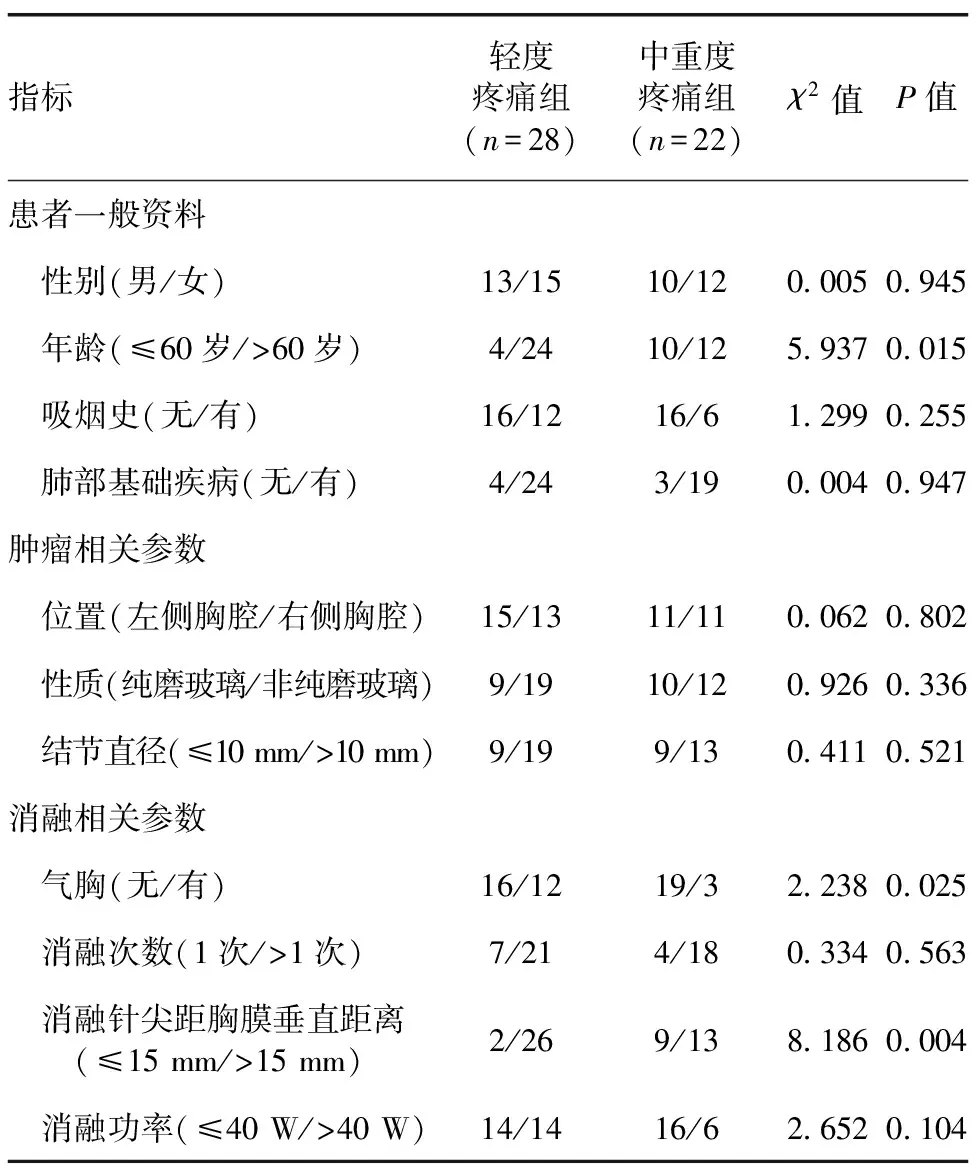
表1 轻度疼痛组与中重度疼痛组患者的相关资料分析
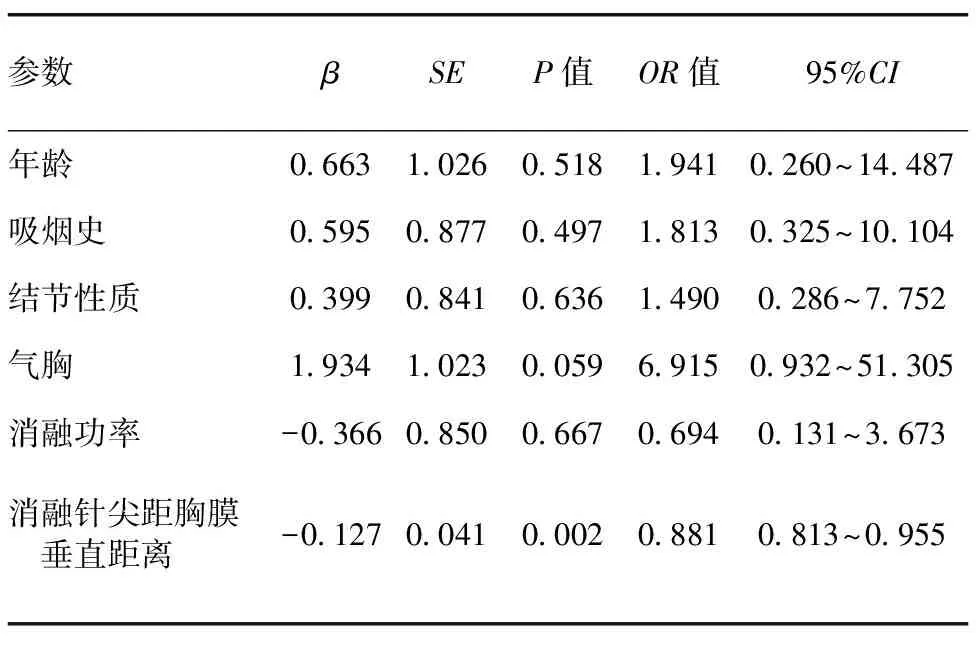
表2 患者疼痛相关影响因素的Logistic回归分析结果
3 讨论
MWA术是一种精确的微创治疗技术,其原理与家用微波炉同理,都是利用特定的电磁波来产生组织加热效果,对肿瘤细胞造成直接的、不可逆的损伤或凝固性坏死。根据生产厂商不同,915 mHz或2 450 mHz频率的微波最常用,高频微波的震荡引起水分子等极性分子快速旋转,将能量转化成热量,在短时间内产生超过60 ℃的高温,直接“烧死”肿瘤细胞;坏死的细胞可进一步释放热休克蛋白,刺激机体的免疫系统,抑制肿瘤细胞进一步发展[8]。通过相关操作平台,如CT、磁共振甚至是VATS等技术,将微波针(针状辐射器)穿刺进入瘤体内,使微波能集中在一定范围内,故而能有效地辐射至所需靶区;同时,由于肺脏的组织特点不同,微波产生的热辐射在肺内有更高的对流性和更低的热沉降效应[9],其治疗肺肿瘤的疗效方面也得到了验证[4]。利用MWA技术治疗肺肿瘤,可以做到更微创化,费用更低,患者恢复期短,还能降低肿瘤复发风险。但是疼痛是消融术中及术后常见的不良反应,疼痛严重时会影响消融进程甚至不能完成消融治疗过程。通过改变麻醉方式为静脉麻醉或全麻可明显改善患者的舒适性,减少疼痛感受。但在实际临床操作中,大部分接受MWA的患者因各种原因不能耐受静脉麻醉或全麻,只能接受局部麻醉,此外,静脉麻醉或全麻在一定程度上增加了经济负担,若是患者术中不能有效配合,也耗费了时间。降低消融功率或缩短消融时间也可减轻疼痛程度,但是也牺牲了消融效果。
本研究结果显示,采用局部麻醉CT引导下肺肿瘤MWA术患者的疼痛主要与消融术中消融针尖距胸膜的垂直距离呈负相关,也就是说消融针尖位置越深,疼痛越轻。以往研究也有类似的结论。如Okuma等[10]在研究肺肿瘤行RFA过程中发现,距胸壁距离<1 cm的肺肿瘤更易出现疼痛;山东大学韩旭建[11]研究也发现,病灶深度是MWA术中疼痛的独立影响因素;Hu等[12]研究也发现胸膜至病变的距离是发生中度或重度疼痛的重要影响因素。本研究更侧重于消融针尖距胸膜的垂直距离,因为在实际操作中,消融针尖往往需要超过肿瘤远端才能产生更好的消融效果;同时术中可能存在不同的穿刺角度导致辐射器位置不一定处于肺肿瘤最深处(图3)。因此笔者认为将消融针尖距胸膜垂直距离作为评价指标更准确。

图3 消融针尖距胸膜距离
消融术中疼痛的产生可能是因为在对肺肿瘤进行MWA时,消融术区的热量通过肺组织传导至壁层胸膜,刺激胸壁的相关神经等所致。从解剖角度讲,肺表面的胸膜为脏层胸膜,胸壁内侧的胸膜为壁层胸膜。两胸膜相连贴近,脏层胸膜神经主要来自肺丛迷走神经和交感神经分布,为内脏感觉神经,对痛温等刺激不敏感;而壁层胸膜神经来自脊神经的躯体感觉神经分布,受机械刺激可引起剧烈疼痛[13]。消融针尖位置较深时,热量远离壁层胸膜,刺激减少,从而疼痛减轻。本研究还发现,在消融时,如肺肿瘤对应胸膜腔因穿刺原因形成了气胸,患者的VAS评分也较未产生气胸的患者低(图4)。主要是因为肺肿瘤对应的胸膜腔形成气胸时,隔离了肺组织及壁层胸膜,隔绝了热量的传导,保护胸壁神经少受或不受损伤,从而减轻了疼痛。人工气胸技术被认为是有效地减轻疼痛及重要组织保护的重要手段[7,14]。本研究也间接地证实了这一点。也有个别报道显示人工液胸在降低MWA术中疼痛和保护周围器官方面效果显著[15]。人工气胸或人工液胸的建立也有其局限性,操作难度较大;如患者存在严重的胸膜粘连或呼吸功能不全,建立人工气胸会失败,或者导致患者无法耐受[16]。
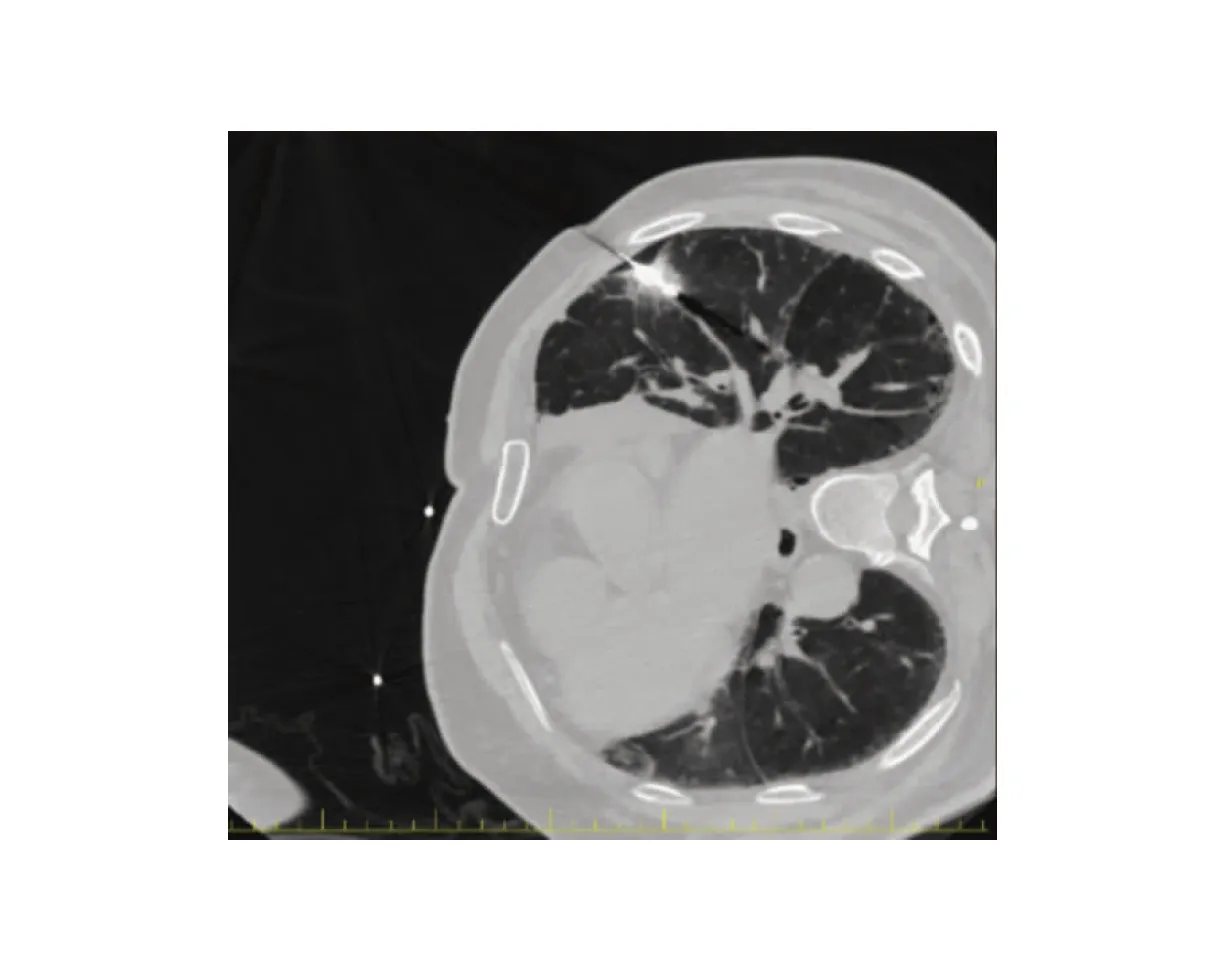
图4 肺肿瘤对应胸膜表面产生气胸
本研究还发现轻度疼痛组与重度疼痛组的年龄差异有统计学意义,但行相关分析未见二者有明确相关性。行Logistic回归分析发现消融针尖距胸膜垂直距离为MWA术中疼痛的独立影响因素,而气胸的发生、年龄等则无统计学意义,原因可能是本研究纳入病例数较小,且患者多为高龄患者,未来需要更大的样本量研究进一步验证。

