不同HBV基因型乙肝相关肝细胞癌患者的临床特征和血管内皮生长因子及其受体在肝癌组织中的表达
白露,李庆刚
(郑州大学第一附属医院 感染科,河南 郑州 450000)
乙型肝炎病毒(hepatitis B virus,HBV)是一种包含4个重叠的开放阅读框的球形DNA病毒,感染后能引起急性肝炎、慢性肝炎和重型肝炎等。其中部分慢性肝炎可演变成肝硬化或肝癌。乙型肝炎已成为世界范围内危害人类健康的疾病,我国现存70万稳定HBV感染者,给社会和家庭造成沉重负担。HBV具有病毒复制产量高和突变率高等特征,现已至少形成A~I 9种基因型,根据目前报道HBV基因型和亚基因型具有不同的地理分布,还可能受到社会人口学、种族或迁徙因素的影响,其分型影响许多临床疾病特征和对治疗的反应,尽管关于HBV基因型分布的报道很多,但研究之间存在很大差异[1-2]。目前我国HBV以B型和C型最为常见,其中B型主要分布于南方,而C型则多见于北方、中原和华东地区,兼有少量B+C混合型和D型。临床研究表明,HBV的基因型与疾病进程、感染后临床表现、预后和抗病毒治疗应答等密切相关。例如,B型患者对普通干扰素和聚乙二醇干扰素为主的治疗均敏感,累积生存率高于C型;与B型相比,C型患者血清乙型肝炎表面抗原出现迟,清除慢,核酸复制力强,更易进展为肝纤维化和肝癌,仅对聚乙二醇干扰素治疗敏感;D型容易在年轻患者中引发原发性肝细胞癌。因此,对HBV进行基因分型具有重要的临床意义。临床上目前对于HBV基因型与乙型肝炎相关肝细胞癌临床特征和血管内皮生长因子(vascular endothelial growth factor,VEGF)和受体(Flt-1,Flk-1)在肝癌组织中表达关系的研究较少,本研究基于此对其展开研究。
1 资料与方法
1.1 一般资料
前瞻性纳入2020年10月至2022年10月在郑州大学第一附属医院就诊住院的200例乙型肝炎相关肝细胞癌患者作为研究对象,根据HBV基因型检测结果将患者分为HBV基因型B型组101例,HBV基因型C型组90例,HBV基因型D型组9例。纳入标准:(1)年龄>18岁;(2)乙型肝炎核心抗体阳性和表面抗原阴性;(3)临床资料、病程等相关资料完整可查。剔除标准:(1)合并其他肿瘤、心力衰竭、心肌梗死、严重感染、免疫系统疾病及严重心、肝、肾功能不全;(2)依从性差或沟通障碍等条件脱落研究。本研究经医院医学伦理委员会审批同意,患者对此研究知情同意。3组一般资料见表1。

表1 3组患者一般资料比较
1.2 研究方法
采集病史并检测各组肝功能相关指标以及VEGF和受体(Flt-1,Flk-1)的表达,分析肝功能相关指标[甲胎蛋白(alpha-fetoprotein,AFP)水平以及HBV载量、Child-Pugh评分]以及VEGF和受体(Flt-1,Flk-1)的表达的差异。VEGF和受体(Flt-1,Flk-1)在肝癌组织中的表达:抽提肝癌组织样本RNA,利用NCBI网站设计VEGF和受体(Flt-1,Flk-1)引物并合成样本模板DNA,进行实时定量PCR。
1.3 统计学方法

2 结果
2.1 不同HBV基因型肝癌患者的肿瘤标志物、病毒载量以及肝功能比较
HBV基因型C型肝细胞癌患者AFP以及HBV病毒载量、肝功能评分较HBV基因型B型肝细胞癌与HBV基因型D型肝细胞癌更高,差异有统计学意义(P<0.05),见表2。
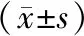
表2 不同HBV基因型肝癌患者的肿瘤标志物、病毒载量以及肝功能比较
2.2 VEGF、VEGFR(Flt-1,Flk-1)在不同HBV基因型肝癌组织中表达比较
HBV基因型C型肝细胞癌患者VEGF及其受体(Flt-1,Flk-1)表达较HBV基因型B型肝细胞癌与HBV基因型D型肝细胞癌更高,差异有统计学意义(P<0.05),见表3。
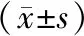
表3 VEGF和受体(Flt-1,Flk-1)在不同HBV基因型患者的水平比较
3 讨论
HBV感染是一种全球性公共卫生问题,其严重程度与HBV的基因型有关。而在乙型肝炎患者中,VEGF和受体的水平与肝功能的分级也存在关联。本研究根据其HBV基因型的不同,将其分为不同组别,研究结果显示,HBV基因型C型肝细胞癌患者AFP水平以及HBV载量、Child-Pugh评分、VEGF及其受体(Flt-1,Flk-1)表达较HBV基因型B型肝细胞癌与HBV基因型D型肝细胞癌更高。这表明不同HBV基因型可能对VEGF和受体的表达产生不同的调控效应,这暗示了HBV基因型对肝功能的影响可能部分通过调节VEGF和受体的表达来实现。
HBV基因型C型肝细胞癌HCC患者甲胎蛋白AFP水平的升高以及HBV载量和Child-Pugh评分的增加可能与以下机制有关。(1)HBV基因型C型是一种较为致病的基因型,与其他基因型相比,HBV基因型C型更容易引起慢性乙型肝炎,并增加患者发展为肝细胞癌的风险;持续的HBV感染可以导致肝细胞的炎症和损伤,促进肝细胞癌的发展,并导致AFP水平的升高。(2)HBV感染引起的持续肝脏炎症和损伤可以导致肝功能的损害,从而使Child-Pugh评分升高[3]。Child-Pugh评分是评估肝功能的指标,包括总胆红素水平、血清白蛋白水平、凝血功能等指标,这些指标的异常可以反映肝脏的损伤程度。加上HBV感染是肝细胞癌的重要危险因素之一[4]。(3)在HBV感染的过程中,病毒基因组的整合和突变可能导致肿瘤抑制基因的失活和肿瘤促进基因的激活,从而促进肝细胞癌的发展。肝细胞癌的发展过程中,AFP水平往往升高,与肿瘤细胞产生AFP的能力增强有关。(4)HBV感染引起的肝脏炎症和损伤可能导致免疫调节的失衡。免疫调节失衡可能导致免疫抑制功能的降低,使得HBV感染的控制受到影响,HBV载量增加[5]。同时,免疫调节失衡也可能导致肿瘤免疫逃逸,使肝细胞癌的发展更为侵袭性。总之,HBV基因型C型肝细胞癌患者甲胎蛋白水平的升高以及HBV载量和Child-Pugh评分的增加可能是多种复杂机制的结果,包括HBV感染、肝脏损伤、肝细胞癌的发展以及免疫调节失衡等[6-7]。而HBV基因型C与B和D相比,可能具有更高的致病性和癌变潜力。HBV基因型C感染的肝细胞可能会产生更多的病理变化,包括累积的基因突变和异常细胞增殖,从而导致更高水平的VEGF和其受体的表达。HBV感染引起的肝炎和炎症反应是肝细胞癌发生的重要因素。HBV基因型C患者可能更容易出现持续性炎症反应,导致持续性的VEGF表达增加[8]。炎症反应中的细胞因子和炎症介质也可能通过调节VEGF和其受体的表达来增加肿瘤血管生成。HBV基因型C感染可能导致一系列基因的表达改变。研究发现,HBV基因型C感染与VEGF及其受体的过度表达相关的基因调控元件存在差异。这些基因调控元件的改变可能导致HBV基因型C肝细胞癌细胞更容易产生VEGF和其受体,从而促进肿瘤生长和血管生成[9-10]。此外HBV感染的机制非常复杂,可能受多个因素的影响。例如,病毒突变、宿主基因多态性、免疫反应等都可能与HBV基因型C肝细胞癌中VEGF及其受体的高表达有关。
4 结论
不同HBV基因型患者的肿瘤标志物、病毒载量以及肝功能比较有区别,对于确诊的肝细胞癌患者及时进行HBV基因型检测和VEGF及其受体(Flt-1,Flk-1)表达检测对于治疗以及预后具有指导意义。

