血清miR-210、miR-133水平在不同TOAST分型老年脑梗死患者中的变化及对预后的预测价值
赵君,任瑞芳,贵永堃,朱德位,孙玉莹
(新乡医学院第一附属医院 神经内科,河南 新乡 453100)
脑梗死又称缺血性脑卒中,是临床最常见的一种脑血管疾病,多发于60岁以上老年群体,可引发偏瘫、语言障碍及共济失调等局灶性障碍,患者面临着较高的残疾及死亡风险[1]。急性缺血性脑卒中试验(trial of Org 10172 in acute stroke treatment,TOAST)[2]是国内外公认的脑梗死病因学分类标准,可为该病诊断及预后判断提供参考,但该方式需进行多项辅助检查,不仅花费较长时间,且具有有创性,因此近年来探究有效的生物学标志物辅助分型备受关注[3]。微小RNA(microRNA,miR)是一类内源性非编码短序列RNA,通过调控基因转录后水平参与蛋白表达,广泛参与代谢性疾病及心血管疾病的病理生理过程[4-5]。miR-210、miR-133是常见的miRNA亚型,可通过介导炎症反应、血管新生及脑氧代谢等在脑梗死发生及发展中发挥重要作用[6-7]。本研究选取210例老年脑梗死患者作为研究对象,观察研究血清miR-210、miR-133水平在不同TOAST分型患者中的变化,及其对预后的预测价值。
1 对象与方法
1.1 研究对象
选取2019年1月至2021年12月新乡医学院第一附属医院收治的210例老年脑梗死患者,设为疾病组。纳入标准:(1)符合《中国急性缺血性脑卒中诊治指南2014》[8]中脑梗死诊断标准,经颅脑影像学检查确诊;(2)年龄>60岁;(3)发病至入院时间<72 h;(4)首次发病;(5)临床资料完整;(6)可接受短期随访。排除标准:(1)合并自身免疫性疾病、感染性疾病;(2)脑出血、蛛网膜下腔出血;(3)无症状静止性脑梗死;(4)意识障碍;(5)合并急性心肌梗死;(6)肝、肾等主要器官功能不全;(7)近14 d外伤史、外科手术史;(8)恶性肿瘤。另选取同期于本院进行体检的50例健康人员,设为健康组。本研究经医院医学伦理委员会批准后进行,所有受试者均知情同意。
1.2 研究方法
1.2.1疾病组TOAST分型标准
根据美国TOAST标准[2],将疾病组患者分为大动脉粥样硬化性脑梗死(large artery atherosclerosis,LAA)、小动脉闭塞性脑梗死(small-artery occlusion,SAO)、心源性脑梗死(cardioembolism,CE)、其他病因脑梗死(other determined etiology,OC)、病因不明脑梗死(undetermined etiology,UE)共5个主要亚型。由2位神经科医生单独进行分型,均经过专业分型培训,工作年限>5 a,针对分型不统一的患者由2位医生讨论后确定。
1.2.2血清miR-210、miR-133水平检测
入院时,采集两组受试者清晨空腹静脉血5 mL,置于离心管中,离心10 min(3 800 r·min-1,离心半径10 cm),取上清,采用实时荧光定量PCR法检测。Trizol试剂盒提取总RNA,紫外分光光度计(美国美林恒通公司)测量纯度。取总RNA样本2 μg,反转录获取cDNA,PCR和套式PCR扩增,凝胶电泳鉴定后行实时荧光定量PCR。按照试剂盒说明书设置反应体系,以U6为内参,计算血清miR-210、miR-133相对表达量。引物序列由生工生物工程(上海)股份有限公司合成。miR-210 上游引物:5’-TTACCAGGACACCGTGCATTGCAC-3’,下游引物:5’-CGTTGCCCGAGCCGTGCCACACGC-3’。miR-146b 上游引物:5’-CGCTTATGCGTGCAGTTGCGTCAC-3’,下游引物:5’-GCGCCGAACGCACGTAAACGTCAC-3’。
1.2.3疾病组预后判断
发病后30 d,根据改良Rankin量表(modified Rankin scale,mRS)[9-10]评价近期预后,总分0~6分,mRS>2分为预后不良,≤2分为预后良好。将预后不良患者设为不良组,预后良好患者设为良好组。由2位经过系统培训的神经科医生独立收集并记录,取均值。
1.2.4疾病组资料收集
收集疾病组患者临床资料,包括年龄、性别、体重指数(body mass index,BMI)、家族史、吸烟、饮酒、高血压、糖尿病、高脂血症、高尿酸血症、冠心病、总胆固醇(triglycerides,TC)、甘油三酯(triglycerides,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、高敏C反应蛋白(hypersensitiv C-reactive protein,hs-CRP)、治疗前美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分、梗死灶直径≥5 cm、发病至入院时间、脑梗死部位、多发性脑梗死、TOAST分型、血清miR-210、血清miR-133。
1.3 统计学处理

2 结果
2.1 疾病组TOAST分型结果
疾病组210例患者TOAST分型包括:LAA型37例(17.62%),SAO型98例(46.67%),CE型40例(19.05%),OC型18例(8.57%),UE型17例(8.09%),分别设置为LAA组、SAO组、CE组、OC组、UE组。
2.2 健康组及不同TOAST分型患者血清miR-210、miR-133水平
与健康组比较,SAO组、OC组、UE组、CE组、LAA组血清miR-210水平降低,miR-133水平升高(P<0.05);与SAO组、OC组、UE组比较,CE组、LAA组血清miR-210水平降低,miR-133水平升高(P<0.05);SAO组、OC组、UE组血清miR-210、miR-133水平比较,差异无统计学意义(P>0.05);CE组、LAA组血清miR-210、miR-133水平比较,差异无统计学意义(P>0.05)。见表1。
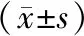
表1 健康组及不同TOAST分型患者血清miR-210、miR-133水平比较
2.3 预后情况
疾病组患者中,128例(60.95%)mRS评分≤2分,设置为预后良好组,82例(39.05%)mRS评分>2分,设置为预后不良组。
2.4 疾病组预后良好、预后不良患者临床资料
与预后良好组比较,预后不良组吸烟构成比、治疗前NIHSS评分、LAA型构成比、CE型构成比、SAO型构成比、血清miR-133水平升高,发病至入院时间延长,血清miR-210水平降低(P<0.05)。见表2。

表2 疾病组预后良好、预后不良患者临床资料比较
2.5 老年脑梗死患者预后的影响因素
以吸烟(否=0,是=1)、治疗前NIHSS评分(连续变量)、发病至入院时间(连续变量)、LAA型构成比(否=0,是=1)、CE型构成比(否=0,是=1)、SAO型构成比(否=0,是=1)、血清miR-210(连续变量)、血清miR-133(连续变量)为自变量,以老年脑梗死患者预后不良(否=0,是=1)作为因变量行多因素logistic回归分析。结果显示,吸烟、治疗前NIHSS评分、发病至入院时间、TOAST分型CE型、血清miR-210、血清miR-133均是老年脑梗死患者预后不良的危险因素(P<0.05)。见表3。

表3 logistic回归模型多因素分析
2.6 血清miR-210、miR-133水平对老年脑梗死患者预后的预测价值
ROC结果显示,血清miR-210、miR-133水平老年脑梗死患者近期预后不良的最佳截断点分别为1.07、0.65,两者单独及联合检测预测老年脑梗死患者近期预后不良的曲线下面积(area under the curve,AUC)分别为0.766、0.730、0.816。见表4。

表4 血清miR-210、miR-133水平预测老年脑梗死患者预后的效能
3 讨论
脑梗死病因复杂多样,且病理生理机制各不相同,有必要对其进行病因分型。目前,TOAST分型是国际公认的脑梗死病因学诊断标准,信效度较高。本组患者根据辅助检查结果,参照美国TOAST标准,将患者分为LAA型(17.62%)、SAO型(46.67%)、CE型(19.05%)、OC型(8.57%)、UE型(8.09%)5个主要亚型。构成比最大的为SAO型,其次为CE型及LAA型,与目前国外报道[11]结果相似。临床在确定脑梗死TOAST分型时,需完善颈部血管超声、心脏超声及大动脉数字减影血管造影技术,操作较为复杂。因此,研究新型生物学标志物与TOAST分型的关联,可对患者进行更好地分层,对高风险患者实施强化治疗,改善其预后,使更多患者受益。本研究中210例患者近期预后不良患者构成比为39.05%,略高于黄晋等[12]的36.67%,可能与本组患者均为老年人有关。
在TOAST分型中,CE型指心脏来源的栓子导致的脑部动脉闭塞,患者脑梗死病变面积较大,脑组织损伤严重且累及范围较为广泛,加之急性期神经内分泌系统发生变化加重心室负荷,侧支循环建立不佳,导致预后不良。LAA型主要脑动脉与皮质支均表现出不同程度的粥样硬化性病变,发病位置通常为髓鞘丰富的基底节及脑叶,且具有典型的血管堵塞及脑损伤表现,神经损伤程度较为严重。本研究结果显示,脑梗死患者血清miR-210水平均低于健康组,miR-133水平均高于健康组,以CE、LAA及SAO分型较为明显,且logistic逐步回归分析显示,吸烟、治疗前NIHSS评分、发病至入院时间、TOAST分型CE型、血清miR-210、血清miR-133均是老年脑梗死预后不良的危险因素,提示血清miR-210、miR-133水平与该病TOAST分型及近期预后密切相关。miR-210是一种乏氧激活因子,有体外实验发现在缺氧条件下其表达量上调,且对血管新生及神经再生具有促进作用[13]。Xu等[14]在一项基础动物研究中发现,脑梗死后miR-210表达降低,上调其表达可抑制神经元凋亡,促进血管与神经新生,从而减轻神经损伤。miR-133是横纹肌组织特异性miRNA,广泛表达于心肌及骨骼肌,参与心律失常、心脏发育及心肌凋亡等过程,以往关于其研究多集中在心血管疾病[15]。近年来有学者发现,miR-133可通过下调炎性相关蛋白及凋亡相关蛋白表达减轻新生大鼠脑神经元细胞焦亡[16],提示其与神经功能具有一定关联。与此同时,高静贵等[17]认为,miR-133b-3p可能通过调控相关信号通路加重大鼠脑缺血/再灌注损伤,抑制其表达则对大鼠神经元有保护作用。
本研究通过绘制ROC曲线评价血清miR-210、miR-133对老年脑梗死患者近期预后的预测效能,结果显示,血清miR-210、miR-133水平预测老年脑梗死患者近期预后不良的最佳截断点分别为1.07、0.65,两者单独及联合检测预测近期预后不良的AUC分别为0.766、0.730、0.816,提示两者联合检测对老年脑梗死患者近期预后有较高的预测效能。miR-210是目前公认的表达稳定且显著的miRNA之一,其与血清miR-133水平检测操作简单、准确性高,具有作为老年脑梗死患者诊断与疗效评估生物学标志物的潜在价值[18]。
4 结论
老年脑梗死患者血清miR-210、miR-133水平明显异常,且血清miR-210、miR-133水平与不同TOAST分型密切相关,血清miR-210、miR-133联合检测对老年脑梗死患者早期预后有较高预测效能。但本研究并未就血清miR-210、miR-133发挥作用的相关机制进行分析,而鉴于血清miR-210、miR-133与老年脑梗死患者不同TOAST分型及预后的关联,深入探讨两者在该病中的调控途径,对于进一步探究脑梗死发病机制具有重要作用,将作为今后研究方向展开。

