基于明胶/六偏磷酸钠/谷氨酰胺转氨酶复合水凝胶包埋体系的构建及作用机理
刘治芹,陈俊亮,任广跃,2,*,段 续,2,曹伟伟,李琳琳,赵梦月,金 鑫
(1.河南科技大学食品与生物工程学院,河南 洛阳 471000;2.粮食储藏安全河南省协同创新中心,河南 郑州 450001)
植物乳杆菌(Lactobacillusplantarum)可以平衡肠道微生物菌群,提高免疫功能,但由于植物乳杆菌在食品制造、运输、储存及人体胃肠道消化过程中会遇到环境压力,如高温、盐、氧气及胃液和胆盐等因素的影响,从而降低生物利用度,限制其功能特性的发挥[1]。为提高益生菌的稳定性和生物利用率,近年来已对益生菌的保护和递送机制进行了大量研究。水凝胶是由一种或多种天然或合成聚合物组成,通过化学共价键结合或非共价键进行物理交联,具有独特的三维交联网状结构,能够吸收大量水和体液而不溶解[2]。水凝胶能够保护益生菌免受其在食品加工过程中恶劣条件的影响,同时凝胶基质可以抵抗载体在胃肠道发生化学和酶降解,并有效地在结肠中释放其负载的生物成分,是目前研究中发现的一项较好的益生菌保护机制[3-4]。
明胶(gelatin,GE)是由胶原蛋白部分水解而来,是一种常用的蛋白质类水凝胶。由于GE包含了水凝胶及蛋白质的所有特征,具有良好的热可逆凝胶形成性、透明度、遇冷水不溶和体温熔点、促进细胞黏附等特征,且通过使用物理、化学和酶处理可以使本身具有优良性质的GE转变为水凝胶,使其成为益生菌包埋的重要材料[5]。Vaziri等[6]以海藻酸/果胶/GE为壁材对植物乳杆菌与富含DHA的油进行共包埋。Lopes等[7]将GE与海藻酸钠混合采用挤压法包埋鼠李糖乳杆菌。但GE与多糖之间是通过静电相互作用与阴离子多糖形成络合物,形成的凝胶强度较弱、稳定性和机械强度差、弹性低和对热敏感,在外部环境下具有分解或降解的趋势。研究表明GE的疏水氨基酸,如酪氨酸和脯氨酸,也可以用戊二醛、二异氰酸酯、碳二亚胺等进行交联获得稳定的凝胶材料,但是这些物质绝大多数有毒限制了其在食品工业中的应用。而磷酸化是一种改善蛋白质的功能性质有效且安全经济的方法,它可以通过增加蛋白质的电负性和降低蛋白质的等电点改变蛋白质的电荷状态[8]。蛋白质经磷酸化后,具有优良的功能性质,如胶凝、起泡、溶解、钙吸收、乳化性等,而且食品蛋白质的某些生理功能也可以通过磷酸化改善或赋予[9]。Cen Shijie等[10]研究了焦磷酸钠对鱼胶的凝胶、流变性和结构性能的影响。结果表明,磷酸化修饰显著提高了鱼GE的凝胶强度、结构性能、乳化性能和乳化稳定性。就食品安全而言,酶促磷酸化是食品蛋白质改性的最理想的方法,因为酶反应通常在更为温和的条件下产生均匀的产物。谷氨酰胺转氨酶(transglutaminase,TGase)能催化蛋白质之间(或蛋白质内部)的酰基转移反应,使蛋白质之间发生非共价交联,这种交联可以明显改善蛋白质的胶凝能力、热稳定性和持水性等[11-12]。如Chen Tianhong等[13]使用TGase催化GE/壳聚糖复合凝胶提高了GE的胶凝能力,Huang Tao等[14]使用TGase改善鱼GE/果胶复合物的凝胶性质。
虽然已有研究就GE水凝胶改性及包埋进行了大量研究。然而,已有关GE水凝胶及包埋体的研究主要针对乳清蛋白与多糖类聚合体等形成互穿插网络水凝胶,对于将TGase和六偏磷酸钠(sodium hexametaphosphate,SHMP)联合用于GE的修饰并作为益生菌包埋载体的研究相对较少。而SHMP无毒且易于胶凝,在溶液中会被水解成简单的磷酸盐,这种磷酸盐通常存在于任何生物体的细胞膜中,使其具有良好的生物相容性,已被证实是一种有效改进蛋白质凝胶性能的方法[15]。如Mccarthy等[16]发现添加SHMP可以增强浓缩乳清蛋白的功能特性,降低分散体的黏度。Rasouli等[17]研究了不同胶体和SHMP对乳清浓缩蛋白分散体的热稳定性、流变性能、微观结构及感官特性的影响,发现添加SHMP可使蛋白质稳定性提高,表观黏度改善。此外,TGase可以使蛋白质之间发生共价交联,这种交联可以使GE的结构更加稳定。因此,研究通过SHMP对GE进行修饰构建初级网络水凝胶,加入植物乳杆菌后利用TGase进一步修饰GE/SHMP,使其更有利于植物乳杆菌递送,以GE、GE/SHMP水凝胶及包埋体作为对照,利用物理和化学分析方法对水凝胶复合体系的结构及性能进行分析,探讨GE/SHMP/TGase的作用机理及包埋植物乳杆菌后对水凝胶性能的影响,以期为益生菌功能性食品的开发及贮藏提供理论依据。
1 材料与方法
1.1 材料与试剂
MRS肉汤、MRS固体培养基 北京奥博星生物技术有限公司;SHMP 天津德恩化学试剂有限公司;GE(动力160)郑州天顺食品添加剂有限公司;TGase(120~138 U/g)江苏一鸣生物股份有限公司;氯化钠 江苏强盛功能化学股份有限公司;植物乳杆菌由实验室保藏。
1.2 仪器与设备
TM3030Plus扫描电子显微镜(scanning electron microscope,SEM)日本日立高新技术公司;NIMl20-015V-1-I型低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)成像分析仪 上海纽迈电子科技有限公司;DHR-2型流变仪 美国Waters公司;DSC-1型差示扫描量热仪 瑞士Mettler-Toledo公司;VERTEX70型傅里叶变换中远红外光谱(Fourier transform mid-and far-infrared spectroscopy,FTIR)仪 德国Bruker公司;TA.XT Express食品物性分析仪 英国Stable Micro Systems公司;荧光分光光度计 美国Aglient Cary Elipse公司;恒温磁力搅拌水浴锅 常州诺基仪器有限公司;微波真空冷冻干燥机由实验室自制。
1.3 方法
1.3.1 菌悬液的制备
将-80 ℃贮藏的植物乳杆菌冻存液,按2%的接种量接种于MRS培养基中,传代培养2~3 代后,收集培养至稳定期前期的菌液,4 ℃、5000 r/min离心10 min,并重新悬浮于无菌NaCl溶液(0.75 g/100 mL)中,采用平板稀释涂布计数法测定该悬浮液的菌落总数,使其平均菌落总数在1×108~1×1010CFU/mL左右,放入4 ℃左右的冰箱中备用。
1.3.2 复合水凝胶包埋体的构建
磷酸化GE的制备参照Cen Shijie等[10]的方法,在40 ℃的水浴条件下,将3.5 g/100 mL的GE溶液以一定转速搅拌20 min使其溶解后,按GE/SHMP为35∶1加入SHMP,继续搅拌使GE和SHMP充分混合均匀,此时溶液形成稳定的乳化液。在持续搅拌下向溶液中滴加10%醋酸溶液于乳化液中,调节溶液pH 4.8,使GE和SHMP交联形成初级水凝胶,反应30 min后,将其置于4 ℃的冰箱中静置过夜。复合水凝胶包埋体系的构建参照Yan Wenjia等[18]的方法,在40 ℃水浴条件下,将上述制备的水凝胶以一定转速搅拌并以水凝胶-菌液(1∶4,V/V)的比例加入浓缩菌液,同时加入100 μL的吐温-80作为乳化剂,搅拌10 min使菌液被充分吸附在凝胶网络中,加入TGase(5 U/g(底物为GE)),40 ℃温水浴搅拌2 h后收集湿微胶囊进行分析。
1.3.3 凝胶强度测定
将GE、GE/SHMP、GE/SHMP/TGase水凝胶及包埋体鲜样倒入凝胶模具中,12 h后切割成20 mm高的圆柱体,采用圆柱形探(P/0.5 R),测前速率2.00 mm/s;测试速率1.00 mm/s;返回速率1.00 mm/s,触发力5 g,压缩变形程度40%。每组样品测试3 次,取平均值作为实验结果。
1.3.4 凝胶动力学测试
将GE、GE/SHMP、GE/SHMP/TGase水凝胶及包埋体鲜样,采用直径为40 mm的平板,设定测量间距1 mm,频率为1 Hz,在2.0%的线性黏弹性范围内,首先将凝胶样品以5 ℃/min的速率从40 ℃降至4 ℃,然后以扫描温度4 ℃,扫描时间3600 s,测定扫描过程中的储能模量G’随时间的变化,将G’随时间的动态变化方程拟合为胶凝动力学方程,见下式:
式中:Kgel为胶凝速率;t为胶凝时间;A和C为常数。
1.3.5 水分分布状态测定
将GE、GE/SHMP、GE/SHMP/TGase水凝胶及包埋体鲜样置于核磁瓶中,于4 ℃冰箱中贮藏12 h后,将核磁瓶放于25 cm样品管中并置于射频线圈中心。采用CPMG程序对样品进行测定,测量件如下:采样间隔时间4000.0 ms,累加次数8,前置放大1 倍,回波个数10000。采样结束后采用纽迈核磁共振反演软件对得到的CPMG指数衰减曲线进行反演,得到LF-NMR弛豫时间谱图。
1.3.6 热稳定性测定
将GE、GE/SHMP、GE/SHMP/TGase水凝胶及包埋体鲜样,称取10 mg于铝制坩埚中压片,以空坩埚为空白参照,起始温度25 ℃,终止温度200 ℃,扫描温度范围20~200 ℃,扫描速率为10 ℃/min进行各组凝胶的热稳定性分析,得到DSC热分析曲线。
1.3.7 复合凝胶包埋体结构特征测定
1.3.7.1 内源荧光光谱测定
参照Chen Hao等[19]的方法进行内源荧光光谱的测量。将GE、GE/SHMP、GE/SHMP/TGase水凝胶及包埋体鲜样放入石英试管中。用荧光分光光度计测定水凝胶中的内源荧光,设定激发波长为380 nm,发射波长为400~700 nm;激发和发射的狭缝宽度均为10 nm。用磷酸盐缓冲液(pH 7.0)作为空白组,所有样品均测量3 次。
1.3.7.2 FTIR光谱测定
将经微波真空冷冻干燥后的凝胶样品与KBr以1∶100的比例混合并研磨。使用FTIR光谱仪测定红外光谱。扫描范围为4000~400 cm-1,分辨率为4 cm-1,扫描次数为64 次。
1.3.7.3 水凝胶微观结构观察
在加速电压为10 kV和15 kV的条件下,将样品用碳导电胶带固定在样品支架上,用真空溅射镀膜机镀金后,使用TM3030Plus扫描电镜在放大5000 倍和500 倍下对微波真空冷冻干燥后的包埋体进行扫描,观察其表面结构。
1.3.8 复合凝胶包埋体中植物乳杆菌在模拟胃肠液中存活率及释放特性的测定
为模拟人体胃肠道的条件,根据Su Jiaqi等[20]的方法。将30 mL凝胶样品加入30 mL模拟胃液中,然后将混合物放入37 ℃恒温振荡培养箱,每隔30 min取样,连续测定1 h。用10%氢氧化钠溶液将经胃液消化后的混合物调节pH 6.8,并与等量的模拟肠液混合,将混合物在37 ℃振荡培养2 h,每隔30 min进行取样进行测定。模拟胃液的配制:用1.0 mol/L的盐酸将0.85%的无菌生理盐水调节至pH 2,然后加入含有3 g/L胃蛋白酶。模拟肠液的配制:用1.0 mol/L的NaOH溶液将0.85%的无菌生理盐水调节至pH 6.8,加入4.5 g/L的胆盐和1 g/L的胰酶。
1.3.9 复合水凝胶包埋体贮藏稳定性的测定
将上述制备的凝胶与游离的植物乳杆菌在4 ℃贮存30 d,测定植物乳杆菌在贮藏过程中的存活率。
1.4 数据处理与分析
使用OriginPro 2021和SPSS Statistics 20软件作图并进行方差分析(ANOVA;P<0.05)。
2 结果与分析
2.1 处理方式对复合水凝胶包埋体凝胶强度影响
通常情况下,凝胶强度受氨基酸含量、分子质量分布和提取过程的影响。由图1可知,SHMP和TGase修饰的GE复合体的强度高于单一经SHMP修饰的GE,说明经TGase修饰后能显著增加GE的凝胶强度。这可能是因为SHMP在体系中带负电荷,通过与带正电的GE通过静电相互作用形成聚合物,加入TGase后,催化聚集体形成了“超分子物质”,增强了体系的凝胶网络结构,这与Huang Tao等[12]的研究结果相似。虽然向体系中加入植物乳杆菌后可能会干扰凝胶基质中GE/SHMP或TGase分子的相互作用,导致凝胶网络不均匀,水凝胶的凝胶强度降低,但结果表明GE/SHMP/TGase复合水凝胶的胶强度显著高于GE/SHMP复合水凝胶及单一的GE水凝胶(P<0.05),说明GE/SHMP/TGase复合水凝胶包埋体的分子间作用力较强,有利于包埋的植物乳杆菌的抵抗不良环境的影响。

图1 复合凝胶包埋体凝胶强度分布图Fig.1 Gel strength of composite hydrogels
2.2 复合水凝胶包埋体胶凝动力学分析
如图2和表1所示,在最初0.5 h内所有凝胶体系的G’和损耗模量G”都以较快的速率增长,G’和G”在某一点(即凝胶点)相交后G’变得高于G”,这表明在冷却过程中形成了凝胶胶体。由于凝胶化过程是GE分子从无规卷曲变成三螺旋的过程,胶体网络结构形成后,G’随着时间的推移以较小的速率增加,表明GE及复合物继续形成三螺旋结构,进一步增强凝胶网络结构。对凝胶动力学方程进行分析,可以发现所有复合凝胶体系的G’和G”随着时间的延长凝胶G’在95%的置信区间内具有典型的一致变化。对图2B、D、F分析可知当加入植物乳杆菌后会减少分子之间的物理相互作用或共价交联键的数量,凝胶G’损失,从而影响凝胶网络连接,导致加菌后凝胶形成的速率比未加菌凝胶形成速率低。对比图2A、C、E可知,经改性后复合凝胶形成速率显著低于单一GE的胶凝速率,这是因为TGase催化GE产生空间效应从而形成了含有共价键的聚合物,该络合物限制了GE分子链的灵活性,从而降低了其凝胶化速率。有研究表明较低的凝胶速率会使凝胶的三维网络结构更加稳定[21],这也表明GE/SHMP/TGase水凝胶包埋体有利于植物乳杆菌长期稳定的存在。这也与Marcelo等[22]研究结构一致,该研究表明物理网络能够在空间上限制化学网络的增长。Hu Zizi等[23]通过TGase催化γ-聚谷氨酸(γ-polyglutamic acid,γ-PGA)对鱼GE进行改性,发现γ-PGA-TGase-FG具有类似的结果。
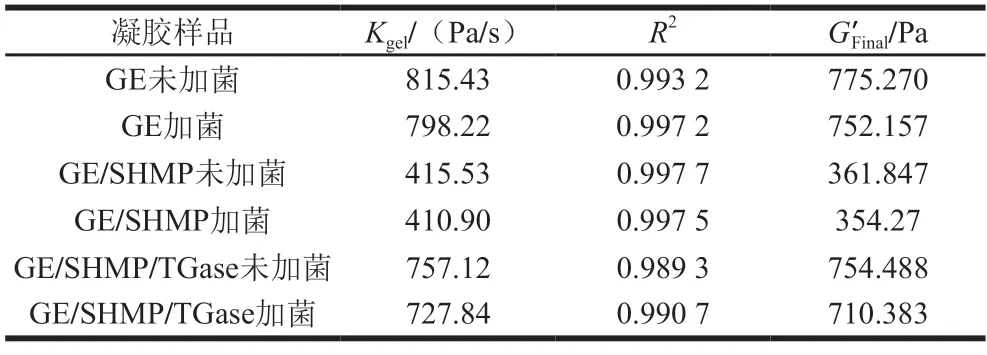
表1 TGase和SHMP复合修饰对胶凝胶动力学的影响Table 1 Effects of combined TGase and SHMP modification on gel kinetics
2.3 复合水凝胶包埋体水分分布状态分析
LF-NMR可以在不破坏凝胶结构的情况下反映凝胶系统内各种水分子部分的流动性和比例[24],其中弛豫时间(T2)包含3 个分量,即游离水(T23)、固定水(T22)和结合水(T21)[25]。通常凝胶的驰豫时间与水分子的结合程度呈反比,即水的自由度越低,测量时的驰豫时间越短;自由度越高,由于水分子的共振频率比氢质子高得多,导致其弛豫时间延长[26]。从图3可以看出,经复合水凝胶对应的水的特征是在0.01~1 ms(T21)范围内具有最小的流动性;在1~100 ms(T22)范围内出现了一个很小的弱峰,表示水凝胶网络中的水流动性较差;在100~10000 ms(T23)范围内相应的信号强度远低于游离水,说明游离水位于交联网络之外,具有优异的流动性。而较短的初始弛豫时间T2对应于水与基质之间结合更加紧密,水的流动分数更小,水凝胶样品的自由度和迁移率较低,凝胶网络结构致密[27],另外从图3可以发现,经SHMP和TGase修饰后水凝胶样品各峰面积所占比例高于GE,这可能是因为磷酸化过程中引入了负电荷,在GE分子链中引入磷酸基团可以增强磷酸基团与GE中氨基酸的NH3+之间的离子相互作用,导致蛋白质的聚集,进一步限制了水分子的流动。表明GE/SHMP/TGase复合水凝胶包埋体相对于单一的GE基水凝胶,体系对水的结合能力得到了极大的改善,能将水分子牢固地保留在凝胶网络中,进而可以提升凝胶的pH值响应能力,调节植物乳杆菌在模拟胃液中的释放行为[28]。
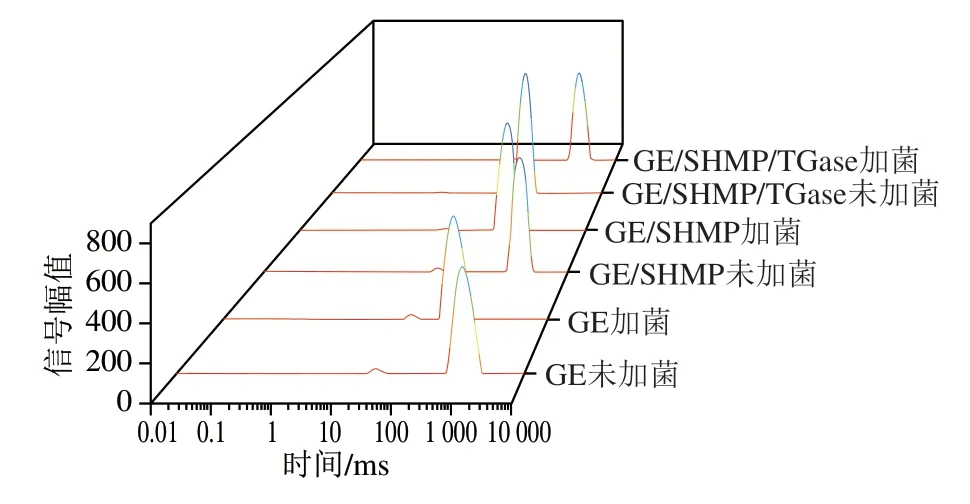
图3 复合水凝胶包埋体水分迁移状况Fig.3 LF-NMR spectra showing water mobility in composite hydrogels
2.4 复合水凝胶包埋体的热稳定性分析
如图4所示,对于GE,Td通常指的是螺旋-螺旋转变温度,Td值主要与GE分子链之间的非共价相互作用和三螺旋样结构的数量有关[29],它代表三螺旋结构中氢键的断裂和无规则螺旋的形成,反映了GE体系中三螺旋状结构的稳定性。由图4B、C可知,GE/SHMP/TGase复合水凝胶的热变性温度高于GE/SHMP高于GE,说明GE经SHMP及TGase修饰后热变性温度提高,这是因为GE三螺旋和最终网络结构的主要能量来源于GE链之间形成的氢键或疏水相互作用,而这种相互作用是非共价结合,形成的稳定性差、对热敏感,而GE/SHMP是通过离子之间的静电相互作用而交联在一起,因此需要更多的热量才能破坏其稳定性,酶交联后蛋白侧链上特定基团交联形成了更大的分子,产生了大量的高能异肽共价键,从而使产物的热稳定性进一步提高[30],表明TGase的存在提高了该复合包埋体系的化学稳定性。此外,对图4中水凝胶包埋体进行分析,发现其热稳定性略低于未加菌的水凝胶,但加菌后的相变温度变化并不明显,说明植物乳杆菌的存在只是轻微的破坏了水凝胶分子间作用力及凝胶网络的有序结构,并不会对包埋体的性能造成很大的影响,从而影响包埋后植物乳杆菌的存活性。

图4 复合水凝胶包埋体的热稳定性Fig.4 Thermal stability analysis of composite hydrogels
2.5 复合凝胶结构特征分析
2.5.1 复合凝胶形成过程中三级结构的变化
内源性荧光光谱可用于表征蛋白质三级结构的变化。蛋白质最大发射波长(λmax)的变化表明氨基酸所处环境极性的变化[31]。从图5可以看出,磷酸化GE的荧光强度高于单一GE,可能是由于磷酸化使GE的芳香基团暴露从而使其三级构象发生改变,蛋白质展开,可以推测磷酸化促使GE的芳香族氨基酸暴露在水中并与蛋白质分子表面的磷酸化基团发生反应。在磷酸化预处理后TGase介导交联,观察到发射波长最大值蓝移(527.01~525.97 nm),表明蛋白质中的氨基酸经过磷酸化预处理后TGase介导交联改变了GE的氨基酸微环境的极性,这与Zou Pengren等[32]的研究报道一致。当植物乳杆菌被添加到凝胶中时,GE分子之间的氢键和静电相互作用减少,从而将疏水基团驱逐到表面,对于单一含有植物乳杆菌的GE,植物乳杆菌的存在导致凝胶的荧光强度降低,并伴有轻微的红移,这表明这些蛋白质将其含色氨酸的延伸区暴露于极性更大的环境(水相),植物乳杆菌产生强烈的空间位阻效应,从而阻断色氨酸残基的荧光信号,并因此导致荧光强度下降[33]。
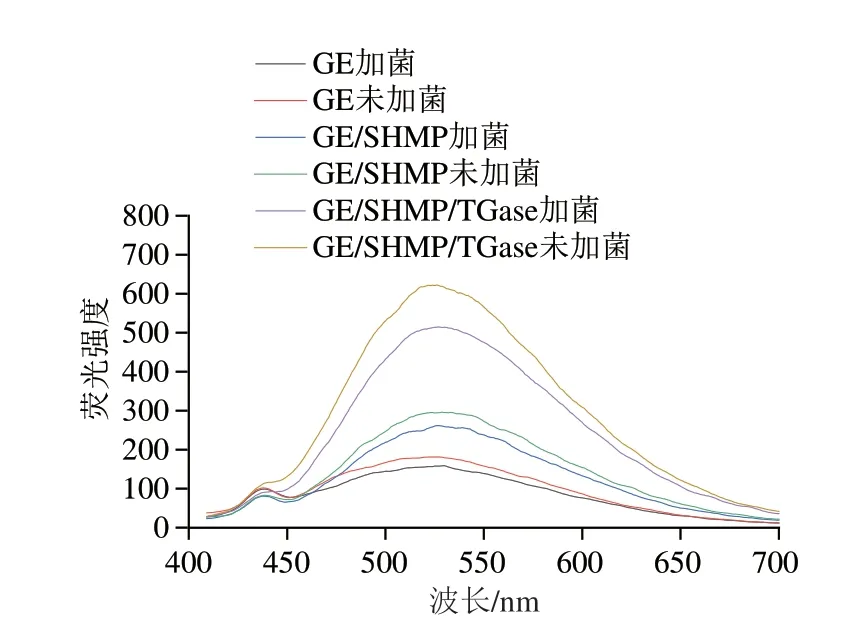
图5 复合凝胶包埋体内源荧光光谱图Fig.5 Intrinsic fluorescence spectra of composite hydrogels
2.5.2 复合凝胶形成过程中二级结构的变化
磷酸化GE的FTIR光谱图如图6所示。通常酰胺A与分子内氢键偶合的—NH伸缩振动有关[34],对于GE酰胺A的吸收峰出现在3420 cm-1附近,GE/SHMP与GE/SHMP/TGase酰胺A的吸收峰分别出现在3408 cm-1和3356 cm-1处,GE/SHMP/TGase有明显的红移,这可能是由于GE中的—COOH、—OH基团和—NH残基之间形成了更多的氢键。在2360 cm-1处发生了明显的变化这是二氧化碳呼吸峰造成。磷酸化GE酰胺I带的变化归因于C=O伸缩振动,该伸缩振动与CCN变形、CN伸缩和NH平面内弯曲模的贡献相偶合,分别在1666 cm-1(GE/SHMP)和1668 cm-1(GE/SHMP/TGase)附近,而GE的酰胺I带约为1646 cm-1,与未磷酸化GE的结果相比磷酸化后发生明显蓝移,这可能是由于引入磷酸基团产生的静电相互作用。Sow等[35]报道静电相互作用可以缩短—NH基团的键长,从而增加波长,GE、GE/SHMP、GE/SHMP/TGase酰胺III带吸收峰分别出现在1241、1254、1244 cm-1处,这是由于氨键的C—N和N—H以及谷氨酸和羟脯氨酸侧链的—CH2的振动和变形的共同作用。Li Canpeng等[36]研究表明蛋白质氨基酸侧链上的—OH和—NH2基团在磷酸化的作用下表现会出更高的活性,通常SHMP在879、1095 cm-1和1274 cm-1分别被指定为P—O—P的对称伸缩、P—O的反对称伸缩和P=O的不对称伸缩[37]。从图6可以看出,GE在1244 cm-1处仅有一个很弱的吸收峰,这表明GE链中引入了磷酸基团,可以推断磷酸化GE中可能形成C—N—P键。在707~1082 cm-1范围内的吸收带对应于C—C和C—O—C骨架的对称伸缩振动,GE在该范围内具有很多较小的弱峰,而GE/SHMP与GE/SHMP/TGase在该处的峰增强,峰位变尖,说明在该处碳链骨架增长,进一步证实了GE/SHMP/TGase水凝胶通过非共价键及共价键结合形成了致密的凝胶网络结构,有利于植物乳杆菌的包埋。
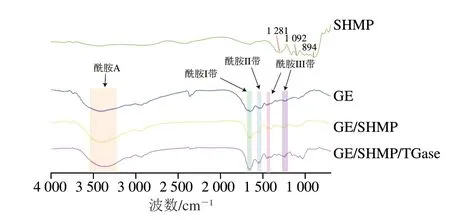
图6 复合凝胶及包埋体FTIR光谱图Fig.6 Infrared spectra of composite hydrogels
2.5.3 复合凝胶微观结构分析
通过SEM可以初步评估结构性质的差异,SEM代表磷酸化预处理对TGase诱导的GE凝胶三维网络微观结构的影响,可以反映相应的凝胶质地和流变特性。如图7所示,所有凝胶样品均呈蜂窝状网络结构,与典型的GE网络结构一致。单一GE凝胶表面粗糙且表现出无序且相对松散的网络微结构,相比之下,磷酸化的GE相比单一的GE具有光滑且非常紧凑的网络结构,这是因为磷酸化促进了GE的有序折叠和展开,促进疏水相互作用和二硫键形成[26]。磷酸基团可能通过参与网络形成而连接到GE分子结构中,这也与磷酸化GE凝胶及凝胶动力学强度一致。添加TGase后水凝胶的微观结构更加有序和稳定,如图7E、F所示,水凝胶中出现层状结构和多孔结构的组合,但GE/SHMP/TGase水凝胶的孔径远小于GE/SHMP的水凝胶,使其更适合益生菌的递送系统。因为磷酸化预处理使GE暴露了对更多对TGase敏感的活性部分,增加了交联度,导致小分子质量聚合物消失,通过蛋白质分子内部和蛋白质分子之间的共价和非共价交联,增加了大分子质量蛋白质聚合物的形成和网络结构含量增大,从而使TGase交联反应过程中形成更均匀、致密的凝胶网络结构。由图7A、C、E可以看出,嵌入益生菌的水凝胶的微观结构与不含益生菌的水凝胶相似,但前者略显不规则。这表明益生菌减弱了分子之间的相互作用,从而阻止了凝胶化过程中有序分子间聚集体的形成,证实了具有植物乳杆菌的水凝胶的流变特性及荧光光谱的结果,加菌后凝胶的G’远低于不加菌,且物乳杆菌产生强烈的空间位阻效应,导致荧光强度下降。此外单一GE凝胶形成过程由于是靠分子之间的氢键或疏水相互作用,分子间作用力较弱,形成的网络结构疏松导致加入植物乳杆菌后,大部分菌体裸露在凝胶表面,经SHMP及TGase修饰后由于致密的网络结构使菌体被牢牢吸附在凝胶网络内部,使其表面裸露的菌体减少,表面光滑[18]。
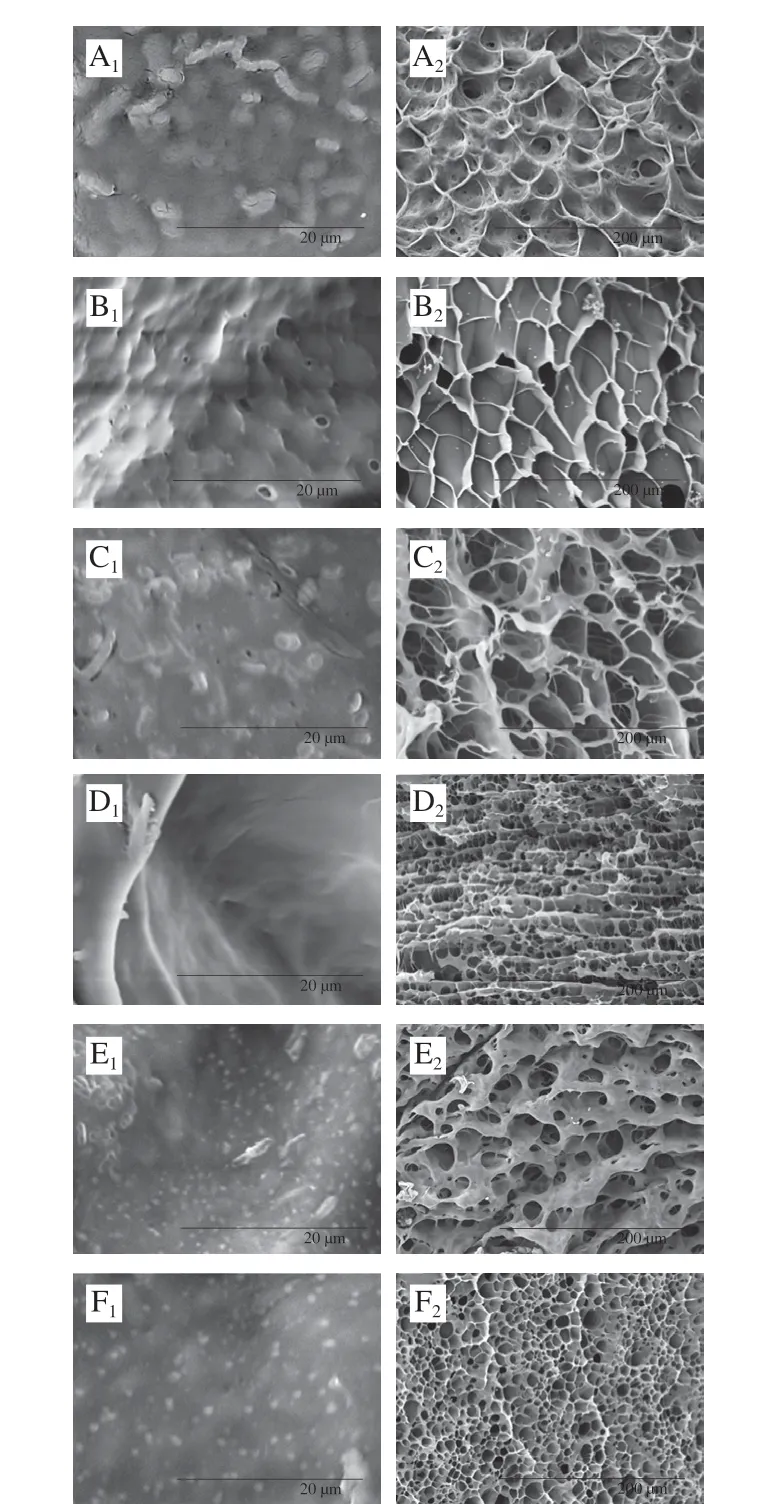
图7 复合凝胶包埋体扫描电子显微镜图Fig.7 Scanning electron microscopic images of composite hydrogels
2.5.4 图解模型
建立关于SHMP与TGase增加GE功能特性的模式图(图8)。蛋白质的天冬氨酸基(β-羧基)、苏氨酸基、丝氨基和酪氨酸残基上的氧与磷酸基团相连,形成了非共价键,引入的磷酸基团可以与水分子形成大量的氢键,促进了凝胶网络的形[38],加入植物乳杆菌后,其通过氢键和疏水相互作用嵌入GE/SHMP复合水凝胶中。由于引入的磷酸基团增加了蛋白质体系的电负性,磷酸化预处理后导致GE的分子结构发生变化,暴露出更多的TGase作用位点。TGase靶向交联谷氨酰胺的γ-COOH和赖氨酸的ε-NH2,形成了共价键。TGase的进一步交联导致小分子质量聚合物消失,通过蛋白质分子内部和蛋白质分子之间的共价和非共价交联,增加了大分子质量蛋白质聚合物的形成和含量。
2.6 植物乳杆菌在模拟胃液肠液中的存活性及释放性分析
包埋的主要目的是保护益生菌免受消化酶和胃肠道恶劣环境条件的影响。在模拟胃肠液消化过程中,益生菌的存活情况如图9所示。在消化开始时,所有类型水凝胶包埋的植物乳杆菌细胞活菌数在9.48~9.59(lg(CFU/mL))。经模拟胃液消化后GE/SHMP/TGase、GE/SHMP、GE水凝胶中植物乳杆菌存活率相对于初始活菌数分别为89.5%、62.3%、57.02%。这些结果表明将植物乳杆菌包裹在GE/SHMP/TGase水凝胶中可以最大限度保护植物乳杆菌活菌数免受胃液中不利条件的影响。GE/SHMP/TGase水凝胶中植物乳杆菌活菌数的提高是因为其致密的网状结构可以抑制胃酶渗透到凝胶网络中。此外,由于其具有较高的凝胶强度,分子间的相互作用力强,从而降低胃酸和胃蛋白酶向水凝胶中的扩散速率。水凝胶经模拟肠液处理2 h后,所有类型的水凝胶中植物乳杆菌活细胞数均减少,但其下降速率显著低于在胃液中的活细胞数,说明大多数植物乳杆菌死亡发生在模拟胃液处理期间,这可能是由于植物乳杆菌对胃酸的耐受性相对较低所致。单一GE凝胶网络结构较差对植物乳杆菌的保护性低,导致其在模拟胃液消化后代谢活性降低,经模拟肠液处理后下降了4 个对数周期,而复合水凝胶基质中在模拟肠液中仅下降了1 个对数周期,这可能是复合水凝胶中的凝胶网络可以通过减缓低酸性环境对植物乳杆菌的代谢活性造成影响,从而对其起到一定的保护作用。
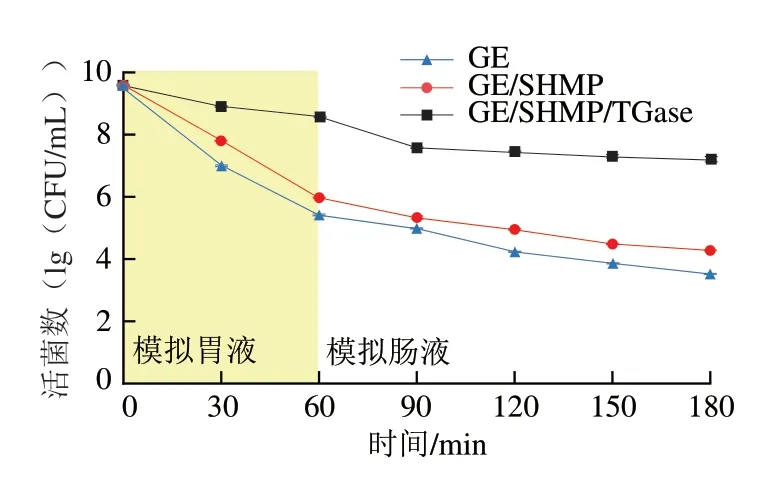
图9 模拟胃肠道消化后的活菌数Fig.9 Survival rate of bacteria after simulated gastrointestinal digestion
如图10所示,不同复合材料的累计释放速率不同,单一GE中植物乳杆菌的释放速率在前30 min内迅速增加,然后在其余时间缓慢增加,之后保持不变,GE/SHMP水凝胶在0~60 min内观察到较低的释放率,在消化60 min后也显示出突然释放,表明凝胶结构的形成能够延缓其在模拟胃液阶段的释放。从图10还可以发现,复合水凝胶的累计释放量为66.2%略高于GE/SHMP(44.6%)和GE(37.0%),在模拟胃液中GE/SHMP/TGase释放速率最慢,而在模拟肠液中的释放速率变快。造成上述差异的原因由很多因素决定,包括活性成分的性质、水凝胶的结构和大小、聚合物的性质以及聚合物基质的相互作用。在控制水凝胶形状和大小一致的情况下,GE/SHMP/TGase复合水凝胶包埋体延长了外壳的溶解时间,进而降低了植物乳杆菌在模拟胃液中的释放率。当pH值从2.0上升到6.8时,由于GE/SHMP/TGase复合水凝胶包埋体是由共价键及非共价键共同作用形成,随着外部溶胀介质pH值的升高,导致其电离程度相对于单一GE和GE/SHMP复合凝胶增加,蛋白质链上的羧酸阴离子增加,水凝胶包埋体随着pH值和离子强度的变化而膨胀,而高度溶胀的水凝胶含有大量未结合的水。在pH 6.8时,在较大的渗透溶胀力下发生了溶胀,在胰酶的高度溶胀和基质侵蚀下导致益生菌在高渗透压下向外扩散,从而逐步释放出更多的植物乳杆菌。这与De Almeida Paula等[39]采用GE和阿拉伯胶通过静电相互作用包埋植物乳杆菌的研究相比,显著提高了益生菌在模拟胃液中的存活性。因此可以得出GE/SHMP/TGase不仅对植物乳杆菌的控释具有协同作用,还有助于增加模拟肠液消化后的累积释放。
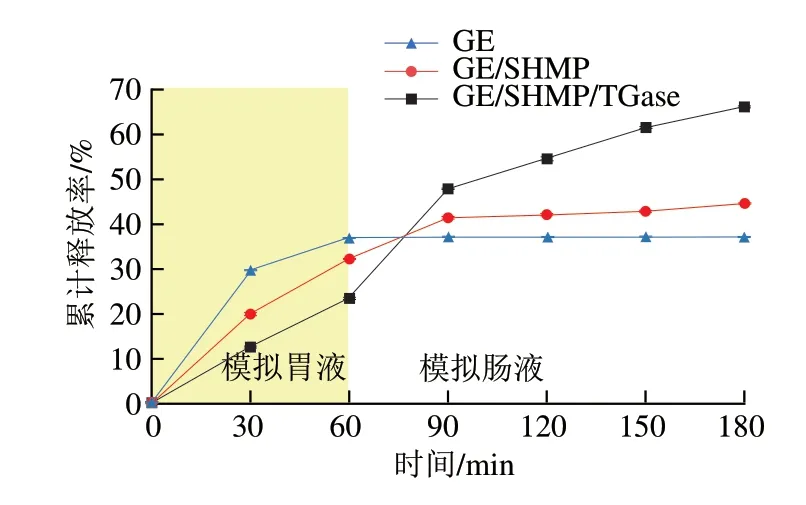
图10 植物乳杆菌体外消化模拟释放曲线Fig.10 Release curves of L.plantarum during in vitro simulated digestion
2.7 复合凝胶包埋体贮藏稳定性分析
水凝胶中的植物乳杆菌在4 ℃定期监测28 d期间其稳定性如图11所示。在贮存期间具GE/SHMP/TGase水凝胶中植物乳杆菌的活菌数没有明显变化,但对于其他水凝胶,植物乳杆菌的存活率趋于降低。这可能是因为GE/SHMP/TGase具有致密的网状结构和厚壁的蜂窝状微观结构而表现出最佳保水能力,有效减少了水凝胶脱水收缩导致的益生菌损失。
3 结论
本研究主要以GE/SHMP/TGase制备复合水凝胶包埋体,以GE、GE/SHMP水凝胶及包埋体作为对照,通过对水凝胶及包埋体的流变特性、凝胶强度、水分迁移状况、热稳定性、微观结构、FTIR光谱及荧光光谱进行测定,研究GE/SHMP/TGase的作用机理及对植物乳杆菌的包埋效果。通过对凝胶体系的流变性能、热稳定性及微观结构进行分析发现GE/SHMP/TGase复合水凝胶的凝胶形成速率较低,酶交联后蛋白侧链特定基团交联形成了更大的分子,产生了大量的高能异肽共价键,导致其热稳定性增加,形成了更加稳定的三维网络结构,有利于植物乳杆菌的长期稳定的存在。低场核磁共振分析表明GE/SHMP/TGase具有更好的保水作用,SHMP和TGase的引入可以改变体系对水的结合能力,促进凝胶形成更加致密的空间网络状结构,进而可以提升壳层凝胶的pH值响应能力,调节包埋物质在SCF中的释放行为。模拟胃肠道消化实验表明,经模拟胃液和模拟肠液消化后,GE/SHMP/TGase水凝胶包埋的植物乳杆菌的存活率显著高于单一GE基水凝胶。贮藏实验结果表明GE/SHMP/TGase水凝胶包埋的植物乳杆菌的储存稳定性(28 d内)较好。进一步证实该复合水凝胶包埋体具有较高的稳定性、流变特性、保水性及凝胶网络结构特性等性能。因此,利用GE/SHMP/TGase复合水凝胶包埋植物乳杆菌,可以有效提升植物乳杆菌的在胃肠道等不利因素下的存活性,为益生菌产品的开发提供有益参考。

