再制干酪拉伸性的调控机制
沈建洋,盛赵越,郭梦圆,郭慧媛,王鹏杰,张 颖,张晓莹,房习习,王逸伦,王彩云,罗 洁,
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.中国农业大学营养与健康研究院,北京 100083;3.内蒙古伊家好奶酪有限责任公司,天津 300308;4.内蒙古伊利实业集团股份有限公司伊利母婴营养研究院,北京 100160;5.内蒙古国家乳业技术创新中心有限责任公司,内蒙古 呼和浩特 010000)
干酪是深加工乳制品,具有营养价值高、品类多样以及便于运输保存等优点[1],2018年,国务院办公厅发布了《关于推进奶业振兴保障乳品质量安全的意见》,明确提出优化乳制品产品结构,支持发展干酪、乳清粉、黄油等干乳制品[2]。2021年,我国的干酪市场规模已增长至122.7亿 元,同比增长33.70%[3-4]。其中,再制干酪在干酪市场的份额占比高达80%以上[2]。
再制干酪是在加热、机械剪切以及乳化等作用下将一种或者多种类型的天然干酪与其他的乳或非乳成分混合而制得的干酪制品[5],被广泛应用于烘焙、烧烤、油炸或者微波等热处理场景之中,因此再制干酪产品在受热时所表现出的功能特性对其品质影响重大。其中,良好的拉伸性可以很好地提升消费者的体验感和满意程度,是再制干酪产品重要的功能特性。然而,目前国内市场上再制干酪的拉伸稳定性较差,调控机制不够清晰。
拉伸性是指熔融干酪在被持续施加拉伸应力时能够形成纤维束并保持其不断裂的能力[6],干酪在高温下表现出的拉伸特性主要取决于酪蛋白分子之间相互作用的强度与数量,包括钙交联作用、静电相互作用、氢键和疏水作用等[7-8]。由于再制干酪在制作时需经历二次熔融乳化等工艺,使天然干酪中的酪蛋白分子解构重排,干酪的凝胶结构也相应变化,从而影响再制干酪的功能特性。此外,不同于天然干酪的简单构成,国内的再制干酪产品除了天然干酪和乳化盐之外,通常还会加入其他乳蛋白、各类食物来源的油脂以及多糖类的稳定剂等成分,使再制干酪体系构成复杂。因此,国际上关于再制干酪的生产经验和研究基础并不适用于我国产品,亟需针对我国再制干酪体系开展相关研究。
文献报道及前期研究发现,乳化盐、再制干酪pH值及变性淀粉添加量是影响再制干酪拉伸性的关键因素[9-10]。不同添加量乳化盐制得的再制干酪的拉伸性差异显著[11]。在pH 5.4~5.8范围内,pH值越低,干酪的拉伸性越差[12-13]。此外,变性淀粉因其良好的加工适用性被广泛用于再制干酪的加工[14],Mehfooz等[15]研究发现添加羟丙基大麦淀粉制得的再制干酪与不加淀粉的对照组相比,再制干酪的拉伸性得到了显著提升,然而上述这些因素调控再制干酪拉伸性的机理尚未明确。
本研究通过调控再制干酪体系乳化盐添加量(0.6%~3.0%)、pH值(5.4~5.8)和马铃薯醋酸酯淀粉添加量(0.125%~2%),研究再制干酪拉伸性的调控机制,旨在为改善再制干酪产品的拉伸性及调控品质提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
马苏里拉干酪(蛋白25.3%、脂肪22.6%,pH 5.3)、切达干酪(蛋白24.2%、脂肪34.7%,pH 5.3)、黄油(脂肪82.9%)、凝乳酶酪蛋白(蛋白82%)恒天然商贸有限公司;商用乳化盐JOHA C Neu(六偏磷酸钠,焦磷酸钠)以色列化工集团;马铃薯醋酸酯淀粉宜瑞安食品配料有限公司;乙二胺四乙酸、聚氧乙烯山梨糖醇单月桂酸酯(吐温-20)上海源叶生物科技有限公司;尼罗红、固绿(Fast Green FCF)、卢戈氏碘液美国Sigma-Aldrich公司;无水乙醇、氢氧化钾、盐酸、硝酸、高氯酸(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
UM/SK5融化锅 德国Stephan公司;Testo-205手持pH计 德国Testo集团;M1-L213微波炉 美的集团;TMS-Pro食品物性分析仪 美国FTC公司;Master sizer 3000激光粒度仪 英国Malvern仪器有限公司;INVENIO傅里叶变换红外光谱仪 德国Bruker公司;VTMR20-010V-1低场核磁共振成像分析仪 苏州纽迈分析仪器股份有限公司;ICP-OSE730等离子体光谱仪美国Agilent科技公司;LSM 900激光共聚焦扫描显微镜德国蔡司公司。
1.3 方法
1.3.1 再制干酪样品的制备
再制干酪的制备工艺流程图如图1所示。

图1 再制干酪制备工艺流程图Fig.1 Flow diagram for the preparation of processed cheese
再制干酪制备的具体操作步骤:1)首先将粉料(凝乳酶酪蛋白和淀粉)和水加入到熔融锅中,升温至45 ℃左右后,设置刮刀转速150 r/min运行3 min,使粉料进行充分水合;2)水合完成之后,将切分成小块的天然干酪和黄油以及乳化盐和柠檬酸依次加入到熔化锅中,同时升温至75 ℃左右后,设置刮刀转速150 r/min运行8 min,使物料熔融;3)待物料基本熔融之后,设置轴刀转速为300 r/min运行5 min,使物料充分搅拌乳化,期间保持温度在75 ℃左右;4)开锅检查干酪是否形成光滑均匀的流体状态,将状态良好的干酪灌装密封并置于冷水中进行冷却降温处理;5)待样品降温至室温左右转移至4 ℃冰箱进行冷藏保存。
1.3.2 样品制备
1.3.2.1 不同乳化盐添加量再制干酪样品的制备
固定天然干酪添加量30%(马苏里拉与切达干酪质量比为1∶4)、凝乳酶酪蛋白添加量13.4%、黄油添加量11.5%、马铃薯醋酸酯淀粉添加量0.25%,利用柠檬酸调节干酪pH值为5.6,分别制备乳化盐添加量为0.6%、1.2%、1.8%、2.4%和3.0%的再制干酪样品。
1.3.2.2 不同pH值再制干酪样品的制备
固定天然干酪添加量30%(马苏里拉干酪与切达干酪质量比为1∶4)、凝乳酶酪蛋白添加量13.4%、黄油添加量11.5%、乳化盐添加量1.4%、马铃薯醋酸酯淀粉添加量0.25%,利用柠檬酸调节干酪pH值,分别制备pH值为5.4、5.5、5.6、5.7和5.8的再制干酪样品。
1.3.2.3 不同变性淀粉添加量再制干酪样品的制备
固定天然干酪添加量30%(马苏里拉与切达干酪质量比为1∶4)、凝乳酶酪蛋白添加量13.4%、黄油添加量11.5%、乳化盐添加量1.4%,利用柠檬酸调节干酪pH值为5.6,分别制备马铃薯醋酸酯淀粉添加量为0.125%、0.25%、0.5%、1%和2%的再制干酪样品。
1.3.3 指标测定
1.3.3.1 拉伸性
参照Fife等[16]测定干酪拉伸性的方法,首先称取40 g的干酪样品放入100 mL烧杯中,然后将放有样品的烧杯置于微波炉中采用中火功率加热60 s,干酪加热熔化后,采用食品物性仪搭配特制的三叉钩探头按照预设的拉伸性测定程序对熔融的干酪样品进行拉伸性测试,测试时以熔融干酪向上拉伸直至断裂时的高度(拉伸长度)评价干酪的拉伸性。拉伸性测定具体参数设置为:测试前探头下降速率100 mm/min,接触到杯底的感应力2 N,探头向上拉伸速率300 mm/min,探头向上总高度270 mm。
1.3.3.2 钙离子分布
采用等离子光谱仪测定并计算干酪样品中游离钙和结合钙的含量从而确定干酪样品中的钙分布状况。
干酪总钙含量的测定:首先对干酪样品进行消解处理,样品消解的方法参考GB 5009.268—2016《食品中多元素的测定》中的湿式消解法,样品消解完成后加纯水定容至50 mL,使用等离子光谱仪对稀释液进行钙离子含量检测,具体的参数设置为:发射功率为1.0 kW,载气为氩气,等离子气体流量15 L/min,辅助气流量1.5 L/min,雾化器流量0.75 L/min,检测模式为轴向观测。
干酪中可溶钙含量的测定:首先称取2.0 g左右的干酪样品切碎置于50 mL离心管中,用超纯水定容至40 mL,使用机械搅拌器以12000 r/min均质3 min,待干酪样品全部溶解后以4200×g离心20 min,采用定量滤纸对上清液进行过滤,然后用0.45 μm滤器再次过滤。过滤完的液体样品同干酪总钙含量测定步骤进行消解处理,最后测定可溶含量。
干酪中结合钙含量测定:结合钙含量=总钙含量-可溶钙含量。
1.3.3.3 脂肪球粒径
参照Trivedi等[17]测定干酪中脂肪球粒径的方法,首先称取0.5 g左右的干酪样品与50 mL溶液A混合,于4 ℃环境中放置过夜后,采用激光粒度仪测定干酪中脂肪球粒径,脂肪球粒径测定结果以D(4,3)和D(3,2)表示。溶液A的配制方法是将3.94 g乙二胺四乙酸与800 mL超纯水混合,然后加入1.27 g吐温-20,使用0.1 mol/L氢氧化钠溶液将所配溶液pH值调节至10,最后用超纯水将溶液定容至1000 mL。
1.3.3.4 傅里叶变换红外光谱
参照Pax等[18]的方法测定干酪的傅里叶红外吸收光谱。首先在室温条件对仪器进行水汽校正和背景扫描,然后将干酪样品放在傅里叶变换红外光谱仪的金刚石物镜上,收集700~4000 cm-1之间的红外吸收光谱,设置分辨率为4 cm-1,样品扫描次数为16,对羰基、酰胺和羟基官能团进行分析以确定蛋白质分子间键的变化。
1.3.3.5 水分分布
采用低场核磁共振技术测定干酪样品的自旋-自旋弛豫时间(T2)从而计算干酪样品中不同状态的水分含量。测试时,先称取3.0 g左右的干酪样品,将干酪样品用保鲜膜进行均匀包裹,之后将待测样品放入检测管之中进行GPMG序列测定。序列的具体参数设置为:采样频率为200 kHz,主频为20 MHz,等待时间为1200 ms,累加次数为8,回波时间为0.1 ms,总回波个数为8000。测试结束后利用反演软件调用CPMG序列进行反演得到各样品的T2分布图谱。
1.3.3.6 微观结构
采用共聚焦激光扫描显微镜对干酪样品进行微观结构观察,首先将干酪样品切分为0.1 mm左右厚的薄片并置于玻璃显微镜载玻片上,依次用卢戈氏碘液、0.2%的固绿染液和0.2%的尼罗红染液对干酪样品中的淀粉、蛋白和脂肪进行染色。染色结束后盖上盖玻片并转移至共聚焦激光扫描显微镜的载物台上,选取合适的通道和放大倍数进行视野观察。其中染色蛋白和脂肪在荧光通道下观察,固绿和尼罗红染料分别使用640 nm和488 nm的激光通道进行荧光激发[19],染色淀粉在明场通道下进行观察。
1.4 数据处理
采用Microsoft Excel和SPSS统计软件进行统计分析,实验数据均采用表示(n=3)。采用单因素方差分析和Tukey’s test统计均值和显著性分析。P<0.05为组间差异具有统计学意义。
2 结果与分析
2.1 再制干酪拉伸性
乳化盐在再制干酪中的添加量一般不超过3%[20],不同乳化盐添加量对再制干酪拉伸性的影响如图2A所示,可以发现随着乳化盐添加量的逐渐增加,再制干酪的拉伸性先升高后降低,其中添加量1.2%时,干酪的拉伸性达到最佳,而继续升高乳化盐添加量,干酪的拉伸性显著降低。

图2 乳化盐添加量(A)、pH值(B)和马铃薯醋酸酯淀粉添加量(C)对再制干酪拉伸性的影响Fig.2 Effects of different levels of emulsifying salt (A),pH (B) and potato acetate starch (C) on the stretchability of processed cheese
不同pH值可以改变干酪凝胶中酪蛋白分子的带电量,如图2B所示,随着pH值的逐渐升高,再制干酪的拉伸性同样呈先升高后降低的趋势,其中在pH 5.7时,干酪的拉伸性最好,而当再制干酪pH值较低时,拉伸性普遍较差。
淀粉高温糊化冷却之后可以形成凝胶,因此当再制干酪体系中加入淀粉之后,淀粉便可以和酪蛋白形成复合凝胶体系,如图2C所示,马铃薯醋酸酯淀粉添加量逐渐增加,干酪的拉伸性逐渐提升,但当淀粉添加量从1%增加至2%时,干酪的拉伸性开始下降。
2.2 再制干酪钙离子分布
再制干酪中的钙主要以结合钙和可溶性钙2 种形式存在,凝乳酶酪蛋白中大部分的酪蛋白分子通过胶态结合钙相互连接,结合钙所提供的钙交联作用是干酪能够被拉伸的主要作用之一。乳化盐可以螯合完整酪蛋白中的胶束结合钙并将其转化为游离的可溶钙,同时也恢复了一部分酪蛋白分子的乳化性[21],具有乳化性的酪蛋白分子可以将再制干酪体系中的蛋白和脂肪重新整合为一体,这是生产再制干酪的基本原理。
由图3A可知,随着乳化盐添加量逐渐增加,干酪中的可溶钙含量逐渐增加,当乳化盐添加量从1.2%增加至1.8%时,干酪中的可溶钙含量超过了游离钙含量,此时对应的拉伸性发生了显著降低,表明较高的乳化盐添加量会降低再制干酪中的结合钙,钙交联作用随之降低,不利于干酪的拉伸。乳化盐添加量为0.6%时干酪中的结合钙含量最高,但是钙交联作用过强也不利于干酪的拉伸,可能是因为当酪蛋白分子间的相互作用太强时,拉伸过程中干酪中产生的内应力就很难释放,此时纤维结构更容易断裂而不是拉伸[22]。

图3 乳化盐添加量(A)和pH值(B)对再制干酪钙分布的影响Fig.3 Effects of different levels of emulsifying salt (A) and pH (B) on the calcium content of processed cheese
pH值也会影响干酪中的钙分布状态,当pH值较低时,干酪中的结合钙便会因为体系内更多的H+而转变为可溶钙[23]。从图3B可以发现,随着pH值逐渐升高,干酪中的结合钙含量逐渐增加,当pH值增加至5.7时,干酪中的结合钙含量超过了可溶钙含量,对应的拉伸性显著增加,同样印证了结合钙含量对再制干酪拉伸的重要性。
2.3 再制干酪脂肪球粒径分布
再制干酪凝胶中的脂肪在高温作用下由固态转变为液态,液化的脂肪可以作为一种低黏度的润滑剂帮助酪蛋白网络在受力方向发生相对位移,从而促进干酪的拉伸[12]。
不同乳化盐添加量制得再制干酪凝胶中的脂肪球粒径如表1所示,随着乳化盐添加量的逐渐增加,脂肪球粒径逐渐降低,这可能是由于乳化效果增加导致;而小体积脂滴所提供的润滑作用也会随之降低,拉伸过程中不利于相邻酪蛋白分子的移动,对干酪的拉伸性产生不利的影响[24-25]。

表1 乳化盐添加量对再制干酪脂肪球粒径的影响Table 1 Effects of different amounts of added emulsifying salt on particle size of fat globules in processed cheese
pH值也会影响再制干酪的乳化效果进而影响干酪凝胶中的脂肪球粒径,由表2可知,脂肪球粒径随pH值升高而呈现降低的趋势,这是因为随着pH值升高,乳化盐的离子交换效率提高[26],乳化效果增强,脂肪球粒径因此不断降低,而脂肪球粒径的持续降低会对再制干酪的拉伸性产生不利影响。
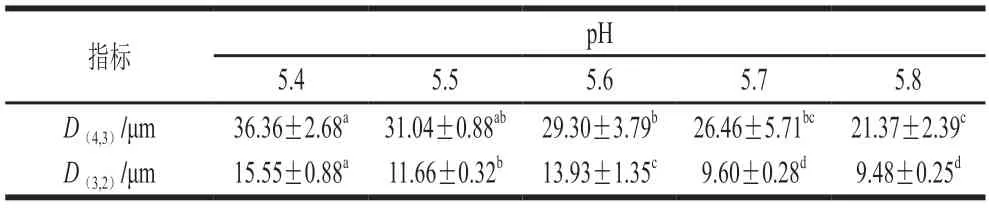
表2 pH值对再制干酪脂肪球粒径的影响Table 2 Effect of pH on particle size of fat globules in processed cheese
同样,淀粉的加入也提升再制干酪的乳化效果,这与Fu Wei等[27]研究结果一致,由表3可知,随着马铃薯醋酸酯淀粉不断增加,脂肪球粒径不断降低,而马铃薯醋酸酯淀粉添加量到2%时拉伸性降低,可能与较低的脂肪球粒径有关。
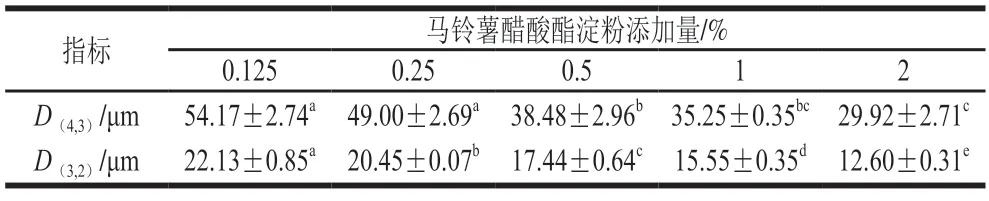
表3 马铃薯醋酸酯淀粉添加量对再制干酪脂肪球粒径的影响Table 3 Effect of different amounts of added potato acetate starch on particle size of fat globules in processed cheese
综上,脂肪球粒径随着乳化盐、pH值和马铃薯醋酸酯淀粉的增加均呈现出降低的趋势,表明干酪凝胶中的脂肪球粒径分布得更加分散,其所提供的润滑效果也会减小,最终不利于干酪的拉伸。
2.4 再制干酪傅里叶变换红外光谱
不同的pH值会改变再制干酪中蛋白分子的带电量,蛋白的二级结构也会因为静电作用的改变而发生变化,最终产生不同的干酪凝胶结构[28]。如图4所示,其中1430 cm-1处出现了O—H弯曲振动的特征吸收峰,1540 cm-1处左右出现了N—H弯曲振动的特征吸收峰;当pH值为5.4和5.5时的O—H弯曲振动在1440 cm-1处有较弱的吸收,而当pH值升高至5.6及以上时,吸收峰向右移动至1437 cm-1处,且吸收峰较明显。同样地,1540 cm-1处的N—H弯曲振动吸收峰随着pH值升高也出现了向低波数方向移动的趋势,其中pH 5.4时在1547 cm-1处有吸收峰,pH 5.5时吸收峰右移至1543 cm-1处,当pH值继续升高至5.6及以上后,吸收峰继续移动至1541 cm-1处,这与Talbot-Walsh等[29]研究结果一致。O—H弯曲振动吸收峰和N—H弯曲振动吸收峰的右移表明蛋白带电量随pH值升高而增加,形成了更多的氢键,这可以在一定程度上表明pH值升高提高了蛋白的水合能力,而当蛋白水合作用较高时,就会削弱蛋白分子间的相互作用,使拉伸性也会因此降低。

图4 不同pH值制得再制干酪的傅里叶变换红外光谱Fig.4 FTIR spectra of processed cheese prepared at different pH
2.5 再制干酪水分分布
根据水分与干酪中的固体成分(主要指蛋白质)之间的空间关系,水分可分为结合水和自由水,而根据自由水在干酪凝胶结构中的流动性又可以将其进一步划分为截留水和游离水,其中截留水被束缚在蛋白质基质中,无法通过离心获得,而游离水流动性最强,与蛋白结合最弱,可通过离心的方式获得[30]。
由表4可知,随着乳化盐添加量的增加,干酪中的结合水含量逐渐增加,而游离水含量逐渐降低,这是因为随着钙胶束的溶解,亲水性的磷酸丝氨酸基团暴露,蛋白的水合能力增加,越来越多的游离水被蛋白吸附并紧密结合,使蛋白之间的相互作用变弱,干酪的拉伸性因此降低。

表4 乳化盐添加量对再制干酪水分分布的影响Table 4 Effect of emulsifying salt addition on moisture distribution of processed cheese
由表5可知,随着pH值的逐渐升高,再制干酪在pH 5.4~5.7时,结合水含量无显著差异,而当pH值继续升高到5.8时,结合水含量显著高于其他组别,pH 5.8时酪蛋白分子可能受到增加的乳化效果和静电斥力作用的综合影响,蛋白的持水能力显著提高,而结合水含量过高可能会降低蛋白之间的相互作用,从而使干酪拉伸性降低。
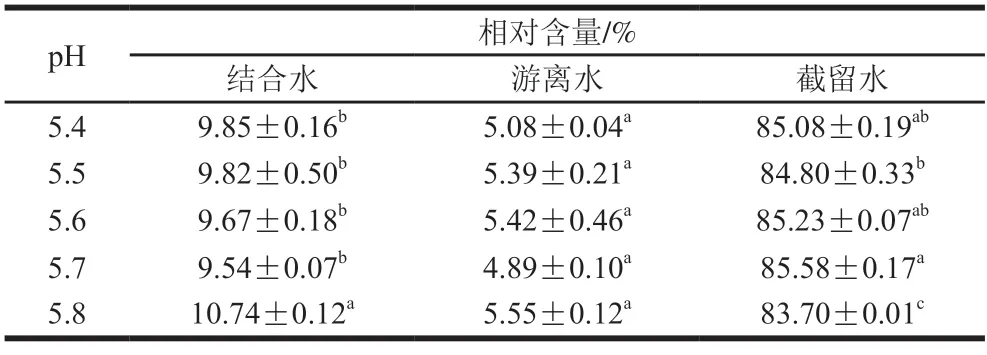
表5 pH值对再制干酪水分分布的影响Table 5 Effect of pH on moisture distribution of processed cheese
由表6可知,随着马铃薯醋酸酯淀粉的不断增加,干酪中的结合水含量有所提高,淀粉持续的加入提高了干酪凝胶的持水能力[14],其中添加量在0.125%~1%时,干酪中的结合水含量未发生显著变化,但是当淀粉添加量为2%时,结合水含量显著增加,干酪的拉伸性可能因为水合作用的增加而降低。

表6 马铃薯醋酸酯淀粉添加量对再制干酪水分分布的影响Table 6 Effect of potato acetate starch addition on moisture distribution of processed cheese
综上,随着乳化盐、pH值和马铃薯醋酸酯淀粉的增加,再制干酪凝胶中的持水能力均得以提升,结合水含量的增加使蛋白分子间的相互作用不断减弱,再制干酪的拉伸性因此而降低。
2.6 再制干酪凝胶结构
如图5所示,随着乳化盐添加量的增加,脂滴的分布也变得更加分散且均匀,脂肪粒径变小,这与干酪脂肪粒径测定的结果一致。当乳化盐添加量为1.2%时,适量的胶体磷酸钙被螯合,较低的乳化效果使得凝结结构中存在较大的脂滴,它可以在干酪加热时熔化从而提供润滑作用,因此表现出良好的拉伸性。

图5 不同乳化盐添加量制得再制干酪的微观结构Fig.5 Microstructure of processed cheese with different amounts of added emulsifying salt
由图6可知,不同pH值对再制干酪的凝胶结构也产生了明显影响,当pH 5.4左右时,由于接近酪蛋白的等电点,再制干酪的蛋白网络结构会因为静电作用的减弱而紧密聚集,随着pH值的逐渐升高,蛋白水合程度增加,蛋白的网络结构变得逐渐舒展[28,31],脂滴的分布也变得更加分散而均匀,这与脂肪粒径测定的结果一致。微观结构结果显示,不同pH值条件并没有改变淀粉的分布状态,淀粉在凝胶结构中始终以分散的颗粒状存在。有文献报道通过调节pH值可以改变淀粉在干酪凝胶结构中的分布状态[29],在pH 5.4左右时淀粉会形成连续的凝胶结构,与蛋白发生相分离,本研究没有观察到这种现象,可能是与实验中的淀粉添加量较低有关。

图6 不同pH值制得再制干酪的微观结构Fig.6 Microstructure of processed cheese prepared at different pH
淀粉等多糖类成分会与蛋白形成复合乳液凝胶,而两种聚合物间相互作用、聚合物浓度、胶凝机制的变化都产生不同的相行为和凝胶结构[32],由图7可知,随着淀粉添加量的逐渐增加,淀粉在凝胶结构中的分布状态发生了改变,在淀粉添加量在0.125%~1%时,淀粉均以分散形式填充在蛋白网络内,而当淀粉添加量增加至2%时,淀粉与蛋白因为热力学不相容而发生了相分离,淀粉以聚集的凝胶形式存在。此外,实验还测定了0.1%的马铃薯醋酸酯淀粉溶液在pH 5.6左右时的Zeta电势,结果表明淀粉带微量的负电荷,与相同pH值条件下带负电荷的酪蛋白结合作用较弱,因此推测淀粉对再制干酪拉伸性的改善主要是通过以惰性填料的形式分散在蛋白网络中,同时通过静电斥力的作用使蛋白网络结构变得舒展从而促进其拉伸性,而当淀粉添加量进一步增加时,淀粉会因热力学不相容形成聚集的凝胶并进一步提升凝胶的持水能力,对蛋白的网络结构造成一定的破坏从而不利于其拉伸。

图7 不同马铃薯醋酸酯淀粉添加量制得再制干酪的微观结构Fig.7 Microstructure of processed cheese with different amounts of added potato acetate starch
综上,乳化盐添加量、pH值和马铃薯醋酸酯淀粉添加量的改变均会影响干酪凝胶中蛋白质、脂肪和淀粉的分布进而对其拉伸性产生影响。当蛋白分子间相互作用较强时,酪蛋白网络紧密聚集,当蛋白分子间相互作用较弱时,酪蛋白网络疏松膨胀,此时都不利于拉伸;干酪凝胶中的脂肪粒径分布会随着乳化效果的增加而变得小且分散均匀,此时也会对拉伸性产生不利的影响;淀粉添加量的持续增加最终会改变复合凝胶的相行为,当与蛋白相发生相分离时,再制干酪的拉伸性会因为酪蛋白网络的破坏而变差。
3 结论
从乳化效果、钙螯合程度、蛋白分子间静电相互作用、水分分布以及蛋白-多糖相互作用多方面分别探究乳化盐、pH值和马铃薯醋酸酯淀粉对再制干酪拉伸性的具体调控机制,结果表明,干酪凝胶中酪蛋白网络是干酪拉伸的基础,其中酪蛋白分子间的钙交联作用、蛋白分子间静电相互作用以及水合作用均显著影响干酪的拉伸性。脂肪作为填充材料支撑酪蛋白网络,脂肪的乳化状态会通过影响复合凝胶的结构而影响干酪的拉伸性。淀粉可以与蛋白形成复合凝胶,不同添加量的淀粉通过影响复合凝胶体系的相行为而影响干酪的拉伸性,再制干酪的拉伸性会受到钙离子螯合程度、乳化效果、蛋白分子间静电相互作用、水分分布状态以及蛋白-多糖相行为等多方面的综合调控。研究明确了再制干酪产品拉伸性的调控机制,为改善再制干酪拉伸稳定性提供理论基础。

