枯草芽孢杆菌发酵紫菜制备一种α-葡萄糖苷酶抑制剂
许育衔,程慧敏,韩贵新,毛相朝,姜宏*
1(中国海洋大学 食品科学与工程学院,山东 青岛,266003)2(晶叶(青岛)生物科技有限公司,山东 青岛,266109)
糖尿病是一种由饮食及生活习惯所引起的以高血糖为特征的疾病,在过去十年间,我国的糖尿病人口快速上升,宋莹倩等[1]在2021年的调查中发现成年样本中具有高血糖症状的比例高达22.09%,若发展为糖尿病及其并发症,将对我国公共健康带来极为重大的医疗负担。
目前治疗糖尿病药物如噻唑烷二酮类、二甲双胍类等药物等虽然能有效干预血糖水平,但是长期服用容易增加肝肾负担,并且会提高病人患心血管疾病的几率[2-3]。因此,亟需一种副作用低且能够有效控制血糖水平的方法。KOJIMA等[4]研究表明,在餐前服用α-葡萄糖苷酶(α-glucosidase,GTase)等多糖降解酶的抑制剂是控制血糖水平的有效策略。这些抑制剂通过占据消化酶的催化位点,延缓大分子碳水化合物的降解速率,以减少糖分摄入,从而达到从源头控制血糖水平的效果,与噻唑烷二酮等降糖药物相比,这种代谢酶抑制剂的副作用相对较低[3]。
紫菜为红藻门、原红藻纲、红毛菜目、红毛菜科、紫菜属(Porphyra)的海洋藻类,含有丰富的营养成分,如糖类、氨基酸、维生素及微量元素等,是一种高营养价值的食品原料[5]。许多研究表明,紫菜可作为多糖降解酶抑制剂的来源。ZENG等[6]通过化学法制备的紫菜多糖具有α-淀粉酶抑制活性;周锋[7]以蛋白酶酶解法制备获得了GTase抑制肽;董玉婷等[8]以植物乳杆菌(Lactobacillusplantarum)发酵紫菜提高了上清液对GTase的抑制活性。但是,由于生产成本、产物得率等因素,紫菜相关产业的加工利用仍处于初级阶段,产品经济效益较低且高度仰赖国外市场。因此,紫菜的精深加工是市场亟待解决的问题。
发酵被广泛用于多种功能食品的工业化生产中[9]。与酶解法相比,发酵的成本相对较低,其简单经济的特性适合用来生产大量具有一定功效的食品[10]。如枯草芽孢杆菌(Bacillussubtilis)被广泛应用于功能食品的工业化生产,其发酵代谢物中含有多种对人体有益的活性成分[11-12]。但目前使用枯草芽孢杆菌发酵紫菜制备GTase抑制剂仍未见相关报道。因此,本实验以枯草芽孢杆菌作为发酵菌株,优化条斑紫菜的发酵工艺,探究紫菜发酵产物的有效成分及对GTase的作用机制,以期为工业化生产具有GTase 抑制性的紫菜功能食品提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
实验使用菌株分离自威海市靖海湾的紫菜养殖网,经鉴定为枯草芽孢杆菌(Bacillussubtilis),由中国海洋大学海洋食品生物技术实验室保存。
1.1.2 材料与试剂
头水紫菜(Porphyrayezoensis),威海市科蓝海洋科技有限公司;GTase、葡聚糖凝胶G-15,北京索莱宝科技有限公司;对硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside,pNPG,BR,99%)、阿卡波糖(BR,95%),上海源叶生物科技有限公司;其余试剂均为国产分析纯。所有实验用水均为超纯水。
1.2 仪器与设备
5425R高速离心机,德国艾本德股份公司;BCM-1000超净台,苏州净化设备有限公司;WD-9405B水平摇床,北京市六一仪器厂;PHS-3C精密酸度计,上海仪电科学仪器股份有限公司;HH-3A水浴锅,常州智博瑞仪器制造有限公司;MULTISKAN FC酶标仪,赛默飞世尔科技公司;HVE-50立式高压蒸汽灭菌锅,上海申安医疗器械厂;全自动紫外分析仪和自动收样器,上海沪西仪器厂;Smart1002-DI超纯水机,青岛莱伯瑞科技有限公司;Kjeltec 2300凯氏定氮仪,福斯分析仪器有限公司。
1.3 实验方法
1.3.1 紫菜发酵液的制备流程
将条斑紫菜粉碎至178 μm(80目)以下粉末烘干备用。称取适量紫菜粉末于锥形瓶中,按一定比例添加纯水,115 ℃灭菌30 min,冷却后将一定量的枯草芽孢杆菌悬浮液接种到发酵基底中,搅拌均匀后置于37 ℃培养箱中发酵一定时间,经离心取上清液即得。
1.3.2 单因素试验
分别考察发酵温度、发酵时间、料液比(紫菜与发酵液质量比)、接种量对GTase抑制率的影响,实验设计如下。
阴性对照:将种子液预先灭菌后进行接种,于30 ℃静置48 h。
发酵温度:分别设定为20、30、40、50 ℃,固定料液比为200 g/kg,接种量为5%(体积分数),发酵时间48 h。并在30 ℃组设置阴性对照,将种子液预先灭菌后进行接种。
发酵时间:分别设定为24、48、72、96、120、144、168 h,固定料液比为200 g/kg,接种量为5%(体积分数),发酵温度为30 ℃。
料液比:分别设定为200、150、100、50 g/kg,固定发酵温度为30 ℃,发酵时间为96 h,接种量为5%(体积分数)。
接种量:分别设定为0.1%(体积分数)、0.3%、0.5%、1%、3%、5%,固定料液比为150 g/kg,发酵时间为96 h,发酵温度30 ℃。
1.3.3 正交试验
根据单因素试验结果,确定发酵温度、发酵时间和料液比3个因素的水平,设置三因素四水平正交试验,以GTase抑制率为指标,获得最佳发酵条件。实验因素及水平见表1。
1.3.4 IC50值的测定
将发酵液干粉(PFPOB)以PBS(pH 7.2)稀释至终质量浓度分别为1、0.6、0.5、0.4、0.3、0.24、0.18、0.12、0.05 mg/mL。依据1.3.9方法对抑制率进行测量。分别以PFPOB质量浓度为横坐标和GTase抑制率为纵坐标绘制标准曲线,测定IC50值。
1.3.5 PFPOB抑制动力学分析
参考董玉婷等[8]的方法略作修改,配制10 mmol/LpNPG,并分别稀释为2、4、6、8 mmol/L等不同底物浓度,加入孵育好的GTase(262.5 U/mL)与PFPOB(0.25 mg/mL),测定反应初速度。Lineweaver-Burk做双倒数曲线,对抑制类型进行分析。
1.3.6 PFPOB成分的分离纯化
参考白露[13]的方法稍作修改,将PFPOB使用超纯水复溶,使用离心过滤装置Amicon®Ultra-15获得分子质量<3 kDa的组分后迅速冷冻干燥,将冻干后样品配制成质量浓度为75 mg/mL的溶液[14],经0.22 μm滤膜除去杂质后备用。将溶胀好的Sephadex G-15介质填充至750 mm×14 mm的层析柱,用去离子水进行平衡。样品进样量为3 mL,洗脱剂为超纯水,洗脱流速0.45 mL/min,检测波长220 nm。
1.3.7 肽鉴定
1.3.7.1 样品处理
取抑制峰样品,冷冻干燥后进行LC-MS/MS鉴定分析。
1.3.7.2 LC-MS/MS条件
参考ZHAO等[15]的方法稍作修改,使用纳升流速Easy nLC 1200色谱系统(Thermo Scientific)从样品中提取1~2 μg肽并分离。缓冲液:溶液A为0.1%(体积分数)甲酸水溶液,溶液B为0.1%甲酸、乙腈和水溶液(其中80%为乙腈)的混合物。用100%溶液A平衡色谱柱。将样品注入Trap Colum(100 μm×20 mm,5 μm,C18,Dr.Maisch GmbH),然后通过色谱柱(75 μm×150 mm,3 μm,C18,Dr.Maisch GmbH),流速为300 nl/min;梯度洗脱:0~2 min:2%~5% B相;2~44 min:5%~28% B相;44~51 min,28%~40% B相;51~53 min,40%~100% B相;53~60 min,100% B相。
质谱条件:一级,分辨率 60 000,自动增益控制目标值 3e6,最大离子传输时间 50 ms,扫描范围350~1 800m/z;二级,分辨率 15 000,自动增益控制目标值 1e5,最大离子传输时间 50 ms,最高信号离子数量 20,NCE/steppedNCE 28。
1.3.7.3 氨基酸序列分析
分析软件为Max Quant 1.6.17.;蛋白质数据库为uniprot-Neopyropia yezoensis (Susabi-nori) (Pyropiayezoensis) [2788]-764-20220530,网址https://www.uniprot.org/uniprot/?query=taxonomy:2788。
参数设定如下:酶:Unspecific;可变修饰:oxidation (M), Acetyl (Protein N-term);遗漏酶切位点:0;一级质谱误差:20×10-6;二级质谱误差:20×10-6;显著性阈值:0.01。
1.3.8 虚拟筛选与分子对接
参考ZHAO等[15]的方法进行操作,首先使用Chemdraw 2019和Chem3D Pro 14.0绘制多肽三维结构,以PDBQT格式保存。GTase晶体结构从蛋白质数据(https://www.rcsb.org/structure/2QMJ)中获得,用PyMOL去除2QMJ中的阿卡波糖配体,使用Autodock进行脱水和氢化,计算gasteiger电荷并将所有原子分类为AD4类型,以PDBQT格式存储以备将来使用。
对接过程使用PyRx软件中的Vina分数,参考阿卡波糖在2QMJ中的位置设置对接盒,其他参数为默认值,将活性肽与GTase进行分子对接,并使用PyMOL软件演示配体和受体之间的相互作用。
1.3.9 紫菜发酵液对GTase活性抑制率的测定
参考董玉婷等[8]的方法略作修改,采用pNPG法进行测定。首先用超纯水将待测定样品稀释10倍,8 000 r/min离心10 min后取40 μL上清液加入120 μL PBS(0.1 mol/L,pH 7.3)与40 μL GTase溶液(262.5 U/mL)混合均匀,于酶标仪中40 ℃孵育10 min,随后加入40 μLpNPG(10 mmol/L)溶液,40 ℃反应15 min,立即加入40 μL Na2CO3(1 mol/L)溶液终止反应,于405 nm波长下检测溶液吸光度。每个试验重复3次。抑制率按公式(1)计算:
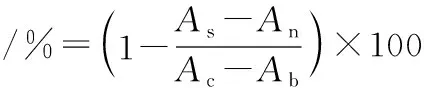
(1)
式中:Ac,对照组吸光度;Ab,空白组吸光度;As,样品组吸光度;An,样品空白组吸光度。
1.3.10 水解度的测定
参考余筱洁等[16]的方法以甲醛滴定法进行测定游离氨基态氮,以凯氏定氮法测定总氮含量。水解度按公式(2)计算:
DH/%=游离氨基态氮/样品总氮含量×100
(2)
1.4 数据处理
数据处理采用SPSS ver.28软件进行分析;采用Origin 18软件作图。所有数据进行3次平行实验,均以平均值±标准差表示。采用Duncan’s multiple range检验进行统计学意义分析,以P<0.05有统计学差异,不同字母表示差异显著。
2 结果与分析
2.1 发酵菌种的选择
从紫菜养殖网中初步筛选了5株枯草芽孢杆菌,分别命名为3、12、14、15和16号菌株,以GTase活性抑制率为主要指标,水解度为辅助指标,探究不同枯草芽孢杆菌菌株对紫菜的发酵情况。从图1可以看出,紫菜在不同枯草芽孢杆菌作用下,出现了不同程度的水解现象,其中3号与15号菌株的水解作用最大。同时,3号菌株产生了更高的GTase抑制率(13.64±4.32)%。因此选取3号枯草芽孢杆菌为发酵菌种。
2.2 发酵工艺的单因素试验
由图2-a可知,随着温度升高,抑制率呈现先上升后下降趋势,表明合适的生长温度有助于促进GTase抑制剂的生成[12]。当发酵温度30 ℃时GTase抑制率达到最高(12.01±0.80)%,但当温度继续升高,虽然有助于酶解反应促进肽的生成,但不利于菌种生长代谢,抑制率下降。因此30 ℃为最佳发酵温度。
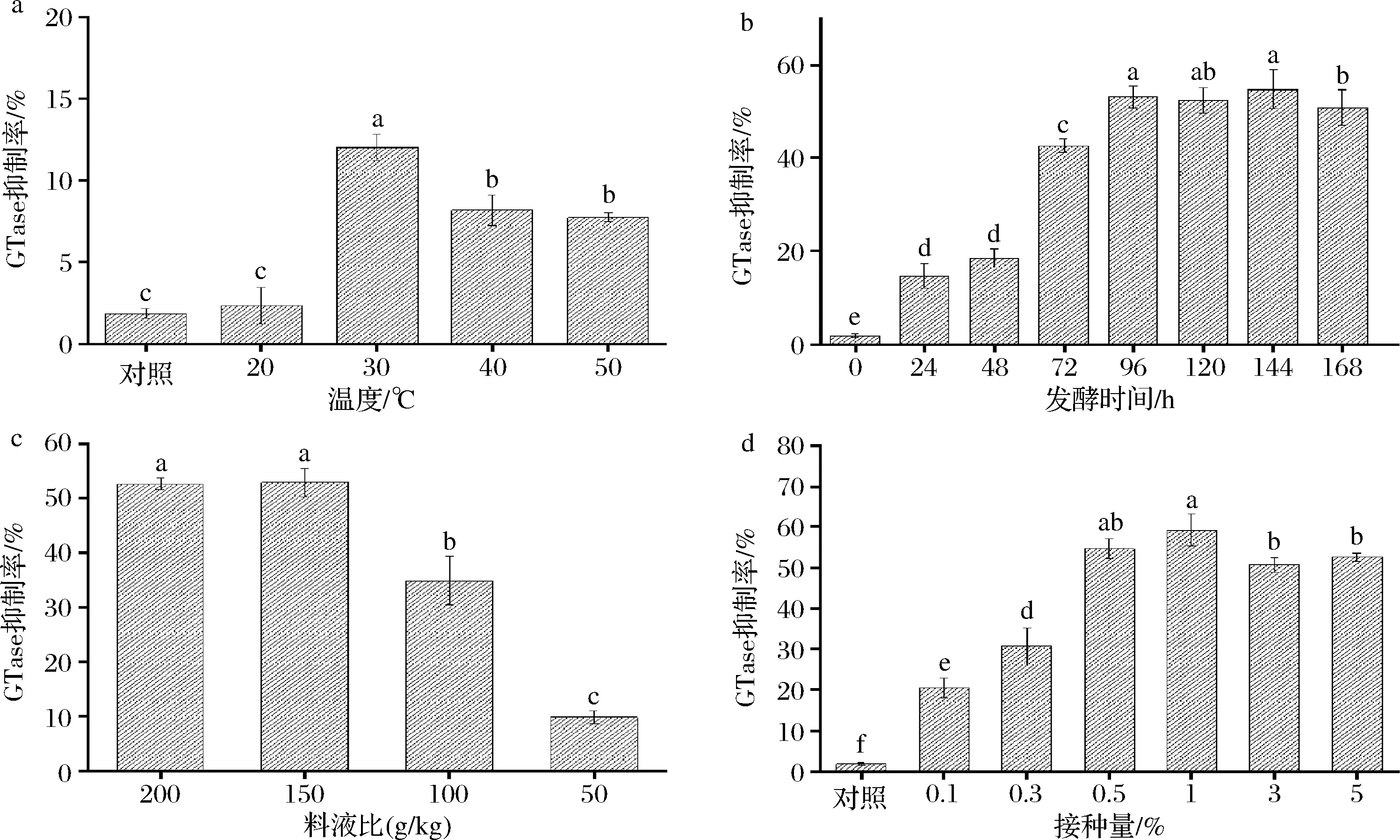
a-发酵温度;b-发酵时间;c-料液比;d-接种量图2 不同发酵条件对GTase抑制率的影响Fig.2 Effect of different fermentation conditions on inhibition rate of GTase注:不同字母表示差异显著(P<0.05)(下同)。
如图2-b所示,随着发酵时间的延长,GTase抑制率逐渐增加,并在发酵72 h时大幅度上升,到96 h后趋于平稳,抑制率为(53.15±2.36)%。在发酵96~144 h期间,抑制率差异不显著(P>0.05),这可能如同KIERS等[17]的研究中所述,在发酵72 h后,几乎所有蛋白质都已转化为肽类,更长的发酵时间并不导致更多的抑制剂产生。因此从时间成本角度考虑,选取96 h为最佳的发酵时间。
由图2-c可知,高料液比组的抑制率较高,随着料液比的下降,抑制率也随之下降,这是由于水分含量过多,营养浓度下降的同时也影响了发酵气体的交换,导致低料液比组的发酵速率较慢。由于200 g/kg组与150 g/kg组无显著性差异(P>0.05),考虑到生产成本,最终选择150 g/kg组为最佳料液比。
如图2-d所示,随着枯草芽孢杆菌接种量的升高,GTase抑制率呈现上升的趋势,在接种量为1%时发酵液的GTase抑制率最高(59.26±3.81)%,当接种量继续增大时,抑制率反而降低,这可能是因为枯草芽孢杆菌在接种量4%时生长最佳[18],而发酵培养基营养物质有限,过多生物量会导致紫菜蛋白快速消耗,无法生成足够的功能肽,因此选择1%为最佳接种量。
综上所述,单因素优化的结果得到最佳发酵条件为30 ℃、料液比150 g/L、1%接种量、发酵96 h,在此条件下制作的紫菜发酵液的GTase抑制率为(59.26±3.81)%。
2.3 正交试验优化发酵条件
考虑到各个因素之间交互影响,为了进一步确认最佳发酵条件,固定接种量为1%,以发酵温度、发酵时间、料液比进行三因素四水平的正交试验,以提高发酵液的GTase抑制率,结果如表2所示。根据GTase抑制率均值判断最优化组合为A2B4C2,即发酵温度30 ℃、发酵时间144 h、料液比150 g/kg。根据极差判断影响GTase抑制率主次因素顺序依次为A>C>B,即发酵温度>料液比>发酵时间。

表2 正交试验结果Table 2 Results of orthogonal test
方差分析结果如表3所示,发酵温度对于GTase抑制率有显著性影响(P<0.05),这与表2得到的结果相同,即发酵温度是该工艺的关键控制点。最终确定枯草芽孢杆菌发酵紫菜产GTase抑制剂的条件为:150 g紫菜加入850 mL超纯水,接种量为1%(体积分数),在30 ℃发酵144 h,离心后上清液对GTase抑制率为(70.91±1.96)%,将本工艺生产的发酵液进行喷雾干燥后命名为PFPOB并用于后续实验。
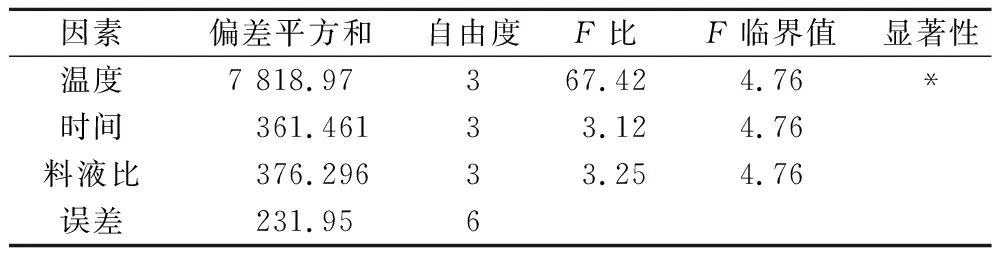
表3 方差分析结果Table 3 Result of analysis of variance
2.4 PFPOB对GTase的抑制类型分析
过高的浓度会使抑制率达到饱和,使剂量-反应曲线趋缓,不呈现线性关系,因此选择合适的线性部份作为标曲计算IC50值。如图3-a所示,在质量浓度0.3 mg/mL以下,PFPOB浓度与抑制率呈现显著正相关,IC50值约为0.21 mg/mL,其对GTase活性抑制优于阳性对照阿卡波糖(IC50=0.88 mg/mL)。
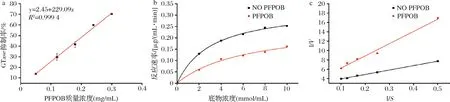
a-剂量-反应曲线;b-V-S图;c-Lineweaver-Buck双倒数图图3 PFPOB的IC50测定与抑制类型分析Fig.3 IC50 determination and inhibition type analysis of PFPOB
GTase的动力学反应结果如图3-b所示,加入PFPOB后Km增加,Vmax降低,根据图3-c中直线的斜率与截距计算可知没有PFPOB时Km为3.17 mmol/L,Vmax为0.335 μg/(mL·min),加入PFPOB后Km增加到了7.21 mmol/L,Vmax降至0.276 μg/(mL·min)。此外,如图3-c所示,在加入PFPOB后,直线斜率增加且两线交点靠近原点(-0.038,2.62),表明PFPOB主要是采用竞争性抑制方式来抑制GTase活性[19]。因为竞争性抑制剂在开放系统中仅表现出短暂的影响,不影响人体正常机能[20],所以PFPOB是一种有一定潜力的降血糖食品原料。
2.5 PFPOB抑制成分分析
2.5.1 凝胶过滤层析分离
为了进一步探究PFPOB的功能成分,将PFPOB使用Amicon®Ultra-15进行超滤分级,迅速冷冻干燥备用,其中<3 kDa的成分(3 mg/mL)对GTase的抑制率为(90.11±2.05)%,为主要抑制成分。使用Sephadex G-15分级为5个吸收峰(图4-a),其中GTase抑制活性最佳的是P3,抑制率为(50.07±3.42)%(图4-b)。

a-凝胶色谱图;b-各个峰的GTase抑制活性图4 Sephadex G-15凝胶层析结果Fig.4 Sephadex G-15 gel chromatography results
Sephadex G-15分级范围于100~1 500 Da,适合分离小分子肽、寡糖等成分。将PFPOB组分使用葡聚糖凝胶进行分离后,测量各层析管的GTase抑制率及肽含量的相关性,并使用SPSS进行相关性分析,计算肽含量与GTase抑制率的皮尔森相关系数。经多次重复实验,发现分离产物中肽含量与GTase抑制率呈显著或极紧密正相关。表明PFBOB中肽对GTase抑制率的影响起至关重要作用。
2.5.2 具有GTase抑制活性的肽片段筛选
为了表征具有GTase抑制活性的肽,通过LC-MS/MS(图5-a)鉴定了PFPOB中的肽序列(<1 kDa)。用Uniprot数据库与紫菜全蛋白进行数据比对,共检测到29条肽,将这些肽进一步的软件模拟,以筛选具有最高抑制活性的肽片段。

a-总离子谱图;b-GPGDFL的MS/MS谱图;c-SPPPPPA的MS/MS谱图图5 肽谱鉴定结果Fig.5 Peptide spectrum identification results
阿卡波糖与人源GTase(PDB:2QMJ)对接结果表明Asp203、Arg526、Thr205、Asp542、His600和Asp327活性位点中的氨基酸残基在形成活性口袋和稳定原始配体中起重要作用[21]。使用对接工具将筛选肽取代阿卡波糖进行分子对接,将低于-8.0 kcal/mol的结合能设置为筛选条件。筛选得出2种有潜力的肽,其MS/MS谱图如图5-b和图5-c所示。GPGDFL和SPPPPPA结合能皆为-8.2 kcal/mol,与GTase有一定结合力,具有抑制其活性的潜力。
2.5.3 GTase抑制肽的分子对接与抑制机理解析
从分子对接示意图(图6)中可以看到2条肽均可嵌入GTase活性口袋,阻止底物的进入。GPGDFL与GTase对接结果如图6-a所示,其Phe与Leu残基与GTase活性口袋中的Asp542、Arg526、His600共形成5个传统氢键相互作用,平均距离为2.34 Å。SPPPPPA对接结果如图6-b所示,其Ser、Pro、Ala 残基分别与GTase活性口袋中的Asp443、Ser448、Arg526、Trp539、Asp542、Asp571共形成8个传统氢键相互作用,平均距离为2.58 Å。两者氢键相互作用平均距离皆短于传统的3.5 Å,有助于活性肽与GTase活性位点形成紧密且稳定的结合[21],其中Trp539、Asp542、His600、Asp443和Arg526是反应底物与GTase活性口袋结合的关键活性位点[22],通过与关键位点的竞争性结合,可以阻止GTase对底物的作用。

a-GPGDFL;b-SPPPPPA图6 肽与GTase的对接结果Fig.6 Docking results of peptides with GTase注:左至右分别为整体3D图,对接位点3D图(不同颜色表示不同氨基酸),与对接位点2D图。
此外,一些文献报道认为,降血糖肽中的Pro和Leu这2种疏水性氨基酸是对GTase分别或协同具有抑制作用的重要氨基酸[23],这2种氨基酸在紫菜蛋白中含量丰富[7],本研究从肽谱鉴定得到的29条肽均存在这2种氨基酸,表明了紫菜是一种优质的降血糖肽来源。这与GPGDFL和SPPPPPA的对接结果相符,如图6所示,SPPPPPA上的Pro环状结构与Trp406、Phe575形成π-烷基作用,而GPGDFL的Pro与Ala576,Leu与Tyr299、Ile328、Ile364与Trp406共形成7个π-烷基作用,同时Tyr299上的苯环与Phe残基上的苯环会形成π-π堆积作用,这些疏水性胺基酸的疏水相互作用可能改变GTase活性口袋构象[24],使活性位点与肽结合的更紧密,并阻止了底物的进入。
分子对接结果表示GPGDFL与SPPPPPA能够与GTase活性位点中的关键氨基酸残基形成传统氢键、疏水相互作用、范德华力和静电相互作用力。其中分别是Leu、Phe与Pro、Ala残基起到了重要的作用,并通过竞争酶与底物的结合位点及改变酶的构型来抑制GTase活性,与PFPOB对GTase活性抑制类型实验结论一致。此外,有大量鉴定肽段的N端第一个或第二个氨基酸为Pro或Ala,与报道的二肽激肽酶抑制肽一致[25],这些肽有可能对血糖的调控起到协同作用,这方面的研究将在进一步的功效研究中阐明。
3 结论
本研究以紫菜为基质使用枯草芽孢杆菌进行固态发酵,制备了具有GTase抑制活性的紫菜发酵液。经过正交试验优化后的发酵条件为发酵温度30 ℃、料液比150 g/kg、接种量1%(体积分数)、发酵时间144 h,制备的PFPOB的IC50为0.21 mg/mL,优于阳性对照药物阿卡波糖。PFPOB抑制方式为竞争性抑制,其中的肽含量与GTase抑制率呈极显著正相关,将PFPOB进行肽谱鉴定后得到了肽GPGDFL与SPPPPPA。与人来源的GTase的分子对接结果表明其通过竞争GTase与底物的结合位点来抑制GTase活性,是一种有效的潜在降血糖成分。PFPOB具有生产成本低,设备要求低,不使用化学药剂等优势。总之本研究为紫菜源GTase抑制剂的工业化生产提供一定的理论指导,并为紫菜的高值化开发利用奠定理论基础。

