PCR与G-四链体联用可视化鉴别人参与西洋参
刘墨祎,汪香君,汪洺卉,李迎,刘丽梅
(北华大学 医学技术学院,吉林 吉林,132013)
人参和西洋参均为五加科人参属的草本植物,其根、茎等部位均可入药,药用价值极高[1-2]。由于人参和西洋参为人参属近缘物种,两者形态和化学成分较为相似,因此市场上将两者掺杂混用现象时有发生[3]。但人参与西洋参在药性和药效上存在较大差异:人参性温,补气助阳,适合体质为寒性的人服用;而西洋参性凉,易于补气养阴,适合阴虚体质或者燥热的人服用[4-6],两者在临床上不可混用。目前国内外对人参和西洋参的检测方法包括形态学、化学分析法和分子生物法[7-8],但都易受到外部环境条件、加工过程和人为主观因素的影响。因此,急需建立一种简单高效的人参和西洋参鉴别方法。
G-四链体(G-quadruplex)是由富含鸟嘌呤(G)的DNA或RNA序列形成的一类独特的核酸结构[9-10]。G-四链体有3种不同的拓扑结构,分别为平行式、反平式和混合式[11]。CHENG等[12]研究发现,不同的结构下G-四链体的稳定性不同,且与氯高铁血红素结合能力也不同[13]。稳定的G-四链体结构可在K+作用下与氯高铁血红素(Hemin)结合,形成具有类似辣根过氧化物酶活性的模拟酶(DNAzyme),在H2O2存在的条件下催化ABTS由无色变为绿色[14]。根据这一原理已实现对金属离子[15-17]、核酸及蛋白等小分子物质[18-19]的检测。G-四链体形成的具有氧化酶活性的模拟酶(DNAzyme)与酶相比,具有热稳定性、高催化效率、易于制备和修饰等特点[20]。本实验将PCR技术与G-四链体功能特点结合,以人参与西洋参基因组DNA上的特异性snp位点,设计了5′端含有G-四链体互补序列的上下游引物,通过PCR扩增目标序列,获得大量含G-四链体的双链DNA,并形成G-四链体结构的DNAzyme,建立了针对人参和西洋参的PCR与G-四链体联用的可视化鉴别方法。
1 材料与方法
1.1 材料与试剂
本研究中的人参和西洋参样品均由国家参茸检验检测中心提供;引物,生工生物工程(上海)股份有限公司合成;Premix TaqTM,宝生物工程(大连)有限公司;ABTS、氯高铁血红素(Hemin),上海源叶生物科技有限公司;植物基因组DNA提取试剂盒,天根生化科技(北京)有限公司;PCR产物纯化回收试剂盒,北京博迈德基因技术有限公司。
1.2 仪器与设备
LX-100手掌型离心机,江苏海门市其林贝尔仪器制造有限公司;ETC811型基因扩增仪,苏州东胜兴业科学仪器有限公司;梯度电泳分析仪、酶标仪,Bio-Rad公司;凝胶成像分析仪,德国耶拿公司;DNA/蛋白质分析仪,Quawell公司。
1.3 实验方法
1.3.1 基因组DNA的提取
用植物基因组DNA提取试剂盒提取样品基因组DNA,DNA浓度通过DNA分析仪检测获得。
1.3.2 引物设计
在NCBI上查找人参和西洋参的基因组序列,利用DNAMAN进行多序列比对。发现人参和西洋参在18S基因上存在snp位点,依据snp位点设计出用于特异性识别和扩增人参基因组序列的上下游引物。上游引物序列为:5′-ATAACAATACCGGGCTGATAC-3′;下游引物序列为:5′-GCCAGTTAAGGACAGGAG-3′,并在引物的5′端加上一段G-四链体的反向互补序列,修饰后的上游引物序列为:5′-CCCACCCACCCACCCATAACAATACCGGGCTGATAC-3′;修饰后的下游引物序列为:5′-CCCACCCACCCACCCGCCAGTTAAGGACAGGAG-3′,其中5′-CCCACCCACCCACCC-3′为G-四链体序列[(G3T)3G3]的反向互补,在K+的存在下可形成平行的G-四链体结构,且稳定性好,可视化反应结果明显[21]。
1.3.3 PCR反应体系和条件的优化
以人参和西洋参的基因组DNA为模版进行PCR反应体系和条件的优化。首先在无模版的体系下进行PCR,检测1、2、3、4、5、6、8、10 μmol/L引物浓度下引物二聚体的形成对G-四链体显色反应的影响;然后进行引物浓度与模版浓度之间的优化,引物浓度梯度设置为2、4、6、10 μmol/L,模版浓度梯度为0.001、0.01、0.1、1、10 ng/μL;最后确定最适的PCR退火温度,退火温度梯度设置为54、58、62、66、70 ℃。
最终对比PCR和显色结果确定反应体系:10 μL Premix TaqTMDNA聚合酶,4 μL DNA(10 ng/μL)模版,1 μL上下游引物(10 μmol/L),加双蒸水至20 μL。PCR扩增条件:95 ℃预变性5 min,95 ℃变性25 s,54 ℃退火25 s,72 ℃延伸25 s,72 ℃延伸5 min,30个循环。PCR产物用2%的琼脂糖凝胶电泳(120V,40 min)进行鉴定,利用凝胶成像系统对结果进行观察分析。
1.3.4 可视化反应体系的优化
将用DNA纯化回收试剂盒回收得到的PCR产物加入20 μL结合缓冲液(25 mmol/L HEPES pH 7.4、20 mmol/L KCl、200 mmol/L NaCl、质量分数0.05% Triton X-100、体积分数1%的DMSO与2 μL不同终点浓度Hemin溶液充分混匀,终浓度梯度为0.005、0.01、0.1、0.5、1 mmol/L。95 ℃孵育5 min完成G-四链体的折叠。之后4 ℃孵育8 min,使G-四链体与Hemin充分结合。加入20 μL不同终点浓度的ABTS,终浓度梯度为3、10、30、45、60 mmol/L,以及2 μL H2O2(3%)室温避光反应至变色,酶标仪测定420 nm处的吸光度值,选择最优的可视化结果进行后续的实验。
1.3.5 特异性检测
为验证特异性,分别对4组人参样品和4组西洋参样品的基因组DNA进行提取。按照优化后的反应条件和最适体系进行PCR扩增与G-四链体联用可视化检测,测定420 nm处的吸光值,验证本实验方法的特异性。
1.3.6 灵敏度检测
将提取的人参基因组DNA进行稀释,浓度梯度为:0.001、0.01、0.1、1、10 ng/μL,根据已优化好的反应条件和最适体系进行PCR扩增与G-四链体联用可视化检测,测定420 nm处的吸光值,以检测本实验方法的灵敏度。
1.4 数据处理
数据处理采用Excel,柱状图和折线图的绘制采用GraphPad Prism8,并采用Adobe Photoshop软件对图片进行组合排列。每组实验数据进行3次重复。
2 结果与分析
2.1 PCR反应体系以及条件的优化
2.1.1 无模版情况下引物浓度对可视化显色效果的影响
和普通PCR引物不同,本实验在PCR上下游引物的5′端加入了G-四链体反向互补序列进行修饰,这样可能会导致引物二聚体更易形成,并干扰实验结果。为了排除这一干扰因素,将引物稀释为1、2、3、4、5、6、8、10 μmol/L的梯度浓度,对其进行G-四链体与PCR联用可视化检测。由图1-a可知,在不同引物浓度下,无模版的PCR体系在扩增后未产生目的条带,且引物浓度与引物二聚体的增加成正比;由图1-b可知,引物浓度对显色反应无明显影响,且在420 nm下吸光度值之间无明显差异。因此,无模版情况下引物浓度对G-四链体与PCR联用可视化显色效果没有明显影响。

a-PCR产物凝胶电泳图;b-G-四链体可视化检测显色效果和420 nm处吸光值图1 无模版PCR体系里引物浓度对G-四链体显色反应的影响Fig.1 Effect of primer concentrations in a PCR reaction system without templates on the G-quadruplex colorings reaction注:M-Marker DL2000;1~8分别为1、2、3、4、5、6、8、10 μmol/L。
2.1.2 PCR体系中引物浓度对模版DNA浓度的优化
根据PCR扩增的原理,在模版浓度不变时,引物浓度增加会导致PCR产物的增加,反之亦然。所以找到最适的引物浓度与其相对应的最适模版浓度对PCR反应的优化尤为重要。从图2可以看出,当引物浓度为10 μmol/L时,可检测出最低浓度为0.1 ng/μL的模版,因此选择引物浓度为10 μmol/L作为后续实验的引物浓度。且在此引物浓度下,模版浓度为10 ng/μL时,电泳图的目的条带最为明显,所以选择模版浓度为10 ng/μL进行后续的实验。

a-2 μmol/L;b-4 μmol/L;c-6 μmol/L;d-10 μmol/L图2 PCR反应体系中引物浓度与模版浓度之间的优化Fig.2 Optimization of the ratio of primer to template in a PCR reaction system注:M-Marker DL2000;1-阴性对照;2~6为0.001、0.01、0.1、1、10 ng/μL
2.1.3 PCR反应退火温度的优化
退火温度也是PCR反应中重要的影响因素,退火温度的高低会影响PCR产物的产生,找到最适合反应体系的退火温度至关重要。在以上优化条件的基础上将退火温度梯度设置为54、58、62、66、70 ℃,观察反应结果。图3为退火温度为54、58、62、66、70 ℃下PCR产物的琼脂糖凝胶电泳图,可见退火温度为54 ℃时,条带最明显,因此选择退火温度为54 ℃进行后续实验。

图3 PCR反应退火温度的优化Fig.3 Optimization of PCR reaction annealing temperature注:M-Marker DL2000;1-阴性对照;2-54 ℃人参PCR产物;3-54 ℃西洋参PCR产物;4-58 ℃人参PCR产物;5-58 ℃西洋参PCR产物;6-62 ℃人参PCR产物;7-62 ℃西洋参PCR产物;8-66 ℃人参PCR产物;9-66 ℃西洋参PCR产物;10-70 ℃人参PCR产物;11-70 ℃西洋参PCR产物
2.2 可视化反应体系的优化
2.2.1 Hemin终浓度的优化
将反应体系中的Hemin终浓度设置为0.005、0.01、0.1、0.5、1 mmol/L进行反应,对比显色结果得到最适的Hemin浓度。如图4-a可见,在420 nm处随着Hemin浓度的增高,人参PCR产物吸光度值不断增加,当浓度>0.5 mmol/L时增加较少,说明G-四链体产生的量趋于饱和。且观察对比图4-a中人参组与西洋参组的显色变化,在Hemin浓度为0.5 mmol/L时有明显差异,所以Hemin终浓度定为0.5 mmol/L。
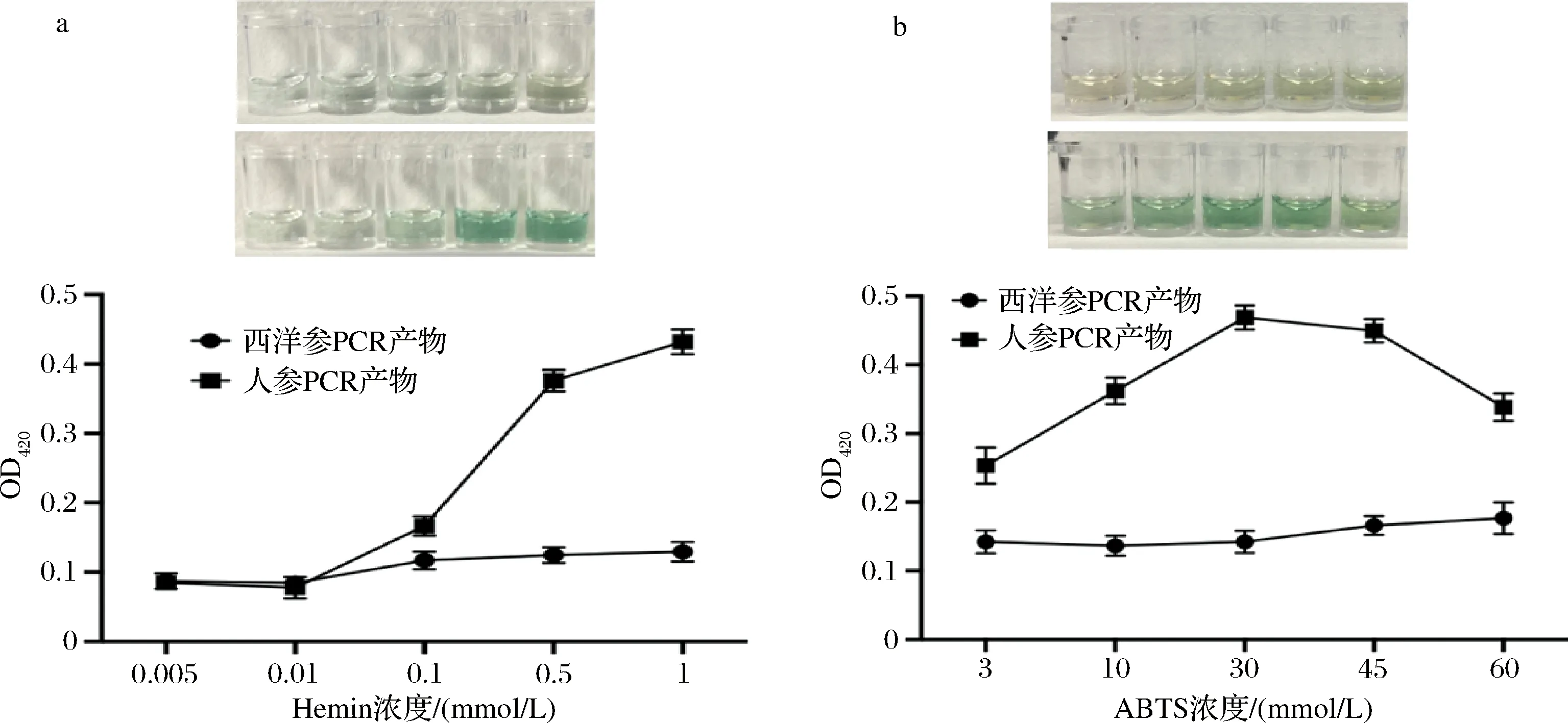
a-Hemin浓度;b-ABTS浓度图4 Hemin浓度、ABTS浓度的优化Fig.4 Optimization of Hemin and ABTS concentration
2.2.2 ABTS终浓度的优化
将反应体系中的ABTS终浓度设置为3、10、30、45、60 mmol/L进行反应,对比显色结果得到最适的ABTS浓度。如图4-b可见随着ABTS浓度的增加,在420 nm处人参PCR产物的吸光度值先是上升,到达30 mmol/L浓度时开始下降,且观察对比图4-b中人参组与西洋参组的显色变化,在ABTS浓度为30 mmol/L时显色有明显差异,所以ABTS终浓度选择为30 mmol/L。
2.3 特异性检测
按照已优化好的反应体系,将4组人参样品和4组西洋参样品的基因组DNA作为模板,进行PCR反应,再对PCR反应产物进行G-四链体显色反应。如图5可见4组含有人参基因组DNA的反应体系均有明显的颜色变化,且4组含有西洋参基因组DNA的反应体系无明显颜色变化;在420 nm处的吸光度值对比,人参组和西洋参组也有明显差异。因此表明本实验的PCR与G-四链体联用可视化鉴别人参与西洋参的方法具有很高特异性。

图5 特异性检测Fig.5 Detection of specificity注:1~4为人参样品;5~8为西洋参样品
2.4 灵敏度检测
根据已优化好的体系,分别将浓度为0.1、0.5、1、5、10 ng/μL的人参基因组DNA作为模板,进行PCR反应,对PCR反应产物进行G-四链体显色。如图6可知,含有1、5、10 ng/μL浓度人参基因组DNA的反应体系显色反应有变化,且在420 nm处的吸光度值与空白对照有明显差异;而含有0.1、0.5 ng/μL人参基因组DNA的反应体系显色反应没有明显变化,在420 nm处吸光度值与空白对照无明显差异。所以当样品中含有1 ng/μL的人参基因组DNA时,即可通过本实验的G-四链体与PCR联用可视化方法鉴别检测。

图6 灵敏度的检测Fig.6 Sensitivity detection
3 讨论
近年来随着科学技术的发展,人参与西洋参的鉴别方法也在逐渐进步,越来越多的现代生物技术被应用到其中[22],包括DNA条形码鉴定[23]、DNA分子遗传标记技术[24]、蛋白质指纹图谱分子鉴定技术等[25]。但都存在着不同的缺点,无法做到简便快速地鉴别人参与西洋参。G-四链体作为一种具有氧化酶活性的模拟酶,具有热稳定性、催化效率高,易于制备和修饰等优势[20],已被广泛用于核酸、蛋白或小分子的检测中,且检测效率高、特异性强,适用于现场的快速检测[26-27]。但目前G-四链体的研究和应用还存在一定的局限性,例如,在金属离子的检测中,所能检测的金属离子种类过少;比色传感器中,可用显色底物只有几种;缺乏对优化传感系统和消除基质效应的研究等。在以后研究中如能更好地优化和发挥G-四链体的作用,可将其应用到更广泛的领域中去。
PCR作为一种核酸扩增技术,可通过变性、退火、延伸组成的多个循环反应使模版序列以指数倍扩增,在核酸检测领域中得到广泛应用。传统的PCR结果分析一般采用琼脂凝胶电泳技术,但存在操作复杂、结果无法直接观察等缺点。本实验将G-四链体与PCR技术的优势相结合,设计了5′端含有G-四链体反向互补序列的PCR引物,通过对目的序列的扩增产生大量的G-四链体序列,最后G-四链体催化底物显色使PCR结果可在肉眼下直接观察。
综上所述,通过将G-四链体与核酸扩增技术相结合,我们建立了一种可视化鉴别人参与西洋参的方法,相较于目前已有的人参和西洋参的鉴别方法,耗时更短、灵敏度更高、成本更加低廉。且PCR的引物设计简单,使该方法更易于普及。但对于参类产品的鉴定中,相比于实验样品DNA的提取效率可能会更低,显色结果颜色更浅,肉眼比色鉴定时灵敏度可能会变低;显色反应时ABTS变色的时间没有明确的标准,需要时刻进行观察;G-四链体在反应中生成的效率也会受到结合缓冲液pH、阳离子、温度等因素的影响,对实验的操作环境要求较高。
4 结论
目前,利用G-四链体与PCR联用鉴别人参与西洋参的相关研究尚未报道。本实验所建立的针对人参与西洋参的 PCR与G-四链体联用的可视化鉴别方法,相比于其他生物技术鉴别方法,无需测序和电泳,在室温下便可用肉眼直接观察结果。含有人参基因组DNA的样品,在引物作用下通过PCR扩增,获得大量含G-四链体的双链DNA,并形成G-四链体结构的模拟酶,催化ABTS显色。
在本实验中G-四链体的形成是最后达到可视化鉴别的关键,所以如何设计适合的引物使G-四链体更好地形成是本实验的重点。G-四链体具有多种拓扑结构,包括平行结构、反平行结构和杂合结构等[26]。不同序列的G-四链体其结构和DNAzyme活性都不同,根据现有的对G-四链体结构与DNAzyme活性的研究结果[21],本实验选择的G-四链体序列为[(G3T)3G3],可形成平行的G-四链体结构,且稳定性好,具有较高的过氧化物酶活性。
本实验针对人参与西洋参基因组DNA,将PCR技术与G-四链体功能特点结合,建立了鉴别人参和西洋参的PCR与G-四链体联用的可视化鉴别方法,灵敏度可达0.1 ng/μL。且该方法具有稳定性好、操作简便、便于观察等优点,为中药材鉴定提供了新的思路。

