HMGCS2在疾病中的研究进展
褚 微 张 冰 纪 洪
1. 枣庄市立医院病理科,山东 枣庄 277000; 2. 滨州医学院附属医院病理科,山东 滨州 256603; 3. 山东大学齐鲁医院(青岛)泌尿外科,山东 青岛 266035; 4. 山东大学齐鲁医院(青岛)病理科,山东 青岛 266035
酮体(ketone bodies,KBs)是脂类衍生的小分子,在禁食或长时间运动时为组织提供能量[1-2]。禁食期间肌肉和肝脏储存的糖原首先被耗尽,脂肪酸从脂肪细胞中被动员起来,在肝脏转化为KBs,通过循环分配到代谢活跃的组织如肌肉、大脑等提供能量[2]。线粒体3-羟基-3-甲基戊二酰辅酶A 合成酶(mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase 2,HMGCS2),是羟甲基戊二酰辅酶A(hydroxy methylglutaryl coenzyme A,HMG-CoA)家族成员[3],其编码基因是一种诱导性基因,在生理条件下控制肝脏KBs 的产生[4]。该基因的近端启动子含激素(如胰岛素)和代谢物(如长链脂肪酸或丁酸盐)[5-7]。
1 HMGCS2的结构与功能
HMGCS2基因定位于1q12,DNA 序列长20 936 bp,包含9个外显子和8个内含子,蛋白定位于线粒体[3,5],是酮生成途径中的第1限速酶[8-9]。在乙酰乙酰CoA硫醇化酶的催化下,2个乙酰CoA分子凝聚形成乙酰乙酰CoA。HMGCS2 将乙酰CoA 和乙酰乙酰CoA 缩合形成HMG-CoA。HMG-CoA 在其裂解酶的作用下生成乙酰乙酸。乙酰乙酸通过2 种途径代谢,一种通过非酶促脱羧作用生成丙酮,另一种通过D-β-羟丁酸脱氢酶的作用生成D-β-羟丁酸[10-12]。乙酰乙酸、丙酮、β-羟丁酸合称为KBs。HMGCS2是合成HMG-CoA 的关键酶,HMG-CoA 是合成KBs 的相关酶,所以HMGCS2对KBs的生成有重要作用。
2 在非肿瘤性疾病中的研究
2.1 阿尔茨海默病(Alzheimer's disease,AD)
β - 淀 粉 样 前 体 蛋 白(β -amyloid precursor protein,APP)及其一系列切割片段是AD 发病机制中的主要因素,APP 代谢途径被认为是AD 治疗的关键机制及药物靶点。除参与生酮途径外,HMGCS2 还参与类异戊二烯和胆固醇的生物合成,并与APP 相互作用[13],提示HMGCS2 可能在AD 的病理生理过程中发挥作用。Hu 等[14]发现与对照组相比,转染HMGCS2的HEK293-APPswe细胞显著增加微管相关蛋白轻链3II(microtubule-associated protein light chain 3II,LC3-II)的蛋白表达水平,当长春新碱(vinblastine,Vin)、渥曼青霉素(wortmannin,Wort)和3-甲基腺嘌呤(3-methyladenine,3-MA)同时处理HEK293-APPswe 细胞时,mHMGCS2 诱导的LC3-II 信号减弱,表明HMGCS2 激活的自噬受到抑制。氯喹(chloroquine,CQ)存在时,HMGCS2 对LC3-II信号强度的影响增加,表明HMGCS2对CQ与LC3-II 的形成具有协同作用。使用雷帕霉素(rapamycin,Rapa)处理HEK293-APPswe 细胞时,降低了HMGCS2对LC3-II蛋白水平的影响,说明Rapa和HMGCS2 之间存在竞争性抑制,提示mTOR 在HMGCS2 调控自噬中发挥作用。这些均表明HMGCS2在自噬过程中起着正向调节的作用。
2.2 糖尿病并发症
高血糖和KBs 会加重细胞的氧化应激,导致活性氧(reactive oxygen species,ROS)的过量产生和组织抗氧化功能的受损。长期接触ROS 会发生慢性炎症和纤维化,导致心脏功能不全[15],因此,高血糖和KBs 的增加会加重心血管疾病发生的风险。Shukla 等[16]通 过RNA 微 阵 列 和 独 创 路 径 分 析(ingenuity pathway analysis,IPA),发现与1型糖尿病(type 1 diabetes,T1D)心脏功能障碍相关的差异表达基因中HMGCS2的表达水平最高,且T1D中小鼠的心、肾、脾组织内HMGCS2 的mRNA 和蛋白表达均显著高于对照组,提示HMGCS2可能在T1D相关的心功能不全过程中参与心脏能量代谢,且HMGCS2 上调增加肾脏KBs 的生成,最终导致糖尿病肾病,这一结果与Kelly 等[17]一致。Wang 等[18]也发现,沉默脂质过氧化物酶体增殖物激活受体-α,可下调HMGCS2,进而减轻心肌细胞损伤和氧化应激反应,降低血糖和血脂,为治疗糖尿病心脏病提供新的潜在靶点。
2.3 心肌病
高脂饮食(high fat diet,HFD)可导致心肌肥大和纤维化,降低冠脉储备和心功能,亲联蛋白2(junctophilin-2,JPH2)是一种在形成连接膜复合体过程中起关键作用的心脏结构蛋白,与肥厚型心肌病、心律失常和脂毒性心肌病有关[19]。Li 等[20]和Sikder 等[21]发现,HFD 小鼠心脏中HMGCS2 水平升高,JPH2水平下降。敲低HMGCS2可阻止棕榈酸酯刺激心肌细胞中Caspase-3的凋亡和裂解,从而上调JPH2的表达;miR-344G-5p过表达可降低棕榈酸酯诱导心肌细胞HMGCS2、JPH2的表达和Caspase-3 的裂解。因此,机体可能通过上调miR-344G-5p抑制HMGCS2 的表达,对抗脂毒性,保护心脏。miR-344G-5p/HMGCS2/JPH2 轴是抗脂毒性心肌保护的新机制,为心肌病的诊断和治疗提供新的方向。
2.4 其他疾病
Singh等[22]发现,HMGCS2是参与氯萨利酮和氢氯噻嗪诱导血糖变化的基因之一,为噻嗪类药物引起高血糖的机制提供新的诊疗思路,并为高血压病的个性化治疗提供选择。Kim 等[23]发现,在肿瘤坏死因子-α 诱导的肠上皮细胞凋亡和炎症反应中,HMGCS2 具有保护作用。Eden 等[24]通过生物分析发现,HMGCS2 在长期溃疡性结肠炎(ulcerative colitis,UC)中高表达(表1),有利于UC的诊断、与其他炎症性肠道疾病的鉴别及治疗。

表1 HMGCS2在非肿瘤性疾病中的研究
3 HMGCS2在肿瘤性疾病中的研究
3.1 肝细胞肝癌(hepatocellular carcinoma,HCC)
Su 等[25]发现miR-107 直接靶向HMGCS2 的3’-UTR 下调其mRNA 表达,并通过ERK/c-Jun 信号通路发挥抗肝癌转移的作用。Wang 等[10-11]也证明HMGCS2 的表达与HCC 的严重程度相关。HMGCS2 在脂肪变性和慢性肝炎肝组织与正常肝组织相比无明显变化,在结节性肝硬化组织中表达降低,HCC 中表达显著降低。在Hep3B 和Huh-7 细胞系中通过慢病毒转染敲低HMGCS2基因后,其可通过c-Myc/cyclin D1 通路促进细胞增殖,上调上皮间质转化(epithelial-mesenchymal transition,EMT)信号通路,促进细胞迁移,抑制Caspase 依赖的凋亡通路,从而促进细胞增殖、迁移。生酮饮食也显著抑制皮下肿瘤生长,提示HMGCS2可能是HCC治疗的靶向生物标记物。
3.2 结直肠癌(colorectal cancer,CRC)
HMGCS2 在CRC 的表达在不同研究组中存在差异。Camarero 等[26]发现,HMGCS2 在正常肠黏膜上皮高表达,在CRC 中低表达。HMGCS2 是c-myc的直接靶标,通过基因近端启动子上的Sp1 结合位点阻断Miz-1 的反式激活,抑制HMGCS2 的转录活性。Kim 等[27]则证明,c-myc 在肠细胞中通过Wnt/β-catenin 信号对HMGCS2 表达的调节作用很小,Wnt/β-catenin 信号独立于c-myc调节酮的发生。同时 发 现 抑 制PPARγ 降 低HMGCS2 表 达,激 活PPARγ则增加HMGCS2表达,敲除β-catenin可增强PPARγ与HMGCS2启动子结合,证实HMGCS2是肠上皮细胞Wnt/β-catenin/PPARγ 信号的下游靶点。这与Zou 等[28]的研究结果一致。而Chen 等[8]发现,与正常组织相比,HMGCS2 在CRC 组织中表达上调,其表达与CRC 患者的TNM 分期、淋巴结转移和预后显著相关。HMGCS2 直接与Src 的转录激活剂脂质过氧化物酶体增殖物激活受体-α 结合,促进Src 的活性。Lee 等[3]也发现,HMGCS2 的过表达与晚期治疗前后肿瘤或淋巴结状态和较低的肿瘤消退级别密切相关,HMGCS2 过表达者预后不良,提示HMGCS2 的过表达与直肠癌术前放化疗的易感性较低相关。这些不同的研究结果提示,HMGCS2在CRC中的致病机制复杂多变,需要进一步深入的研究。
3.3 乳腺癌(breast cancer,BRCA)
Li 等[29]通 过 生 物 信 息 学 对 浸 润 性 导 管 癌(invasive ductal carcinoma,IDC)和 导 管 原 位 癌(ductal carcinoma in situ,DCIS)进行研究,发现与DCIS 组织相比,IDC 组织中HMGCS2 表达显著下调,且HMGCS2 是预测IDC 患者生存率的独立预后因素,为IDC患者提供一种新的潜在的预后标志物。Wang 等[30]通过对脂质代谢基因的研究发现,HMGCS2 蛋白表达水平在ER 阴性的BRCA 病例中对侧未受影响的乳腺(contralateral unaffected breast,CUB)显著高于ER 阳性病例的CUBs。与CUBs的结果相反,HMGCS2在BRCA侧的表达模式发生了逆转,在ER阴性的BRCA中HMGCS2 mRNA和蛋白表达显著低于ER阳性BRCA,提示HMGCS2可能参与不同ER 亚型BRCA 的发生发展,可作为ER阴性BRCA风险生物标志物的临床验证。
Gromov等[31]基于蛋白质组学,结合质谱和免疫组织化学分析发现,HMGCS2 与汗腺分化密切相关,HMGCS2的表达在乳腺大汗腺化生和大汗腺囊肿中比正常非大汗性乳腺上皮细胞显著升高,浸润性大 汗 腺 癌(invasive apocrine carcinomas,IAC)HMGCS2 阳性表达率高达100%,非大汗腺癌仅为16.7%。HMGCS2与类固醇谱(HMGCS2+/AR+/ER-/PR-)相结合,比单独使用类固醇谱(AR+/ER-/PR-)识别IAC的敏感性更高。
3.4 前列腺癌(prostate cancer,PCa)
Saraon等[32]通过蛋白质组图谱和IPA分析发现与PCa 进展相关的5 种生酮途径关键酶:HMGCS2、酰基辅酶A 胆固醇酰基转移酶1、β-羟基丁酸脱氢酶1、3-羟甲基-3-甲基戊二酰辅酶A裂合酶、3-琥珀酰辅酶A 转移酶1,其中HMGCS2 倍数变化最大(9倍)。在PCa 组织中HMGCS2 mRNA 表达水平显著高于正常组织,且在高级别PCa中(Gleason分级 ≥ 8分)蛋白水平显著高于正常前列腺组织和低级别PCa,提示HMGCS2 在PCa 向晚期发展过程中发挥作用。体外雄激素非依赖型细胞株中表达模式与组织相似,支持生酮酶谱改变参与了雄激素非依赖型PCa的发展。生酮途径可能是PCa细胞获得生存优势、具有较高的侵袭性并获得雄激素非依赖型特性的能量产生机制。
而Wan 等[33]发现PCa 组织中HMGCS2 的表达明显低于正常前列腺组织,HMGCS2 的低表达与PCa患者的Gleason评分、病理分级以及远处转移密切相关。敲除HMGCS2可促进PCa细胞在体外的增殖、侵袭和迁移,降低PCa 细胞的凋亡率。说明HMGCS2下调与PCa的发生发展和患者不良预后相关,HMGCS 在PCa 中发挥抑癌作用,其相关通路可能成为抗PCa 治疗候选药物的作用靶点。这与Saraon 等[32]的研究结果相反,提示HMGCS2 在PCa中的致病机制可能与激素有关,但需要进一步地深入研究。
3.5 肾透明细胞癌(clear cell renal carcinoma,ccRCC)
Han 等[34]发现,在ccRCC 中HMGCS2 mRNA 和蛋白表达水平降低,HMGCS2 转录水平的降低与其启动子区域相对较高的甲基化率显著相关。HMGCS2基因转录起始位点和第1外显子区域的甲基化率越高,患者的临床预后越差。HMGCS2的表达可抑制ccRCC的侵袭和迁移能力,为肿瘤的治疗提供了方向。Xu等[35]通过生物信息学证实,HMGCS2 mRNA 在ccRCC 中低表达,且HMGCS2 低表达与患者不良预后具有显著相关性,提示HMGCS2可作为一种有潜在价值的诊断和预后生物标志物。
Hao等[36]使用多组学数据对来自不同肿瘤组织的脂质代谢基因进行分析,发现HMGGCS2是与泛癌免疫微环境相关的脂质代谢基因之一,HMGCS2低表达与ccRCC患者的预后不良相关,这与Xu等[35]的结果一致。一系列相关研究为ccRCC的生物标志物和治疗靶点提供了新的线索。
3.6 食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)
Tang 等[37]研究发现,与食管正常组织相比,约65.5%和37.6%的ESCC 患者HMGCS2 mRNA 和蛋白表达均下调,且与肿瘤细胞分化、病理分期、转移显著相关。HMGCS2 低表达的ESCC 患者5 年总生存率和无复发生存期明显低于其在正常组织中的表达(表2)。HMGCS2可抑制ESCC细胞的增殖、迁徙,其相关机制的研究可能为ESCC 治疗提供帮助。
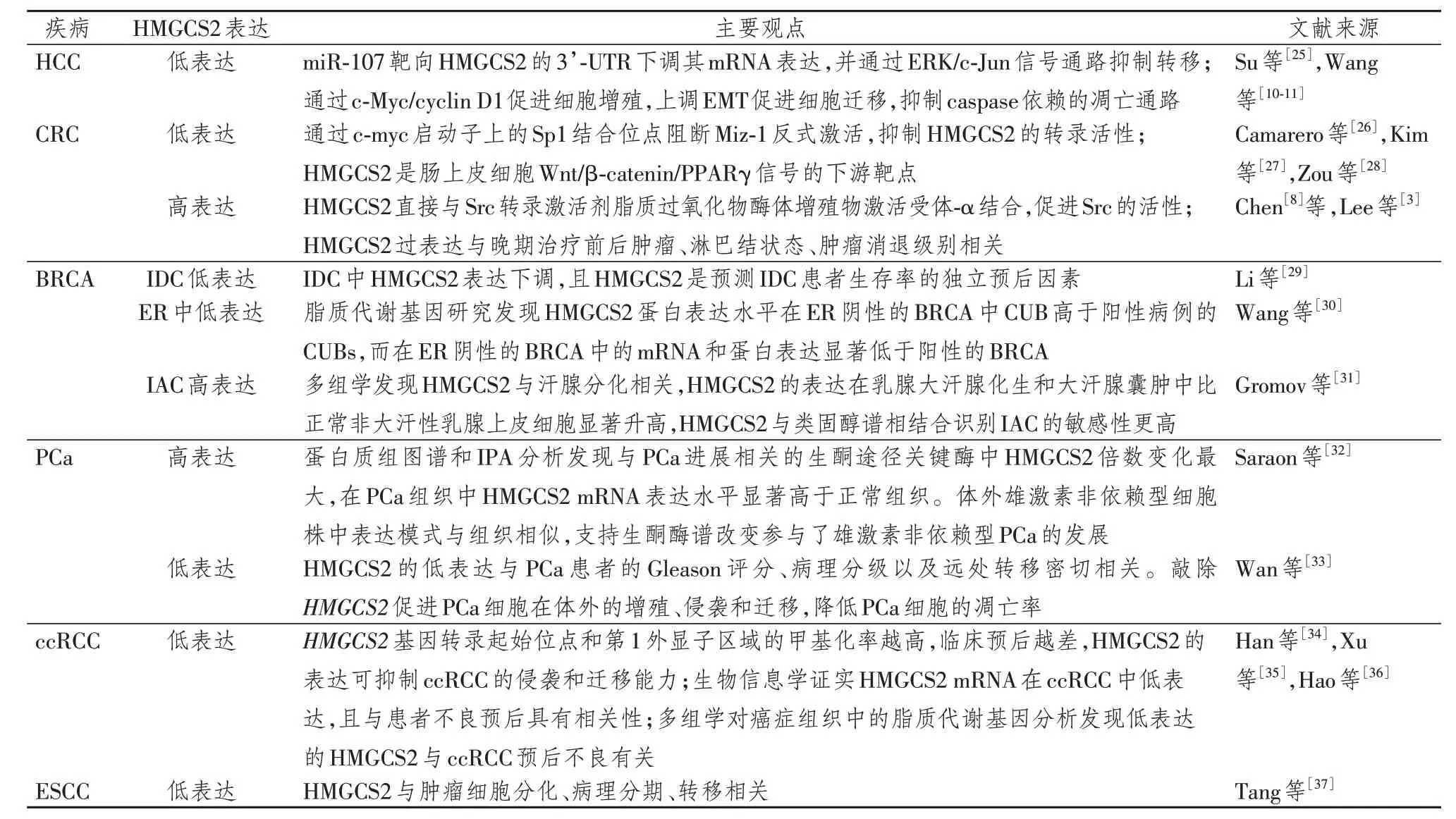
表2 HMGCS2在肿瘤性疾病中的研究
近几十年来,经过长期探索HMGCS2 在不同疾病不同阶段中的作用,初步了解HMGCS2的相关致病机制。HMGCS2 在多数肿瘤中低表达,与患者较差的总生存率相关,提示HMGCS2可作为肿瘤的诊断标志物及预后标志物,但对HMGCS2在不同疾病或同一疾病中截然相反的作用认识尚不足,因此仍需进一步探索HMGCS2的致病机制,为精准医疗制定个性化治疗策略提供更多的信息。
利益冲突所有作者均声明不存在利益冲突

