无导线起搏器在特殊人群中植入的研究进展
牟秦娇 张玥 王楠
(1.宁夏医科大学临床医学院,宁夏 银川 750000;2.苏州大学苏州医学院,江苏 苏州 215123;3.甘肃省人民医院心内科干部病区,甘肃 兰州 730000)
无导线起搏器(leadless pacemaker,LP)集脉冲发生器与起搏电极于一体,以“微型胶囊”形式经下肢股静脉直接植入右心室,以解决传统经静脉起搏器导线和囊袋相关的并发症[1]。目前临床多用的LP系统为MicraTM(美国美敦力公司)(图1),全球已累计超过10万例患者植入了LP[2]。现围绕心脏解剖结构异常、静脉通路异常、瓣膜相关性疾病、心脏移植术后、传统起搏器感染后、高龄患者、青少年患者这些特殊人群植入LP遇到的困难以及解决方案进行综述,为临床中特殊人群植入LP提供参考依据,提高其植入的成功性和安全性。

图1 MicraTM
1 心脏解剖结构异常
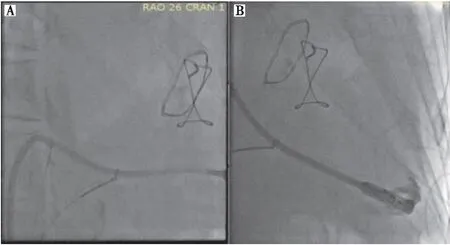
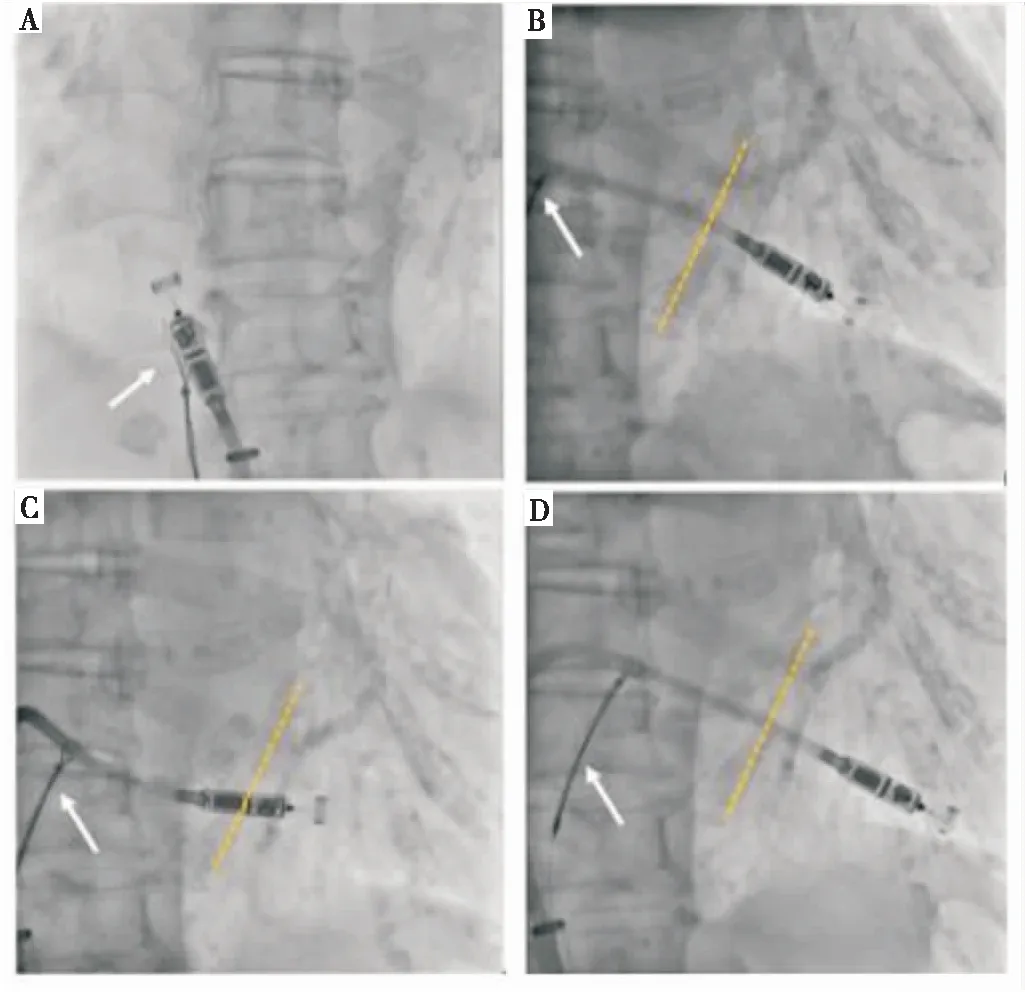
心脏解剖结构异常可导致起搏器植入程序复杂化,增加起搏器植入难度。右位心伴内脏反位是一种罕见的先天畸形,表现为腹部脏器和心脏及大血管的镜像改变,在进行心脏电生理介入治疗时必须特别注意,因为所有操作都会因其特殊解剖结构而完全相反。Wilson等[3]提出此类患者植入LP时,可以将输送导管在透视下经下肢股静脉导入,将其送至右心房-下腔静脉(inferior vena cava,IVC)交界处。为测定心脏方向,将一根“猪尾”导管跨过房室瓣进入形态左心室,并采用手推对比剂定位室间隔,以指导LP植入[4]。此外,也可以选择将心脏解剖结构在透视下转换到“镜像”模式,模拟正常心脏X射线影像[5](图2),然后再进行起搏器植入治疗,操作同常规植入诊疗,可以降低手术难度,加快手术进程,提高成功率。右心扩大患者植入LP时,由于右心房扩大,经食管超声心动图检查和心脏超声心动图均无法观察整个右心的解剖结构,并且起搏器不足以深入右心室,因此难以找到合适的植入位点[6]。对此,Huang等[7-9]提出为了扩大起搏器的可触及范围,可以通过圈套器-导管技术,将圈套器置于输送导管轴上,通过手动牵引圈套器并施加推力,校正输送导管的方向,并将LP导向右心室(图3~图6),帮助右心扩大患者成功并安全地植入LP。综上,对于心脏解剖结构异常患者,可以通过镜像透视、静脉造影、右心室造影和工具辅助等检查方式,对心脏进行精确的解剖学评估,这对于准确掌握心脏正确解剖结构并成功植入LP非常重要。

注:A,镜像右位心示意图;B,镜像右位心转换“镜像”模式模拟正常心脏,植入LP的示意图;C,镜像右位心患者在穿衣状态下的左前斜位胸片[3](黑色箭头表示形态左心室中的LP)。

注:A,LP植入之前,将圈套器部署到LP输送系统轴上;B,插入预装的输送鞘;C,圈套器的近端易于调整和牵引;D,圈套器与输送导管一起离开输送鞘。
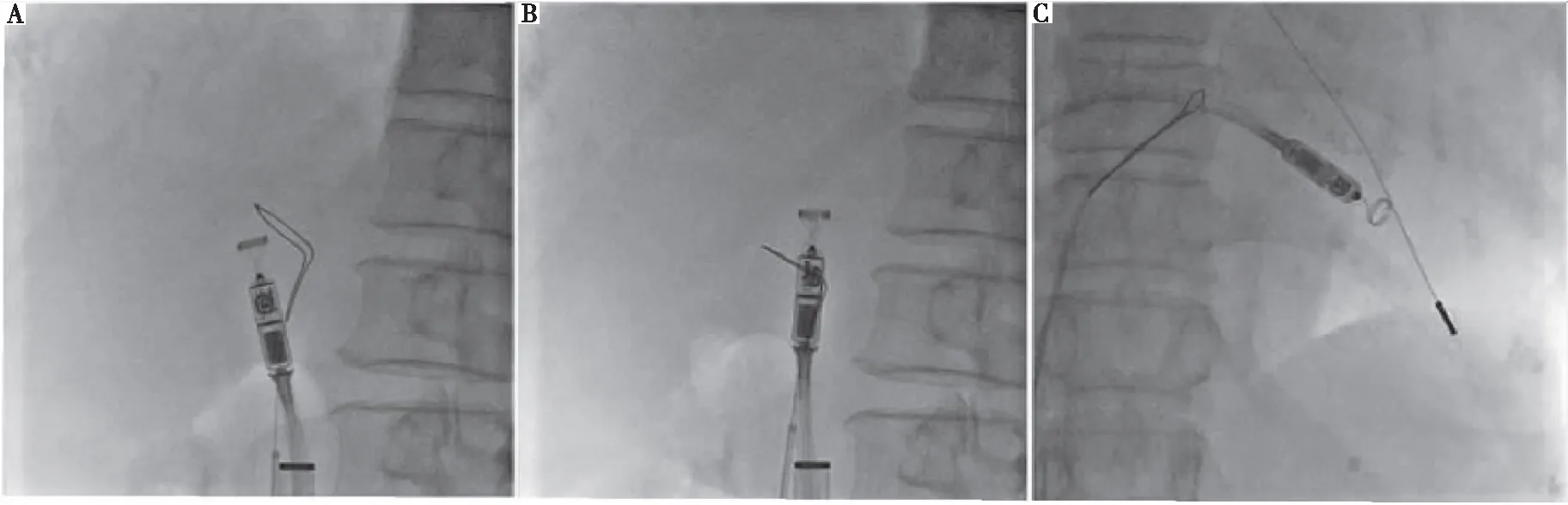
注:A和B,部署在IVC输送系统轴上的单环圈套器;C,连续牵引圈套器改变输送导管的形状,扩大起搏器可触及范围。
注:A,连续牵引圈套器,改变输送导管的形状,扩大起搏器可触及范围;B,起搏器植入右心室。
注:A,三环圈套器在IVC中夹住起搏器系统轴;B,连续牵引圈套器,将LP导向右心室;C,拉动圈套器使导管呈鹅颈状,导管远端部分被拉下;D,固定圈套器的同时植入起搏器。白色箭头表示圈套;橙色虚线表示三尖瓣。
2 静脉通路异常
LP直径相对较大,通常经股静脉入路,随鞘管被推至右心房-IVC交界处,然后将装置顺利推进右心室并轻松定位到室间隔部位植入[10],不受锁骨下静脉或上腔静脉阻塞的影响。若患者上腔静脉或无名静脉完全闭塞,可以选择植入LP。Afzal等[11]报道1例有复发性肺栓塞/深静脉血栓形成史的患者,其左侧存在用于血液透析的动静脉瘘,右侧行乳房切除术伴淋巴结清扫,鉴于此,该患者不适用传统起搏器治疗,应选用LP植入方案。此外,该患者还存在IVC过滤器(双侧髂外静脉非血栓性压迫),需要在术前透视观察通过该过滤器的通道,术中通过逐渐扩大鞘管直径以及球囊扩张过滤器,保证顺利将装有LP的传送鞘管推进右心室。术后随访影像显示LP及IVC过滤器未见异常,证实LP经IVC过滤器植入的可行性和安全性。需要长期血液透析的肾功能衰竭患者及长期化疗的恶性肿瘤患者,很可能导致传统起搏器所经上腔静脉或颈内静脉等路径受限[12-13],此类人群更适于植入LP。因此,当股静脉并非LP植入的可行路径时,可以考虑经锁骨下静脉或颈内静脉等其他静脉通路(图7)植入LP[14-16]。
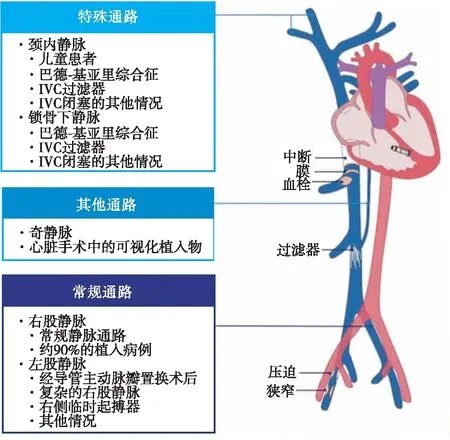
图7 MicraTM植入的可替代静脉通路[14]
3 瓣膜相关性疾病
瓣膜介入术后的急性手术创伤和术后心肌缺血可导致心脏传导障碍,其3%~6%患者需要起搏器治疗,而经皮/外科主动脉瓣或三尖瓣置换术后,这种发生率可增加到20%~27%[17]。鉴于此,瓣膜介入术后通常需要起搏器治疗,然而传统起搏器的导线会感染瓣膜影响闭合,在植入过程中严重损坏瓣膜和瓣膜下装置而加重反流,或因黏附或纤维化而造成瓣膜长期损坏[18-19]。此外,在机械瓣膜存在的情况下,右心室导线植入是绝对禁忌的[19]。因此,存在瓣膜相关性疾病的患者可以考虑选用LP治疗。在超声心动图引导下,LP输送系统可安全通过三尖瓣生物瓣膜或成形术环,并选择适当位置植入。LP不存在导线,可避免导线与瓣膜接触相关的并发症,可降低生物瓣膜医源性三尖瓣反流和导线引起的瓣膜相关心内膜炎的风险[20]。然而,Beurskens等[21]提出,43%的患者在LP植入术后三尖瓣反流更严重,认为LP对三尖瓣及瓣膜下装置的机械干扰是其主要原因。因此,熟练和仔细地处理输送系统以及正确使用X射线是LP成功跨过瓣膜的决定因素[19],应特别注意鞘管通过瓣膜环时的接触,以避免瓣膜功能障碍,以上对于成功植入LP非常重要。
4 心脏移植术后
据报道[22],4.5%~20.0%的心脏移植术后患者需植入心脏起搏器。然而,传统起搏器导线和囊袋所带来的相关并发症,不仅影响起搏器的正常工作,而且影响患者的生活质量,严重时可危害患者的生命健康。心脏移植术后的患者需终身服用免疫抑制剂,因此更容易发生感染,感染率约为15%[22]。相比传统起搏器,LP可降低感染风险,因此,在免疫功能低下(如心脏移植术后)的患者中植入LP尤为重要。此外,三尖瓣反流是心脏移植术后最常见的瓣膜病变,发生率为18%~84%[23],而传统起搏器和心内膜心肌活检都是医源性三尖瓣反流的常见原因[24]。因此,LP有助于减缓三尖瓣病变的进展,是心脏移植术后患者更安全的治疗手段。但相比传统起搏器,心脏移植术后患者植入LP可能更具有挑战。严重的右心扩大,使LP输送导管不足以深入右心室,无法找到合适的植入位点,再加上心脏移植术后部分心肌组织纤维化,使得LP的植入更有难度。当心脏移植术后患者植入LP时,多数患者需尝试≥3次才能获得满意的植入位置,而在90%的非心脏移植术后患者中尝试≤3次便可成功植入[22]。上述分析[22]表明,心脏移植术后患者植入LP可能更有挑战,但绝对可行。总之,心脏移植术后患者因高感染风险和低起搏依赖性,使得植入LP成为心脏移植术后患者的可行治疗方案。
5 传统起搏器感染后
随着起搏器植入数量的不断增加,起搏器的感染率逐年增长,感染发生率为1.0%~3.4%,需要移除感染设备的需求也急剧增长。传统起搏器由于存在经静脉导线,通常会引起导线相关的并发症[25],而LP治疗可以通过消除跨瓣膜导线的存在而避免导线相关的不良后果。因此,当移除感染设备选择再次植入起搏器时,可以优先选择植入LP。目前指南[26]提出,在已证实或疑似起搏器感染的情况下,需彻底移除整个起搏装置,并在充分抗感染治疗后,再植入一个新的起搏器。但是,关于移除后再植的最佳间隔时间目前尚未明确。此外,起搏器依赖患者在感染起搏器移除后需临时起搏器支持,但临时起搏器会增加植入感染风险使治疗复杂化。有研究[26]表明,在移除已感染的起搏器之前,可先植入LP,将LP作为感染起搏器移除的桥梁,以消除起搏器依赖患者临时起搏的需求,待LP植入后再移除已感染的起搏器,该结论对于活动性感染患者也是可行的。但Zhang等[27]指出,有全身感染症状的患者,只有当已感染的起搏器完全移除并控制炎症后,才能植入新的起搏器。因此,当不确定是否有全身感染时,最佳策略是移除已感染的起搏器并控制住炎症后,再择期植入LP[28]。
6 高龄患者
高龄患者通常多器官功能不全、合并症较多、体质虚弱、长期服用抗凝或抗血小板药物[29],是手术高风险以及出血高危人群。多数高龄患者因谵妄风险较高而选择植入LP,可以获得稳定的起搏频率和起搏阈值,并且短期随访无任何并发症。阿尔茨海默病患者以及阿尔茨海默病治疗药物会使高龄患者在传统起搏器植入的围手术期谵妄风险增高,使患者无法耐受长时间平卧手术。与传统起搏器相比,植入LP可以获得更短的手术时间以及更短的住院天数[30],并且不需要术后对伤口长期护理或过多身体限制。LP操作简单,植入成功率高,术者易于掌握,手术时间短,创伤更小,术后恢复更快,避免了传统起搏器导线和囊袋相关的并发症,并且核磁共振检查也不影响起搏参数[31],对于高龄患者损伤更小。LP的应用安全且有效,对有谵妄风险的高龄患者有一定益处,是一种有价值的治疗策略。
7 青少年患者
青少年患者因体型较小,而且有持续生长、高活动水平的特点,导致传统起搏器相关并发症发生率较高[32]。LP体积较小,没有导线和囊袋结构,不影响患者活动,避免了手术瘢痕对患者的心理影响,保留了患者上肢静脉通路,还规避了因发育需要预留导线长度的问题[33-34],可作为青少年患者的有效治疗方式。Gallotti等[35]报道1例8岁(18 kg)患者,考虑到患者的血管尺寸以及更容易操作的目的,体型较小的患者可能更倾向于经颈内静脉植入LP,较短的输送系统使LP植入的操作和定位更容易[36],但由于患者颈内静脉与右心室的相对直角关系,使得经颈内静脉所看到的植入过程没有经股静脉看到的清楚,因此,患者可选择经股静脉植入LP。Breatnach等[37]提出经股静脉成功植入LP的患者,往往年龄稍大,体型较大。对于考虑植入LP的青少年患者,建议术前对其股静脉和颈内静脉进行血管检查,以确定血管尺寸及其扩张能力,用于规划起搏器植入路径[38]。目前,植入LP的年龄和心室大小的下限尚未明确,因此,LP可能不是较小年龄或体型的患者起搏器植入的最佳选择。值得注意的是,在青少年患者的生命周期内可能使用多个设备,需要考虑LP未来的移除问题。有一种策略是对旧设备进行非功能模式编程后,放弃它,并在附近植入一个新的LP,确保两个设备在心脏收缩期间不会接触[39]。然而,目前还没有研究证实新旧LP之间没有长期的电干扰,也没有证据表明心脏中有多个LP不会损害心脏功能。因此,可以选择在同一手术过程中,先植入新的LP,再尝试回收旧设备,目前已证明这种方法是可行且安全的[39]。
8 总结
LP避免了传统起搏器导线和囊袋相关的并发症,如导线脱位、断裂、囊袋血肿、感染;减少了植入传统起搏器时穿刺静脉带来的相关并发症,如血胸、气胸;规避了传统起搏器的电极导线对三尖瓣活动及功能的影响。虽然特殊人群植入LP具有一定挑战,但不能成为LP植入的禁忌证。LP的优势在于更适合部分特定人群,如传统起搏器植入路径异常、反复起搏系统感染及感染性心内膜炎、终末期肾病及血液透析、其他临床情况或合并疾病导致植入传统起搏器特别困难或极易发生并发症的患者。然而,对于正在服用抗凝或抗血小板药物等有出血倾向、存在伤口难以愈合、已发生囊袋感染、潜在囊袋感染、瘢痕体质以及不能接受较长时间平卧手术的患者,可以考虑植入LP。LP作为一种新兴的治疗方案,植入病例还很有限,仍需进一步的研究应用。