隐丹参酮治疗小鼠非酒精性脂肪性肝病效果及机制研究
赵梦溪,罗 斌,吕建瑞,王 宁
(西安交通大学第二附属医院,陕西 西安 710004)
非酒精性脂肪性肝病(Nonalcoholic fatty liver disease,NAFLD)是临床中较为常见的代谢综合征。近年来,NAFLD的发生率逐渐升高,已经成为人们亚健康状态的疾病之一[1]。“二次打击”或“多次打击”是NAFLD目前公认的核心发生机制,其本质与肝脏脂质代谢异常密切相关。在脂质代谢过程中,脂肪酸α-氧化和β-氧化研究最为广泛。脂肪酸α-氧化主要涉及肝脏脂肪酸的合成,脂肪酸β-氧化主要涉及肝脏脂质的分解代谢[2-3]。隐丹参酮是一种从丹参酮中获得的有效药理成分单体,具有优秀的抗炎、抗菌及降温能力[4]。目前,隐丹参酮已经应用于冠心病及肝炎的治疗中[5-7],但还没有其用于治疗NAFLD的相关研究。因此,本研究探讨不同剂量隐丹参酮对NAFLD的治疗效果及其作用机制。
1 材料与方法
1.1 实验动物 选取SPF级雄性C57BL/6小鼠60只,均为6 周龄,体重18~22 g,购自西安交通大学医学部动物实验中心,生产许可证号:SCXK(陕)2020-001。饲养环境由中央空调统一控制,温度为22~24 ℃,湿度40%~60%,光照/黑暗为12 h/12 h,自由进食和饮水,适应性喂养1周。本研究获本院实验动物伦理委员会授权。
1.2 主要药物与试剂 隐丹参酮(质量分数98%,货号:35825-57-1,上海同田生物技术有限公司);10%的低脂饲料和45%的高脂饲料(江苏美迪森生物医药公司);谷草转氨酶(AST)、谷丙转氨酶(ALT)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、超氧化物歧化酶(SOD)、丙二醛(MDA)和谷胱甘肽(GSH)检测试剂盒(货号:C010-2-1、C009-2-1、A111-1-1、A110-1-1、A112-1-1、A113-1-1、A001-3-2、A003-1-2、A006-1-1,南京建成生物工程研究所);肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)和IL-6 ELISA检测试剂盒(货号:CSB-E04741m、CSB-E08054m、CSB-E04639m,武汉华美生物科技有限公司);BCA蛋白定量分析试剂盒(货号:G2026-1000T,武汉赛维尔生物工程有限公司);ECL发光液(货号:34578,赛默飞世尔科技中国公司);过氧化物酶体增殖物激活受体α(PPARα)、过氧化物酶酰基辅酶A氧化酶1抗体(ACOX1)(货号:sc-13551、sc-398394,美国Santa Cruz Bicycles公司);肉碱棕榈酰转移酶1(CPT1)一抗(货号:ab189182,美国ABCAM公司);辣根过氧化物酶(HRP)标记的二抗 (货号:BA1066,武汉博士德生物工程有限公司)。
1.3 主要仪器与设备 精密电子天平(型号:WT20003型,常州万泰天平仪器有限公司);化学发光成像系统(型号:ChemiDoc XRS+型,美国Bio-Rad Laboratories公司);酶标仪(型号:BIO-DL K3 Plus型,上海素秋仪器设备有限公司);低温高速离心机(型号:MULTIFUGF X1R型,德国Heraeus公司);超低温冰箱(型号:MDF-U53V型,日本三洋公司);组织石蜡包埋机(型号:ES500型,美国Them Fisher Scietific公司);冰冻组织切片机(型号:CM 1860型,德国Leica公司);石蜡切片机(型号:HM 325型,美国Them Fisher Scietific公司);实验室荧光显微镜(型号:FCK-40C型,上海蔡康光学仪器厂);常规垂直电泳仪(型号:Mini-PROTEAN型,美国Bio-Rad公司)。
1.4 实验方法
1.4.1 动物分组与给药:将60只小鼠根据随机数字法分为两组,其中正常组12只(普通饲料喂养),造模组48只(高脂高糖饲料喂养)。8周后,正常组随机处死2只,造模组随机处死8只检验造模是否成功(本研究NAFLD模型均构建成功)。造模成功后,随机将造模组小鼠分为模型组和隐丹参酮低、中和高剂量组,每组10只。正常组和模型组给予1 ml/(kg·d) 0.9%氯化钠溶液腹腔注射,隐丹参酮低、中和高剂量组分别给予7.5、15、30 mg/(kg·d)隐丹参酮腹腔注射,4周后进行后续实验。
1.4.2 实验样本采集:4周后,所有实验小鼠禁食不禁水12 h,于次日腹腔注射1%戊巴比妥钠12 ml/kg进行麻醉,麻醉后固定于解剖板,暴露腹腔,找到腹主动脉后用5 ml注射器采集小鼠血液。采用低温高速离心机离心血液(3000 r/min离心10 min)并收集血清,保存至超低温冰箱中用于后续检测。此外,收集血液后,快速分离小鼠肝脏组织,将其表面血液处理干净后用于后续HE染色、油红O染色、相应生化指标检测及相关蛋白表达检测。
1.4.3 小鼠一般情况记录:在喂养周期内,每日观察记录小鼠的日常活动、毛发特点以及饮食变化量。同时每周称重小鼠1次,同时进行相应的药物计算,以确定每周的给药量。
1.4.4 血清AST和ALT检测:将血清严格按照试剂盒说明书进行检测,得到吸光度值后计算AST和ALT含量。
1.4.5 肝脏组织生化指标检测:称取100 mg肝脏组织,用组织提取液提取并收集上清液,定量并调平后使用相应的试剂盒检测TG、TC、HDL-C、LDL-C、SOD、MDA、GSH、TNF-α、IL-1β和IL-6。
1.4.6 肝脏组织病理学染色:①将肝脏组织固定24~72 h后取出并清洗,用梯度乙醇浸润并脱水,二甲苯溶液处理后采用石蜡包埋法制作石蜡块,并切成3~5 mm薄片。将切片脱蜡处理后进行HE染色,采用光学显微镜收集图像,每张切片选取4个不同视野。②将肝脏组织用包埋剂包埋后连续切成厚度为10 μm的薄片,用组织固定液固定10 min后用超纯水洗涤,油红O染色封片后收集图像,每张切片选取4个不同视野。
1.4.7 肝脏组织蛋白表达水平检测:称取100 mg肝脏,用组织裂解液裂解后提取上清液,测定蛋白浓度并调平。每组取50 μg进行SDS-PAGE凝胶电泳,电泳条件:80 V恒压电泳30 min;120 V恒压电泳60 min。电泳结束后,将目的蛋白用半干转移法转移到PVDF膜,选用5%脱脂牛奶进行封闭,一抗过夜孵育、二抗孵育,ECL发光液反应后用凝胶成像仪成像。计算CPT1、ACOX1以及PPARα蛋白的表达水平。
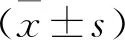
2 结 果
2.1 各组小鼠一般情况 正常组小鼠毛色光滑且有光泽,精神活跃。模型组小鼠毛色枯糙暗淡,体重前期增加快,后期增加慢,活动明显减少,且垫料在后期明显潮湿发臭。与模型组比较,隐丹参酮低、中和高剂量组小鼠一般情况均有好转。
2.2 各组小鼠肝脏组织染色结果 见图1。HE染色结果显示:正常组肝脏组织可见完整的小叶结构和均匀分布的肝细胞,肝细胞核多数位于细胞中央,偶尔出现空泡;模型组肝脏组织可见大量脂肪空泡;与模型组比较,隐丹参酮低、中和高剂量组肝脏组织病变有不同程度好转。油红O染色结果显示:正常组肝脏组织几乎未见脂滴;模型组肝脏组织出现大量脂滴且呈弥漫性分布;与模型组比较,隐丹参酮低、中和高剂量组脂滴数量均有不同程度降低。

图1 各组肝脏组织病理学HE、油红O染色结果(×400)
2.3 各组小鼠血清AST和ALT水平比较 见表1。与正常组比较,模型组小鼠AST和ALT水平升高(均P<0.05)。与模型组比较,隐丹参酮低、中和高剂量组AST和ALT水平降低(均P<0.05)。

表1 各组小鼠血清AST和ALT水平比较(U/L)
2.4 各组小鼠肝脏组织脂代谢指标比较 见表2。与正常组比较,模型组LDL-C、TG和TC水平升高,HDL-C水平降低(均P<0.05)。与模型组比较,隐丹参酮低、中和高剂量组LDL-C、TG和TC水平降低,HDL-C水平增加(均P<0.05)。

表2 各组小鼠肝脏组织脂代谢指标比较(mmol/L)
2.5 各组小鼠肝脏组织氧化应激指标比较 见表3。与正常组比较,模型组SOD和GSH水平降低,MDA水平升高(均P<0.05)。与模型组比较,隐丹参酮低、中和高剂量组SOD和GSH水平升高,MDA水平降低(均P<0.05)。

表3 各组小鼠肝脏组织氧化应激相关指标比较
2.6 各组小鼠肝脏组织炎性指标比较 见表4。与正常组比较,模型组TNF-α、IL-1β和IL-6水平升高(均P<0.05)。与模型组比较,隐丹参酮低、中和高剂量组TNF-α、IL-1β和IL-6水平下降(均P<0.05)。

表4 各组小鼠肝脏组织炎性指标比较(ng/L)
2.7 各组小鼠肝脏组织脂肪酸β-氧化调节酶表达水平比较 见表5。与正常组比较,模型组肝脏组织中PPARα、CPT1和ACOX1表达水平降低(均P<0.05)。与模型组比较,隐丹参酮低、中和高剂量组肝脏组织中PPARα、CPT1和ACOX1表达水平升高(均P<0.05)。

表5 各组小鼠肝脏组织脂肪酸β-氧化调节酶表达水平比较
3 讨 论
NAFLD的发生是一个复杂的过程,“二次打击”和(或)“多次打击”学说能够较为全面地阐述本病的发生和发展,是目前国内外相关学者接受度较高的机制学说。两种学说几乎都离不开NAFLD发生的本质,即肝脏的脂肪变性以及脂肪细胞在肝脏中过量蓄积[8-9]。肝脏脂质的蓄积是NAFLD发展的第一步。相关研究[10]表明,在NAFLD中,肝脏脂质蓄积的主要原因为脂肪生成增加(即脂肪酸α-氧化)和肝脏中脂肪酸β-氧化减少。脂质长期蓄积可引起肝脏脂质和相关碳水化合物的异常,长期存在可引起肝细胞炎症反应和氧化应激的发生,进而加重NAFLD,导致肝纤维化甚至肝硬化的发生[11-13]。因此,目前国内外学者对NAFLD治疗的研究重心转到减少脂质合成或促进脂肪分解代谢两个方面[14-15]。本实验重点研究增强脂肪酸β-氧化方面。
研究[16]表明,中药天然化合物可能能够作为脂肪酸β-氧化的靶点。例如,田香[17]分别构建了NAFLD的细胞和动物模型,观察梓醇对NAFLD脂肪酸β-氧化信号通路的影响,发现梓醇能够明显调节脂肪酸β-氧化信号通路蛋白ACC、PPARα、CPT1和ACOX1等的表达,进而调节肝细胞脂质代谢,减轻肝脏负担,预防脂肪肝。此外,廖文云等[18]构建了NAFLD小鼠模型,发现人参皂苷Rg1对脂肪酸β-氧化信号相关蛋白具有明显的调节作用。
隐丹参酮是中药丹参的主要成分。由于隐丹参酮在丹参中含量较低,所以目前缺少将其用于治疗NAFLD的研究。然而,有较多研究报道[19-21]其中药植株及中药提取物对NAFLD有治疗作用。本研究中,肝脏组织HE染色结果显示模型组肝脏组织可见明显的脂肪空泡。与正常组比较,模型组血清AST和ALT水平升高,肝脏组织LDL-C、TG和TC水平升高,HDL-C水平降低。而给予隐丹参酮治疗后,肝脏组织染色提示,脂肪空泡明显变小且数量减少,脂肪浸润均有不同程度降低。与模型组比较,血清AST和ALT水平降低,肝脏组织LDL-C、TG和TC水平降低,HDL-C水平升高,证明了隐丹参酮对NAFLD有治疗作用。
在脂肪酸β-氧化过程中,PPARα、CPT1和ACOX1是其中的三个核心蛋白酶。PPARα是机体内重要的转录因子,可以控制脂肪酸氧化酶ACOX1基因表达,通过激活ACOX1的表达促进脂肪酸的分解,而在此过程中脂肪酸β-氧化的关键调节酶和限速酶能够平衡脂肪酸β-氧化,维持β-氧化的稳态[22]。本研究结果发现,与正常组比较,模型组小鼠PPARα、CPT1和ACOX1蛋白表达水平降低,证实NAFLD存在脂肪酸分解异常。采用隐丹参酮治疗后,肝脏组织中PPARα、CPT1和ACOX1蛋白表达水平较模型组升高,表明隐丹参酮能够促进肝脏脂肪酸β-氧化,进而改善脂肪颗粒在肝脏中蓄积。
为准确地评估隐丹参酮对NAFLD的治疗作用,本研究也观察了隐丹参酮对炎症反应和氧化应激相关因子的变化特点。观察这两类指标,主要是因为在NAFLD发生和发展过程中炎症反应和氧化应激参与了“二次打击”或“多次打击”的过程,是NAFLD进展的关键指标[23]。本研究发现,模型组小鼠TNF-α、IL-1和IL-6水平显著高于正常组,而氧化应激相关指标中MDA水平较正常组升高,抗氧化应激指标SOD和GSH水平降低。采用隐丹参酮治疗后,TNF-α、IL-1、IL-6以及MDA水平较模型组降低,而SOD和GSH水平升高,提示隐丹参酮能改善NAFLD的炎症反应,也能平衡氧化应激,进而保护肝脏。
综上所述,隐丹参酮对NAFLD具有治疗作用,能够改善脂质代谢,促进肝脏脂质排出,改善肝功能和减少肝脏脂质沉积,其机制可能与调节脂肪酸β-氧化、减轻炎症反应及平衡氧化应激有关,但具体机制仍需后续进一步实验研究。

