长链非编码RNA YAF2-AS1通过调控微小RNA-141-3p表达抑制肝星状细胞活化实验研究
刘 俊,曾 龙,高 云,敖会芳,林 勇,魏雪源
(1.荆门市人民医院 荆楚理工学院附属中心医院感染性疾病科,湖北 荆门 448000;2.荆门市人民医院 荆楚理工学院附属中心医院血液内科,湖北 荆门 448000;3.上海长征医院消化内科,上海 200003)
肝纤维化是以肝组织结构改变以及肝功能损伤为特征的一类疾病,其发生率在近几十年中快速增长[1]。肝纤维化的发生与病毒感染、肥胖、药物、糖尿病以及酗酒等因素相关,是肝硬化和肝癌发生的重要原因[2]。大量研究[3-4]证实,肝纤维化发生的关键环节是肝星状细胞活化。长链非编码RNA(Long non-coding RNA,lncRNA)是内源性长链RNA,属于单链RNA家族,通过转录水平修饰调控基因的表达,参与各种疾病的发生和发展[5-6]。研究[7-8]报道,lncRNA与肝星状细胞的活化和凋亡有关,是肝纤维化诊断、分型、治疗和预后监测的靶点。YAF2-AS1是由396个核苷酸组成的lncRNA,其编码基因位于人染色体12q12区域,含有3个外显子。目前关于YAF2-AS1在肝纤维化中的作用和机制鲜有报道。本研究探讨YAF2-AS1在肝纤维化组织中的表达水平,观察YAF2-AS1对肝星状细胞活化的作用及机制,为YAF2-AS1/micro-RNA-141-3p(miR-141-3p)在肝纤维化诊疗和预后评估中的应用提供一定的实验基础。
1 材料与方法
1.1 实验细胞与主要试剂 人肝星状细胞株LX-2购自中科院上海细胞库。DMEM培养基和胎牛血清(批号:12491015、A4766801)购自美国Thermo Fisher公司;CCK-8实验试剂盒、细胞周期试剂盒、活性氧(ROS)检测试剂盒(批号:C0039、C1052、S0033M)购自上海碧云天生物有限公司;miR-141-3p、mimic NC、YAF2-AS1质粒以及阴性对照质粒(批号:L4535、L3050、H189、H238)购自上海集奇生物科技有限公司;Lipofectamine 3000、实时荧光定量聚合酶链反应(qRT-PCR)试剂盒(批号:L3000008、12361010)购自美国Invitrogen公司;荧光素酶野生型质粒pMIR-YAF2-AS1 WT、突变型质粒pMIR-YAF2-AS1 MUT(批号:GF22111-5191、GF22111-5192)购自上海歌凡生物科技有限公司;双荧光素酶活性试剂盒(批号:150327)购自美国Millipore公司;兔抗人磷酸酶及张力蛋白同源物(PTEN)、兔抗人磷酸化蛋白激酶B(p-AKT)、兔抗人α平滑肌肌动蛋白(α-SMA)、兔抗人Ⅰ型胶原蛋白(Collagen Ⅰ)、兔抗人转化生长因子β受体Ⅱ(TGFβR2)、兔抗人β微管蛋白(β-Tubulin)抗体(批号:ab267787、ab8805、ab5831、ab138492、ab184948、ab18207)购自英国Abcam公司。
1.2 实验方法
1.2.1 生物信息学分析:采用基因表达数据库(GEO)分析YAF2-AS1在肝纤维化组织和正常肝组织中的表达。使用lncRMap软件预测YAF2-AS1的靶向基因。
1.2.2 细胞培养与质粒转染:配制含12%胎牛血清的DMEM培养基,在37 ℃、5% CO2环境中培养LX-2细胞。转染前16 h,取对数生长期的LX-2细胞接种于12孔板,每孔2 ml。通过Lipofectamine 3000试剂将阴性对照质粒(对照组)和YAF2-AS1质粒(YAF2-AS1组)转染至LX-2细胞,转染浓度为70 nmol/L,转染7 h后更换培养基。
1.2.3 qRT-PCR检测YAF2-AS1和miR-141-3p表达:提取各组LX-2细胞总RNA,通过核酸检测仪分析RNA浓度,反转录合成cDNA。设置qRT-PCR参数:96 ℃ 6 min;96 ℃ 16 s,56 ℃ 26 s,64 ℃ 26 s,共39个循环。采集各循环的荧光信号,分析熔解曲线。以U6和GAPDH为内参,引物序列见表1。以2-ΔΔCt法分析YAF2-AS1和miR-141-3p表达。

表1 各基因引物序列
1.2.4 CCK-8法检测LX-2细胞增殖:收集各组LX-2细胞,以1500个/孔接种于96孔板,在37 ℃、5% CO2环境中分别培养1、2、3、4、5 d。配制体积分数为10%的CCK-8试剂,在每天恒定时间点于每孔加入25 μl CCK-8试剂,在37 ℃、5% CO2环境中培养3 h,通过酶标仪分析各孔LX-2细胞在波长450 nm处的光密度值。
1.2.5 流式细胞术检测LX-2细胞周期:采用胰蛋白酶(不含EDTA)消化收集各组LX-2细胞,用3 ml 80%乙醇固定。12 h后,离心弃上清。磷酸缓冲盐溶液清洗2次,加入RNA酶重悬,在37 ℃环境培养40 min。110 μl碘化丙啶溶液染色20 min。筛网过滤到流式细胞管,流式细胞仪检测各组LX-2细胞周期。
1.2.6 流式细胞术检测LX-2细胞ROS水平:采用无血清培养基稀释二氯荧光素二乙酸酯(DCFH-DA),稀释比例为800∶1。收集各组LX-2细胞,重悬于DCFH-DA溶液中,在37 ℃、5% CO2环境中培养20 min,每隔4 min颠倒混匀,保证探针与LX-2细胞充分接触。使用不含血清的培养基清洗LX-2细胞4次,过滤到流式细胞管,流式细胞仪检测ROS水平。
1.2.7 双荧光素酶活性实验检测YAF2-AS1和miR-141-3p的靶向结合:将对数生长期的LX-2细胞接种于24孔板,设置mimi NC/pMIR-YAF2-AS1 WT组、miR-141-3p/pMIR-YAF2-AS1 WT组、mimi NC/pMIR-YAF2-AS1 MUT组、miR-141-3p/pMIR-YAF2-AS1 MUT组,通过Lipofectamine 3000将质粒和miRNA转染至LX-2细胞。在37 ℃、5% CO2环境中培养30 h,根据双荧光素酶活性试剂盒分析各组LX-2细胞的荧光素酶活性。
1.2.8 Western blot检测PTEN/AKT信号通路蛋白和肝纤维化标志物表达:各组LX-2细胞中加入RIPA裂解液,超声裂解7次,冰上孵育15 min,高速离心取上清,与上样缓冲液摇床混匀,煮沸9 min。用8% SDS-PAGE胶分离各组LX-2细胞总蛋白,转膜蛋白到聚偏二氯乙烯膜。用6%(质量分数)牛血清白蛋白溶液室温封闭50 min。加入兔抗人PTEN(1∶2000稀释)、兔抗人p-AKT(1∶1000稀释)、兔抗人α-SMA(1∶3000稀释)、兔抗人Collagen I(1∶2000稀释)、兔抗人TGFβR2(1∶3000稀释)、兔抗人β-Tubulin(1∶3000稀释,内参),孵育15 h。洗膜后,加入羊抗兔二抗(1∶6000稀释)孵育3 h。洗膜后,在化学发光成像仪中曝光和成像。
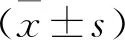
2 结 果
2.1 生物信息学分析结果 GEO数据库显示,与正常肝组织比较,肝纤维化组织中YAF2-AS1表达水平降低(P<0.01)。
2.2 两组LX-2细胞YAF2-AS1表达量比较 qRT-PCR结果显示,YAF2-AS1组LX-2细胞YAF2-AS1表达量高于对照组(9.98±1.45与1.02±0.40,P<0.01)。
2.3 过表达YAF2-AS1对LX-2细胞增殖的影响 见图1。CCK-8实验结果显示,与对照组比较,YAF2-AS1组LX-2细胞从第2 天开始增殖受到抑制(均P<0.05)。
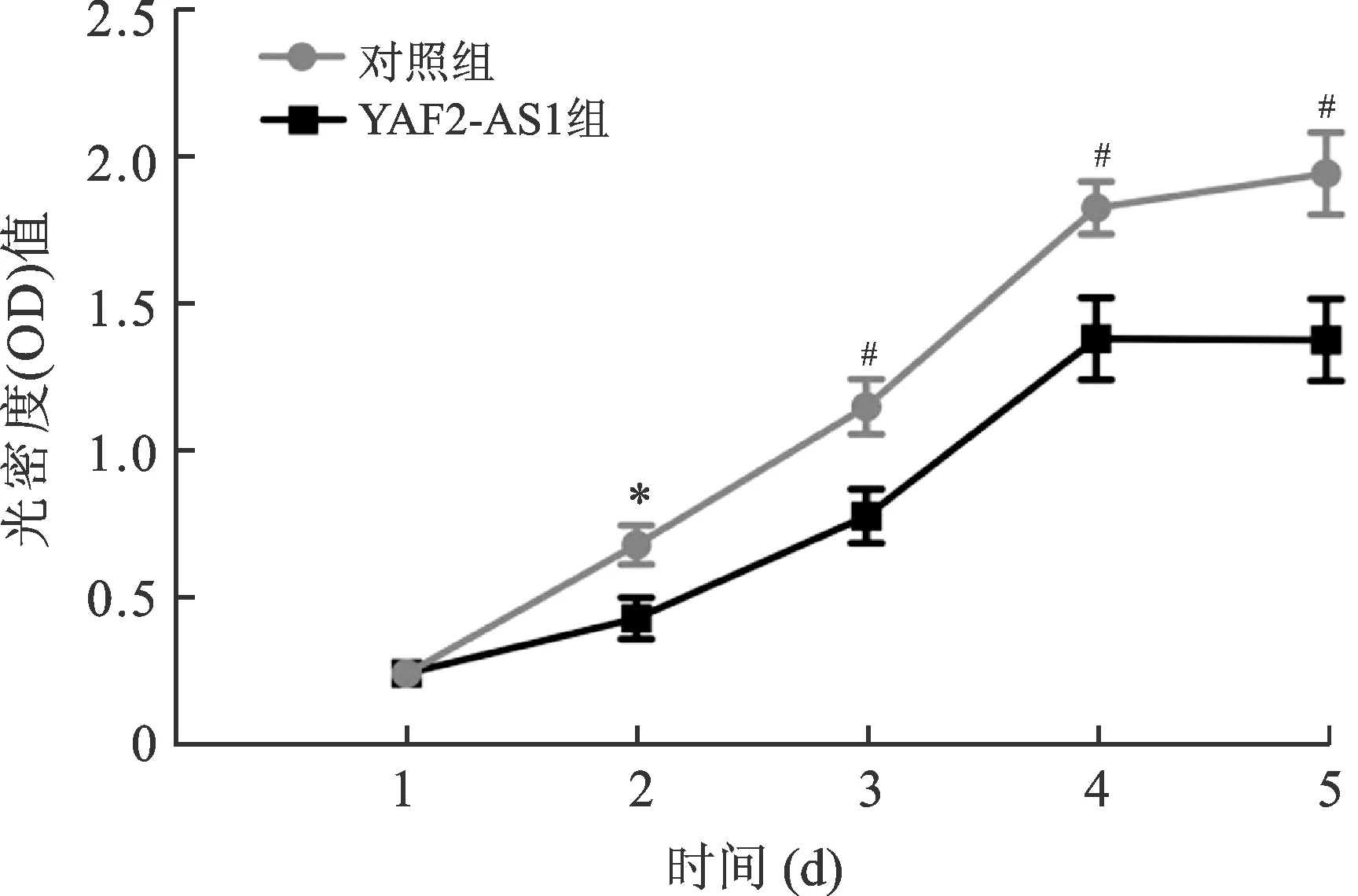
注:与对照组比较,*P<0.05,#P<0.01
2.4 过表达YAF2-AS1对LX-2细胞周期的影响 见图2。流式细胞仪检测结果显示,与对照组比较,YAF2-AS1组在G0/G1期细胞比例升高,S期和G2/M期细胞比例降低(均P<0.05)。

注:与对照组比较,*P<0.05,#P<0.01
2.5 过表达YAF2-AS1对LX-2细胞ROS含量的影响 见图3。流式细胞仪检测结果显示,与对照组比较,YAF2-AS1组LX-2细胞ROS含量升高(P<0.01)。

注:与对照组比较,#P<0.01
2.6 YAF2-AS1对miR-141-3p的靶向调控作用 见图4、5。lncRMap软件分析结果显示,YAF2-AS1与miR-141-3p存在结合位点,YAF2-AS1和miR-141-3p可能靶向结合。双荧光素酶活性实验显示,与mimic NC比较,miR-141-3p共转染pMIR-YAF2-AS1 WT质粒后的荧光素酶活性降低(P<0.01),miR-141-3p共转染pMIR-YAF2-AS1 MUT质粒后的荧光素酶活性无明显改变(P>0.05)。

图4 YAF2-AS1与miR-141-3p结合位点

注:与mimic NC比较,#P<0.01
2.7 过表达YAF2-AS1对miR-141-3p表达的影响 qRT-PCR结果显示,YAF2-AS1组miR-141-3p表达水平低于对照组(0.99±0.36与6.38±0.52,P<0.01)。
2.8 过表达YAF2-AS1对PTEN/AKT信号通路蛋白和肝纤维化标志物表达的影响 见图6。Western blot实验结果显示,与对照组比较,过表达YAF2-AS1后PTEN蛋白表达升高,p-AKT蛋白及肝纤维化标志物α-SMA、Collagen Ⅰ和TGFβR2表达降低(均P<0.05)。

图6 PTEN/AKT信号通路蛋白和肝纤维化标志物蛋白电泳图
3 讨 论
肝星状细胞在各种慢性肝损伤的刺激下活化并分泌胶原,促进肝组织纤维化[9]。有效阻断肝星状细胞的活化,减少胶原的分泌和沉积,可能是抑制肝组织发生纤维化的重要途径[10]。lncRNA在非酒精性脂肪性肝病、肝癌、急慢性肝炎等肝脏疾病的病理过程中发挥重要作用[11-13]。越来越多的研究[14-16]证实,lncRNA可能与肝星状细胞的活化密切相关。例如,肝脏组织lncRNA H19表达水平与肝纤维化的严重程度密切相关,沉默lncRNA H19能够有效抑制肝星状细胞的活性,减少成纤维细胞的增殖和基质形成,预防肝纤维化[17]。lncRNA SNHG7在肝纤维化组织和肝星状细胞中明显升高,靶向抑制lncRNA SNHG7可以减轻动物模型的肝纤维化,miR-29b是lncRNA SNHG7的靶基因[18]。目前,YAF2-AS1在肝纤维化发生中的作用并不清楚。
本研究显示,肝纤维化组织中YAF2-AS1的表达水平明显低于正常肝组织,说明YAF2-AS1可能参与调控肝纤维化。进一步研究发现,转染YAF2-AS1质粒后肝星状细胞LX-2的增殖能力明显降低,LX-2细胞周期被抑制在G0/G1期,同时LX-2细胞内的ROS水平升高,提示YAF2-AS1能够显著抑制肝星状细胞LX-2的活化。且YAF2-AS1质粒转染LX-2细胞后,肝纤维化标志物α-SMA、Collagen Ⅰ、TGFβR2表达均降低,表明YAF2-AS1对肝纤维化有抑制作用。后基因组学研究[19-21]显示,lncRNA充当竞争性内源RNA,靶向结合miRNA的反应元件,调控细胞的病理生理过程。本研究采用生物信息学软件lncRMap分析YAF2-AS1的靶向基因,结果表明miR-141-3p与YAF2-AS1存在互补的结合位点。双荧光素酶活性实验证实YAF2-AS1可结合miR-141-3p。
近年来,miR-141-3p被证实在多种肿瘤如视网膜母细胞瘤、肾透明细胞癌以及鼻咽癌中异常表达,是诊断肿瘤的分子标志物,且miR-141-3p在调控肿瘤细胞侵袭、代谢、增殖和迁移等活动中发挥重要调控作用[22-24]。研究[25]发现,miR-141-3p能够有效促进肝星状细胞的增殖能力,诱导细胞周期的进展,降低细胞的凋亡水平,同时升高细胞的促纤维化蛋白,显著促进肝星状细胞的活化。本研究发现,转染YAF2-AS1质粒后肝星状细胞LX-2中miR-141-3p表达下调,证实YAF2-AS1能够抑制miR-141-3p表达。有研究[25]显示,miR-141-3p主要通过PTEN/AKT信号通路在肝纤维化的过程中发挥促进作用。为进一步证实YAF2-AS1对miR-141-3p表达的抑制作用,本研究观察了YAF2-AS1对PTEN/AKT信号通路的调控功能,结果显示YAF2-AS1质粒转染的LX-2细胞中PTEN蛋白表达升高,p-AKT蛋白表达降低。
综上所述,YAF2-AS1在肝纤维化组织中表达降低,其通过下调miR-141-3p表达抑制肝星状细胞的活化。YAF2-AS1调控miR-141-3p通路表达可能为肝纤维化诊断、预后评估和治疗提供新标志物和靶点。

