槲皮素和山柰酚对痤疮相关致病菌抗菌作用及网络药理学研究
万春梅,石春蕊,高军,张剑虹
作者单位:1兰州大学第一临床医学院,甘肃 兰州 730000;2兰州大学第一医院皮肤科,甘肃 兰州 730000
痤疮是最常见的皮肤病之一,影响全球近90%的青少年[1]。近20 年来,我国痤疮的发病率及患病率持续上升[2]。该病虽不会危及生命,但若治疗不当,可能会遗留永久性瘢痕,导致严重的身心疾病[1]。病原微生物学发现痤疮丙酸杆菌(Cutibacterium acnes,C.acnes)、金黄色葡萄球菌(Staphylococcus aureus,Saureus)和表皮葡萄球菌(Staphylococcus epidermidis,S.epidermidis)是痤疮相关致病菌[3],抑制痤疮相关致病菌的繁殖是治疗痤疮的重要手段之一。
抗生素是治疗痤疮的常用药物[4],但长期使用抗生素可导致耐药菌产生,还可能使皮肤微生态失衡[5]。外用红霉素治疗痤疮,12周后耐药性S.epidermidis成为皮肤优势菌种,鼻腔S aureus相对丰度从15%升至40%[6];另一项基于16SrRNA 测序的研究发现使用四环素类抗生素6 周后,病人脸颊C.acnes相对丰度降低,葡萄球菌、链球菌等丰度增加[7]。
近年,植物来源的天然产物因其更高效低毒受到广泛关注,可以替代或辅助抗生素抑制痤疮致病菌[8-9]。黄酮类化合物是自然界一大类天然产物,具有明显抗菌活性[10]。槲皮素(quercetin)和山柰酚(kaempferol)是其中代表。槲皮素是一种天然多羟基黄酮类化合物,目前发现其存在于100 余种中草药及多种蔬菜水果中。它对多种细菌有抑制作用,包括耐甲氧西林金黄色葡萄球菌[10];槲皮素和阿莫西林联用可逆转耐阿莫西林表皮葡萄球菌的耐药性[11];Kumar等[12]研究发现槲皮素具有广谱抗菌性。山柰酚是另一种分布广泛的天然黄酮类化合物,对幽门螺杆菌及大肠杆菌有抑制作用[13-14];Cruz 等[15]研究发现山柰酚与氨基糖苷类抗生素组合能产生协同作用,增强对S aureus及大肠杆菌的抗菌作用,降低抗生素最小抑菌浓度(MIC)和治疗剂量。
网络药理学是通过构建药物成分-靶点-通路-疾病的网络关系,分析其作用机制的新兴学科;它以生物信息学为基础,结合基因组学、药代动力学等不同学科,运用多种网络模型进行可视化分析,探索药物治疗疾病的机制[16-17]。
本研究拟探究槲皮素和山柰酚对三种痤疮致病菌的抗菌作用,并联合网络药理学和分子对接技术预测其抗痤疮的作用机制,为后续实验设计和临床应用提供基础。
1 主要试剂与仪器
1.1 实验菌株S aureus(SAU Newman)和S.epidermidis(ATCC 12228)由兰州大学基础医学院菌种保藏中心提供,C.acnes(ATCC 6919)购自上海富祥科技有限公司。
1.2 主要试剂与仪器槲皮素(批号C12374611)、山柰酚(批号C12945398)、红霉素(批号C11119014)、克林霉素(批号C11860980)购自上海麦克林生化科技有限公司;强化梭菌培养基(RCM)(批号1210S031)、大豆蛋白胨(批号218K052)、琼脂粉(批号1214X028)购自北京索莱宝科技有限公司;胰蛋白胨(批号2127842)购自上海金畔生物科技有限公司;D(+)无水葡萄糖(批号20160824)、磷酸氢二钾(批号20140507)、氯化钠(批号20201016)购自国药集团化学试剂有限公司。厌氧产气袋、培养盒及指示剂(日本三菱瓦斯化学株式会社);生化培养箱(兰州文曦分析仪器有限公司);生物洁净工作台(苏州安泰空气技术有限公司);恒温振荡培养箱(上海旻泉仪器有限公司);宝特ELx800 酶标仪(济南奥诺生物工程有限公司)。
2 方法
2.1 供试药液、培养基和菌悬液的制备用二甲基亚砜(DMSO)溶解槲皮素、山柰酚并稀释成所需浓度;无菌蒸馏水溶解克林霉素、95%乙醇溶解红霉素,蒸馏水稀释成所需浓度,现配现用。配制胰酪大豆胨液体培养基(TSB)、胰酪大豆胨琼脂培养基(TSA),强化梭菌培养基(RCM)、强化梭菌琼脂培养基(RCA)。121 ℃灭菌20 min,冷却后置于4 ℃冰箱。无菌条件下取C.acnes甘油冻存液至RCM,37 ℃厌氧培养48 h,稀释转接后再培养28 h获对数期菌液;分别取S aureus及S.epidermidis甘油冻存液至TSB,37 ℃、180 r/min培养16 h,稀释转接后再培养3 h获对数期菌液,使用前稀释菌液浓度约为1.5×105CFU/mL。
2.2 药物抑菌活性考察无菌条件下,在培养基平板表面均匀涂布0.1 mL 相应对数期菌液,每板打5个直径7 mm的孔,去除孔内琼脂,分别加入槲皮素、山柰酚(浓度均为500 mg/L)、两种药物等体积混合液、阳性对照克林霉素(5 mg/L),阴性对照DMSO 各70 µL。S aureus及S.epidermidis于37 ℃培养16 h,C.acnes于37 ℃厌氧培养48 h,十字交叉法测抑菌环直径,实验平行测定3次取平均值。
2.3 药物MIC 和最小杀菌浓度(MBC)根据微量二倍稀释法略作变化测药物MIC和MBC[18]。在96孔板第1 列孔中分别加入180 µL 菌液,20 µL 药物,使槲皮素、山柰酚终浓度为2.5 g/L,克林霉素、红霉素终浓度为0.5 mg/L,第2~9 列孔分别加入100 µL 菌液。吹打混匀后吸取第1 列每孔100 µL 液体至第2列,以此类推,连续倍比稀释9个浓度。同时设阳性对照(仅含菌液),阴性对照(空白培养基),溶剂对照(DMSO),每种菌1板。S aureus、S.epidermidis于37 ℃培养16 h,C.acnes于37 ℃厌氧培养48 h,630 nm波长检测光密度(OD)值,以抑制80%细菌生长的最小药物浓度为相应药物的MIC,公式1:抑制率(%)=1-(OD实验组- OD阴性对照组- OD溶剂对照组)/(OD阳性对照组-OD溶剂对照组)×100%[18]。每组质量浓度设2个复孔,实验平行测定3 次。取MIC、2MIC、4MIC 孔内液体10µL 涂布于相应平板,“2.2”的条件培养,当菌落数≤5个,判定该浓度为MBC,实验平行3次。
2.4 药物时间抑菌曲线测定将7 个无菌小锥形瓶分别编号1、2、3、4、5、6、7 号,每瓶加9 mL 的C.acnes菌液(浓度为105CFU/mL),1~3 号再加1 mL 不同浓度槲皮素,4~6 号加1 mL 不同浓度山柰酚,使其终浓度分别为2MIC、MIC、1/2MIC,7 号只含菌液,37 ℃厌氧培养;将14 个无菌试管分为两组,分别编为1~7 号,每组试管加4.5 mL 的S aureus或S.epidermidis菌液(浓度为105CFU/mL),1~3 号再加500 µL不同浓度槲皮素,4~6号加500 µL不同浓度山柰酚,使药物终浓度分别为2MIC、MIC、1/2MIC,7 号只含菌液,37 ℃、180 r/min 培养。C.acnes每4 小时各取100 µL 于96 孔板,以相应培养基调0,630 nm 波长检测OD 值,连续测至第52小时;S aureus及S.epidermidis每2小时测OD值,连续测至第24小时。
2.5 统计学方法数据采用SPSS 26.0 分析,计量资料以±s表示,多组计量资料间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
2.6 网络药理学探究槲皮素和山柰酚治疗痤疮的作用机制
2.6.1预测槲皮素和山柰酚靶点 检索药物作用靶点数据库DrugBank(https://go.drugbank.com)、中药分子机制的生物信息学分析工具BATMAN-TCM(http://bionet.ncpsb.org/batman-tcm/)、中医药实验和参考指导数据库HERB(http://drug.ac.cn/)获取槲皮素和山柰酚作用靶点,并通过文献补充,用Uniprot数据库(https://www.uniprot.org/)将靶点名转化为人类基因名称。
2.6.2获取痤疮潜在靶点 检索人类基因信息数据库GeneCards(https://www.genecards.org/)、在线人类孟德尔遗传数据库OMIM(https://www.omim.org/)、Disgenet(https://www.disgenet.org/home/)数据库、DrugBank(https://go.drugbank.com)数据库筛选痤疮靶点,选择物种为“Homo sapiens”,以“Acne”为关键词,将药物及痤疮靶点上传到Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)获得交集靶点。
2.6.3蛋白质-蛋白质相互作用(PPI)网络构建和拓扑分析 将交集靶点导入STRING 数据库(https://string-db.org/),选取“Homo sapiens”为蛋白属种,设置“Highest confidence=0.900”,获得PPI网络,并下载“tsv”格式文件,利用Cytoscape 3.9.1 软件的插件CytoHubba进行网络拓扑分析,分析参数包括度值(Degree)、边缘渗透组件(EPC)和最大团中心性(MCC)。
2.6.4基因本体(GO)生物功能与京都基因与基因组百科全书(KEGG)通路富集分析 将交集靶点导入Metascape 数据库(更新于2022-4-22),物种选择为H.sapiens,P Value Cutoff 设置为0.01,其余保留默认设置。GO包含生物学过程(BP)、细胞组成(CC)、分子功能(MF)。用微生信网站(http://www.bioinformatics.com.cn/)绘制GO 分析柱状图和KEGG 通路分析气泡图,用Cytoscape 3.8.2软件构建“药物成分-交集靶点-信号通路-疾病”网络。
2.6.5分子对接分析验证 从PubChem(https://pubchem.ncbi.nlm.nih.gov/)下载化合物2D 结构,用ChemBio3D 软件获得3D 结构,从PDB 数据库(https://www.rcsb.org/)中获得受体蛋白结构,用Py-MOLWin 软件去水和小分子配体,AutoDock Tools 1.5.6 软件向受体添加极性氢,网格盒设置为包含整个受体区域,在所有对接研究中,每对配体和受体生成20个对接构象,当配体和受体结合构象稳定时,能量分数越低,发生结合的可能性越大[19]。结合能小于0 表明配体可自发与受体结合,当对接能量值<-20.92 kJ/mol表示二者有较好结合活性;<-29.29 kJ/mol表示有强烈的结合活性。AutoDock Vina 1.5.6软件进行分子对接模拟及分析,PyMOLWin软件绘图。
3 结果
3.1 药物抑菌活性考察阴性对照组不存在抑菌现象,所有实验组抑菌环直径大于15 mm,说明槲皮素和山柰酚单用及联用对三种菌均有较强抑制作用,见表1,图1。
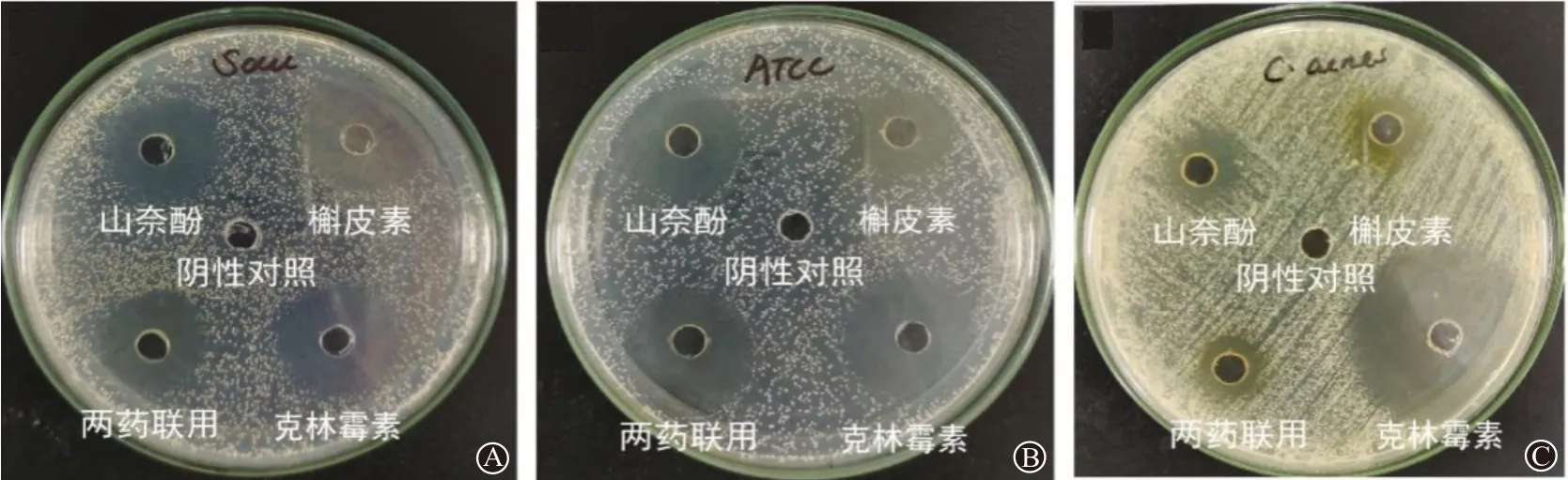
图1 相同浓度不同药物分别作用于S aureus(A)、S.epidermidis(B)、C.acnes(C)的药物抑菌环直径平板图
表1 相同浓度药物抑菌环直径比较/(mm,±s)

表1 相同浓度药物抑菌环直径比较/(mm,±s)
注:S. aureus 为金黄色葡糖球菌,S.epidermidis 为表皮葡萄球菌,C.acnes为痤疮丙酸杆菌。①与阴性对照比较,P<0.05。
抑菌环直径组别S. aureus SAU Newman 19.17±0.29①21.67±0.58①18.33±0.58①25.33±0.58①7.00±0.00 655.08<0.001槲皮素(500 mg/L)山柰酚(500 mg/L)两药联用阳性对照阴性对照(DMSO)F值P值S.epidermidis-ATCC 12228 16.67±0.58①21.00±1.00①19.00±1.00①27.67±0.58①7.00±0.00 317.63<0.001 C.acnesATCC6919 16.67±0.58①17.33±0.58①17.33±0.58①31.33±0.58①7.00±0.00 847.75<0.001
3.2 MIC和MBC槲皮素及山柰酚对三种菌有较强抑制作用,但弱于阳性对照组,见表2。

表2 槲皮素和山柰酚等药物对痤疮相关菌的MIC和MBC/(mg/L)
3.3 药物时间抑菌曲线阳性对照组(不加药)OD值呈“S”形上升趋势,加药能有效抑制细菌生长。各组在2MIC 的OD 值持续处于初始水平,表明该浓度完全抑制细菌生长;各组在MIC 及1/2MIC 的生长整体滞后,细菌迟缓期持续时间比对照组长,且随药物浓度增加抑制作用增强,见图2。
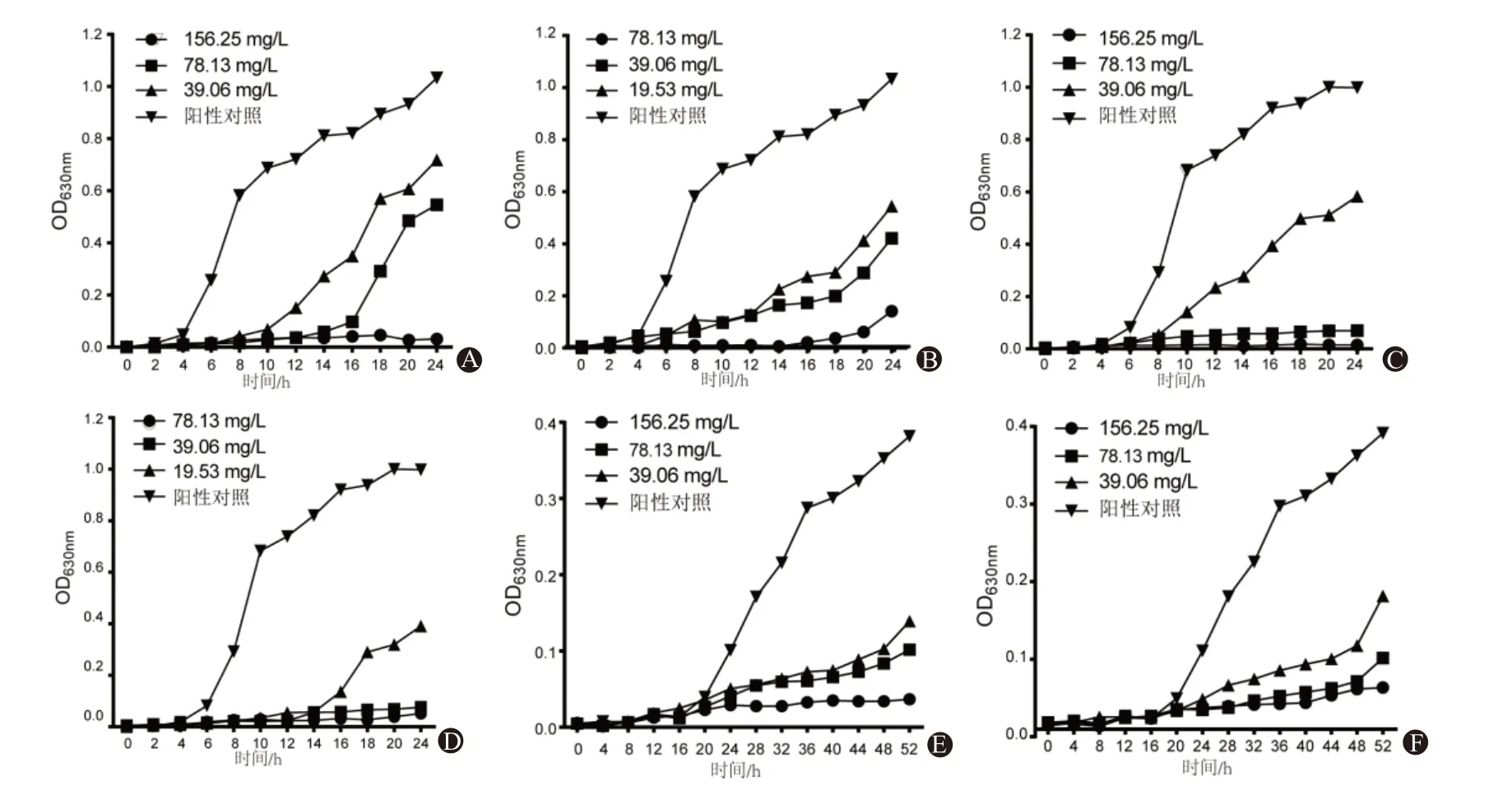
图2 不同浓度槲皮素或山柰酚对三种细菌的抑菌曲线:A为金黄色葡糖球菌与槲皮素;B为金黄色葡糖球菌与山柰酚;C为表皮葡萄球菌与槲皮素;D为表皮葡萄球菌与山柰酚;E为痤疮丙酸杆菌与槲皮素;F为痤疮丙酸杆菌与山柰酚
3.4 网络药理学分析结果
3.4.1获取药物、疾病及二者交集靶点 检索得到2 种活性成分靶点212 个;痤疮靶点1 548 个,将212个成分靶点和1 548 个疾病靶点导入Venny 2.1.0 得到97个交集靶点,如图3。
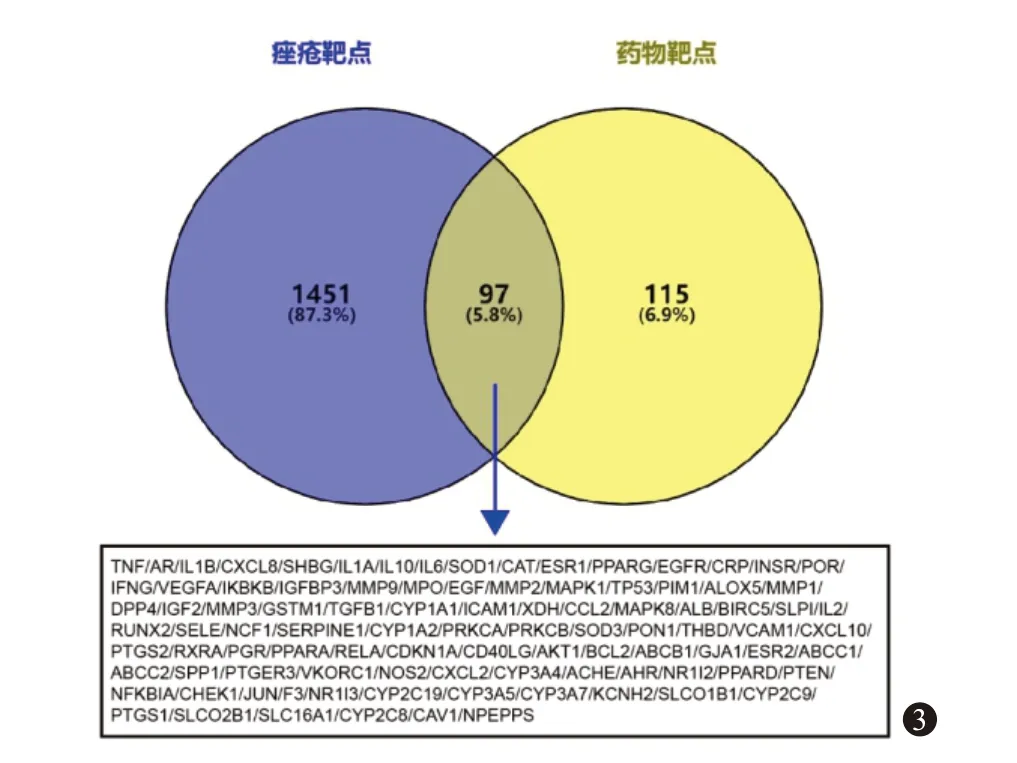
图3 药物潜在作用靶点-痤疮靶点Venny图
3.4.2PPI网络构建及核心靶点筛选 网络共97个节点,315 条边,节点平均Degree 值为6.49。计算每个节点的Degree、MCC 和EPC 并对分值进行排名,得到8个参数排名均靠前的靶点,作为PPI的核心靶点(Hubs),见表3,图4。
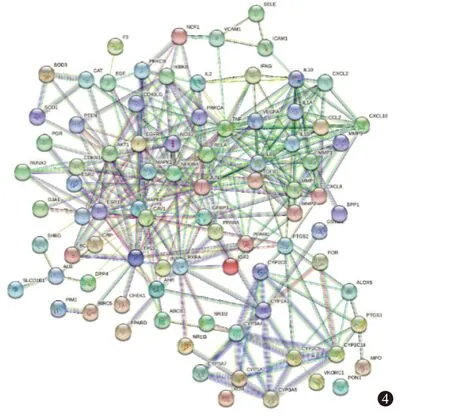
图4 药物治疗痤疮的PPI网络图
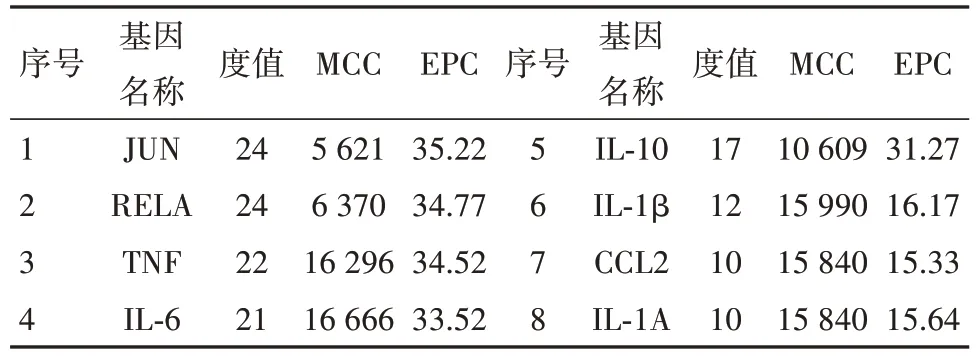
表3 槲皮素和山柰酚治疗痤疮关键靶点的拓扑参数信息
3.4.3GO 功能和KEGG 通路富集分析 Metascape分析得到GO 功能富集条目共1 464 条,其中BP 有1 296 条,MF 有37 条,CC 有131 条,KEGG 富集分析得到183 条信号通路。根据P值由小到大排序分别选取BP、CC、MF 前10 个条目,KEGG 分析中前40 条通路,见图5,6。BP 主要涉及细胞对脂质的反应、对异种刺激的反应、对脂多糖的反应等;CC主要包括囊泡腔、分泌颗粒管腔、胞质囊泡腔等;MF 主要有核受体活性、配体激活的转录因子活性、血红素结合等。综合文献分析,与痤疮炎症反应相关的KEGG 富集通路主要包括肿瘤坏死因子(TNF)信号通路、白细胞介素-17(IL-17)信号通路、丝裂原活化蛋白激酶(MAPK)信号通路、NF-κB 信号通路、Toll 样受体信号通路、辅助性T 细胞17(Th17)细胞分化、磷脂酰肌醇3 激酶-蛋白激酶(PI3K-Akt)信号通路。
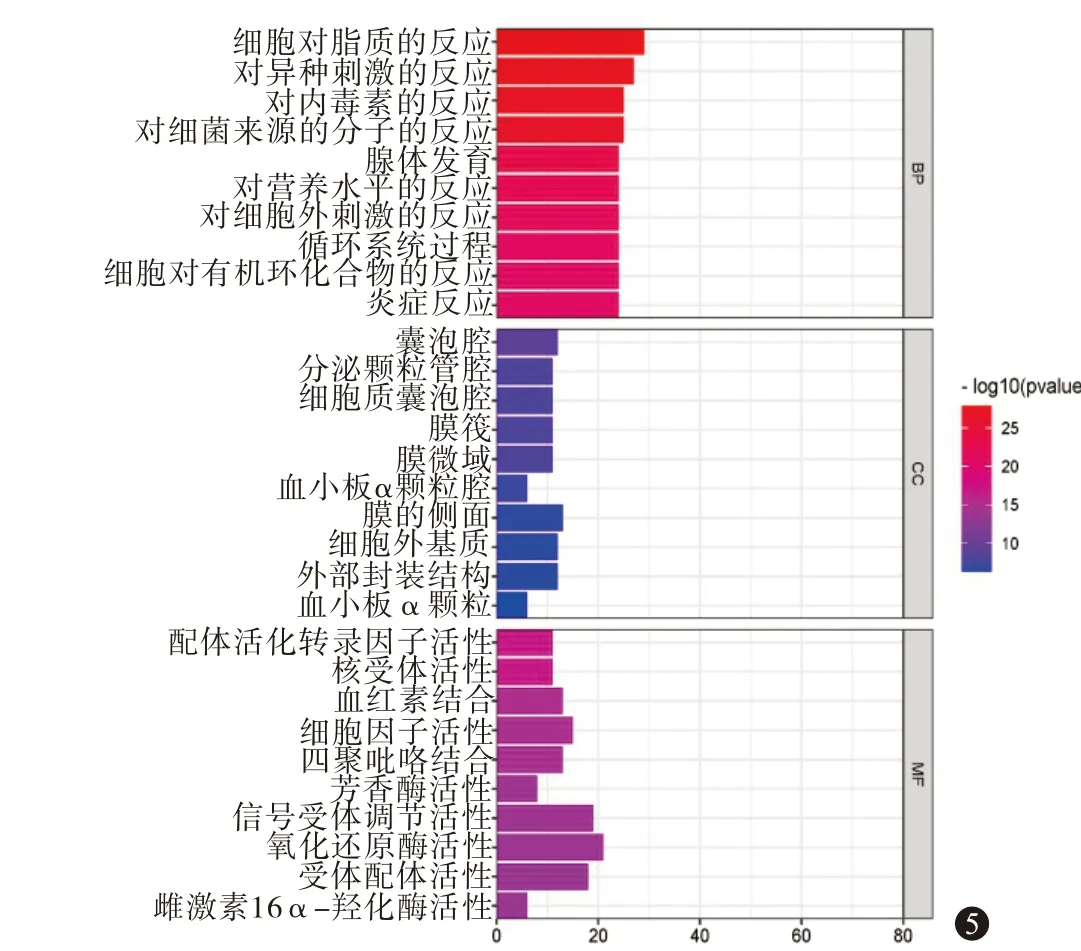
图5 Go分析柱状图
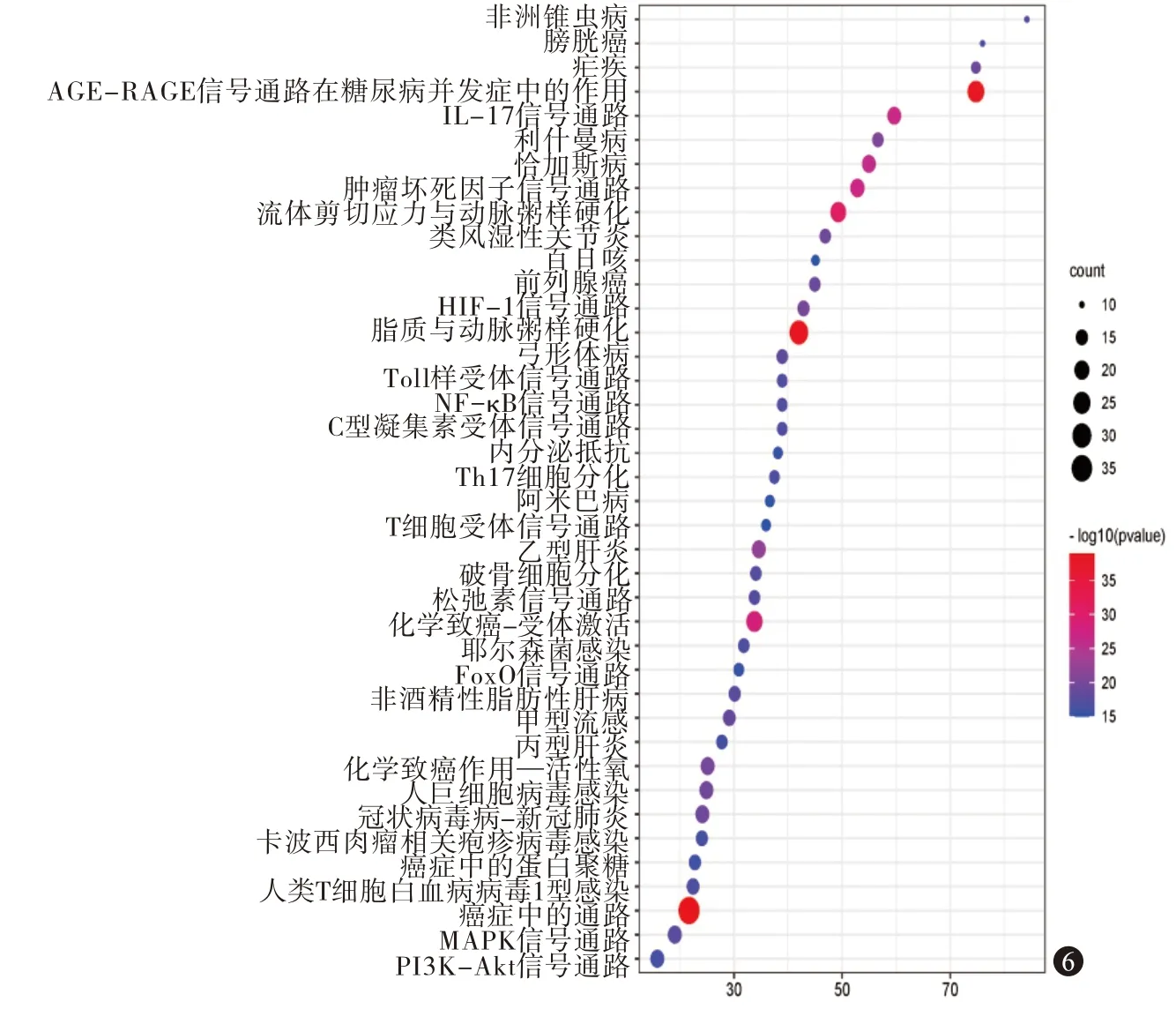
图6 KEGG分析气泡图
3.4.4复合靶点通路网络构建与分析 利用Cytoscape 3.9.1 软件构建药物成分-交集靶点-信号通路-疾病网络,如图7。网络共有107 个节点(疾病1 个、活性化合物2个、靶点97个、通路7条)和336条边。
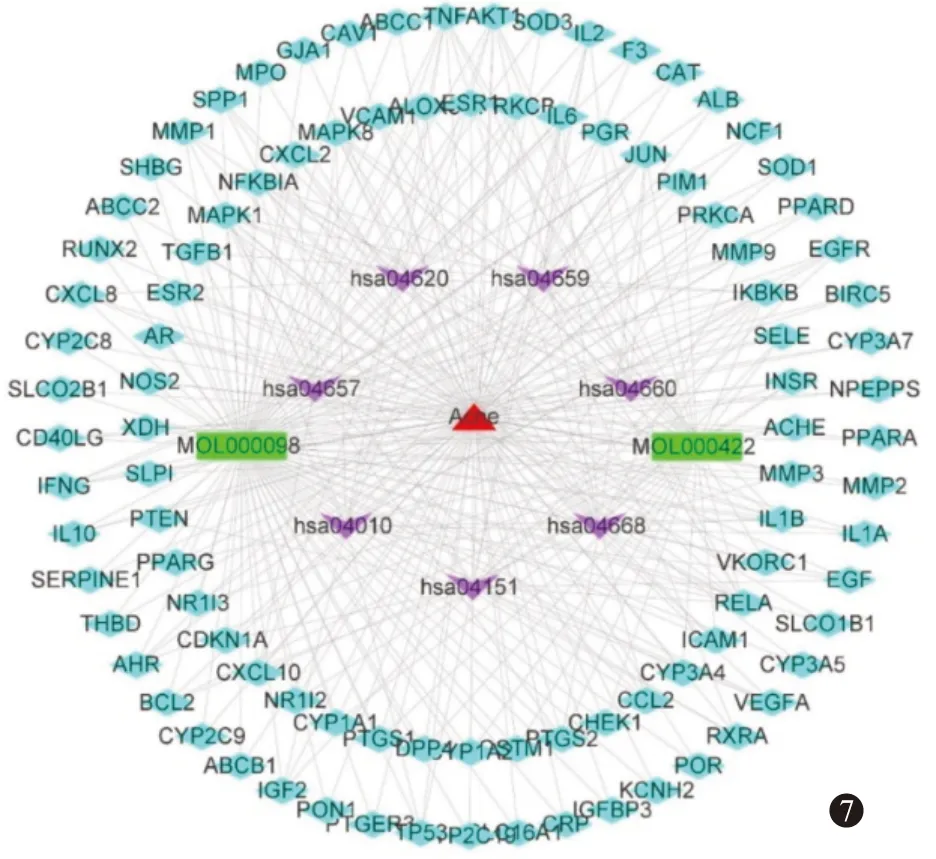
图7 药物成分-交集靶点-信号通路-疾病网络图(紫色节点代表痤疮相关通路,红色节点代表疾病,绿色节点代表活性成分,蓝色节点代表靶点)
3.4.5分子对接验证 选取槲皮素和山柰酚与排名前四的核心靶点蛋白(JUN、RELA、TNF、IL-6)对接,槲皮素、山柰酚与关键靶点蛋白的结合自由能都<-20.92 kJ/mol,说明活性成分与蛋白形成的构象结构稳定,结合活性较高。其中二者与RELA、TNF结合更紧密,见表4。将槲皮素、山柰酚与4 个核心靶点进行可视化,见图8。
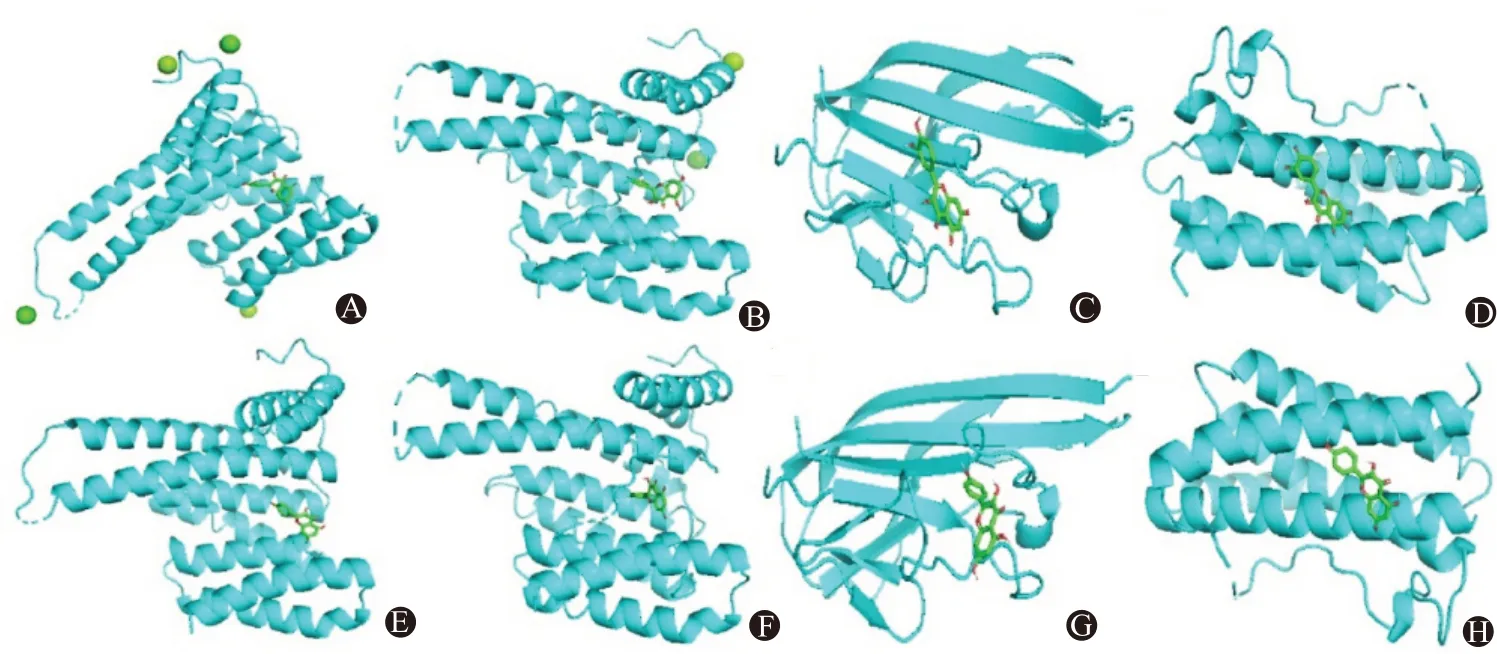
图8 槲皮素和山柰酚与核心靶点分子对接图:A~D分别为槲皮素与JUN、RELA、TNF、IL-6对接过程;E~H分别为山柰酚与JUN、RELA、TNF、IL-6对接过程
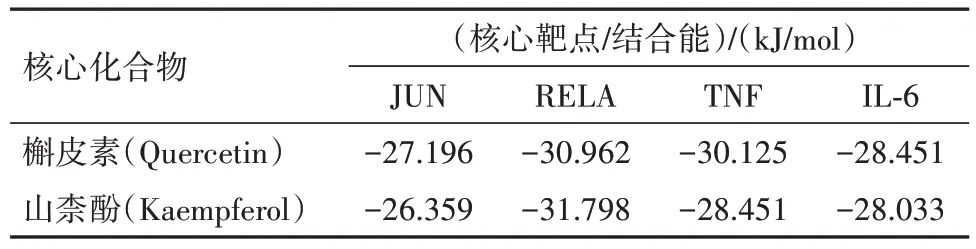
表4 核心靶点蛋白与槲皮素、山柰酚分子对接得分
4 讨论
微生物学研究认为痤疮与S aureus、S.epidermidis和C.acnes等细菌繁殖有关[20],C.acnes在病程早期可诱发毛囊口角化,形成微粉刺;还参与疾病进展的炎症反应[21];Jusuf 等[22]培养痤疮病人皮损及非皮损部位皮肤进行细菌鉴定,发现S aureus在炎性皮损中样本含量明显高于非炎性皮损,S.epidermidis在炎性及非炎性皮损中含量相当,因此S aureus与痤疮炎性皮损具有一定关联。S.epidermidis可诱导相关炎性因子表达,促进并加重炎症反应[23]。故本研究考察槲皮素及山柰酚对上述三种痤疮致病菌的体外抗菌效果,并通过网络药理学预测其治疗痤疮的作用机制。
研究结果显示槲皮素及山柰酚对三种菌均有较好抗菌活性;二者对S aureus和S.epidermidis更加敏感,C.acnes次之,这提示其在痤疮治疗中可能有更全面的抗菌效果。槲皮素对三种菌的MIC≤78.13 mg/L,MBC≤156.25 mg/L;山柰酚对S aureus和S.epidermidis的MIC≤39.06 mg/L,MBC≤78.13 mg/L,对C.acnes的MIC≤78.13 mg/L,MBC≤156.25 mg/L。国外研究[24]得出槲皮素及山柰酚对克林霉素敏感及耐药C.acnes的MIC分别为≤32 mg/L、≤64 mg/L。虽然抗菌实验可能受药品、提取方式、菌株及培养条件等影响,但总体而言,本研究结果和既往同类研究具有较好可比性。其它具有抗菌作用的植物制剂,如滇重楼提取物、山竹提取物等[25],受限于提取工艺,提取物成分复杂等,对C.acnes的MIC 多为g/L 级别,本研究采用植物单体成分,得出MIC为mg/L,抗菌作用强于大多数植物提取物,对痤疮治疗具有潜在价值。
网络药理学分析获得药物与痤疮97 个交集靶点及蛋白互作关系,筛选出JUN、RELA、TNF、IL-6、IL-10、IL-1β、CCL2、IL-1A 共8 个核心靶点。构建KEGG 富集分析发现许多通路在痤疮炎症和免疫反应中发挥作用,其中代表性通路有TNF 信号通路、IL-17 信号通路、MAPK 信号通路、NF-κB 信号通路等。核心靶点JUN、RELA、TNF、IL-6 等在上述通路富集,控制痤疮基因的表达。
TNF和IL-17信号通路是炎症经典通路,痤疮作为一种炎症性皮肤病,与单核巨噬细胞产生的多种炎性因子有关,IL-1α、IL-6、IL-8 及TNF-α 是启动固有免疫应答的关键,可促进毛囊口过度角化及痤疮特征性炎性皮损[26]。丝裂原活化蛋白激酶(MAPKs)是广泛存在于动植物细胞中的一类丝/苏氨酸蛋白激酶,主要作用是将细胞外刺激信号转至胞内及胞核中,引起细胞增殖分化、凋亡和应激等效应[27]。MAPK 信号通路主要有4 条:细胞外信号调节激酶1/2(ERK1/2)、jun 氨基末端激酶(JNKs)、p38 和ERK5[28]。p38-MAPK 和JNK-MAPK 通过磷酸化激活,并促进下游底物磷酸化来快速传递信号,激活的MAPK 能促进单核巨噬细胞产生IL-1α、IL-6等炎性因子,在炎症反应中发挥关键作用[29-30]。Lim等[31]通过体外实验发现槲皮素可抑制C.acnes刺激的人角质形成细胞(HaCaT)、人单核细胞(THP-1)和鼠巨噬细胞系(RAW)264.7 中IL-1β、IL-6、IL-8 和TNF-α的产生和mRNA 的表达水平;其次,槲皮素降低了C.acnes刺激的HaCaT 和THP-1 细胞中ERKs、JNKs 和p38 磷酸化;此外,槲皮素显著减轻C.acnes诱导的痤疮小鼠的炎症反应[31]。
NF-κB是一种调节多种炎症反应表达的诱导性转录因子,许多参与早期免疫反应及各阶段炎症反应的分子都受其调控[32]。TNF-α、IL-6、IL-8 等20 余种炎性因子可被NF-κB 激活,促使大量中性粒细胞聚集于炎症反应部位;此外NF-κB 还促进TNF-α、IL-1β 等细胞因子表达,反之细胞因子也能刺激NFκB 进一步活化,让炎症反应持续和放大[29]。Liu等[33]发现山柰酚能够通过抑制活性氧依赖性MAPKs-NF-κB 信号通路,减少促炎因子IL-18 和IL-1β的释放,降低氧化应激和炎症反应。
分子对接结果示槲皮素和山柰酚与4个核心靶点蛋白JUN、RELA、TNF、IL-6 对接的结合自由能均<-20.92 kJ/mol,表明两种化合物与核心靶点蛋白形成的构象稳定,结合活性较高,验证了槲皮素和山柰酚对痤疮的治疗作用。
综上,槲皮素及山柰酚对三种痤疮致病菌有较强抗菌作用,且与药物浓度存在显著相关性;综合文献和网络药理学研究显示槲皮素在痤疮的抗炎症TNF 信号通路,山柰酚通过抑制活性氧依赖性MAPKs-NF-κB 信号通路发挥作用,且二者治疗痤疮具有多靶点多通路协同特点。这两种中药成分治疗痤疮的核心靶点及通路值得进一步实验验证;并开展疗效相关临床试验,以上是我们未来的研究方向。
(本文图3~7见插图10-6)

