脂肪氧合酶催化亚油酸氧化对核桃蛋白的影响
王旭敏,李怡霞,邓子雨,张杨杰,狄建兵*
(1.山西农业大学 食品科学与工程学院,山西 晋中 030801;2.华朔(山西)绿色产业发展集团生物科技检测有限公司,山西 朔州 038300;3.山西农业大学 山西功能农产品检验检测中心,山西 太原 030031;4.泰州安井食品有限公司,江苏 泰州 225700)
核桃,世界四大干果之一[1],据原国家林业局、国家林草局提供的统计数据和《中国农村统计年鉴》:2020 年我国核桃的产量为479.6 万吨;2021 年我国核桃种植面积达1.2 亿亩,产量达540.4 万吨[2]。核桃中脂肪含量为60%~70%,蛋白质含量为15%~20%,核桃的可食用部分为核桃仁,占总重量的40%~60%,含有丰富的营养素,核桃壳皮在打磨石材、生产活性炭、油毛毡工业以及磨碎做肥料等方面应用广泛[3]。核桃富含脂肪酸和天然抗氧化剂,在预防和降低心脏病及癌症风险方面有重要作用,也具有补肾、温肺润喉、润肠通便等优点[4]。在食品的加工与贮存过程中,都伴随有蛋白质氧化的发生。有研究表明,氧化作用会改变蛋白质的结构特性,影响蛋白质的消化性质,降低其营养蛋白质氧化是指由于蛋白质在受到直接或间接氧化作用后,分子内部发生变化,其原本的共价态结构发生变化,被破坏,分子间的连接、肽链断裂,功能特性进一步恶化,导致食品风味降低、营养损失等[6]。脂肪氧合酶(Lipoxygenase, LOX)在动植物体内最常见,并且植物性原料中的LOX 活性较动物性原料中的高[7],是氧化的一个关键因素。LOX 催化的脂质氧化是由4 个基本反应组成的,分别为夺氢过程、自由基的重排、氧插入和过氧自由基的还原[8]。脂质氧化与蛋白质氧化可以相互转移,这2 种氧化反应的产物如自由基、H2O2等可作为中间物质参与到另一种氧化反应中,前者常常先于后者发生,并且会迅速生成醛类、酮类和低级脂肪酸等一系列化合物,所以二者之间常常可以被说成是前者的产物可以促进后者的发生[9]。
本文以核桃为试验原料,利用脂肪氧合酶对不同添加量的亚油酸进行催化,对核桃氧化蛋白的溶解度、粒径、电位、巯基含量、表面疏水性、二级结构以及内源荧光进行检测分析,本文对核桃蛋白质的氧化机理进行研究,有助于了解脂质氧化对核桃蛋白结构的影响,为抑制核桃蛋白的氧化,增加核桃产品的货架期提供一定的理论依据。
1 材料与方法
1.1 主要材料
核桃:山西农业大学果树研究所(经度112°29′49″E;纬度37°20′29″N);2021 年9 月摘;品种为秋香。
脱脂核桃粉:实验室制备粉。
1.2 主要试剂
本试验所需试剂如表1 所示。
1.3 主要设备
表2为试验所需主要仪器设备。

表2 试验仪器与设备Table 2 Test instruments and equipments
1.4 试验方法
1.4.1 核桃分离蛋白的制备
参照刘岩等[10]方法略加修改,脱脂核桃粉与水按1∶26 的比例混合,调节pH 至11,磁力搅拌1.5 h,离心(5000×g,20 min),取上清液,调节pH 至4.5,磁力搅拌1 h,离心(9000×g,20 min),得沉淀,将沉淀pH 调节至7.0,倒入液氮快速冷冻,-80 ℃冰箱中放置24 h 后放入真空冻干机,得到核桃分离蛋白,4 ℃冰箱保存。
1.4.2 脂肪氧合酶(LOX)的制备
底物的制备:取烧杯,加入0.27 mL 亚油酸、5 mL NaOH 溶液,混合均匀,加入0.25 mL Tween 20,用HCl 溶液调节混合液的pH 至9.0,加入硼酸缓冲液定容至500 mL。
粗酶液的制备[11]:称0.5 g 核桃,冰浴研磨,分别加入20 mL 聚乙烯吡咯烷酮溶液与PBS 缓冲液,离心(4 ℃,12 000×g,30 min),取澄清液,过0.22 μm 滤膜,制得所需粗酶液。
1.4.3 核桃氧化蛋白的制备
将1.4.1 制得的核桃分离蛋白溶于其重量的20 倍的去离子水中,将pH 调节至9.0,取5 个锥形瓶,各加入1.4.2 制得的酶液10 mL,再分别加入0、3、4.5、7.5、9 mL 亚油酸,混匀,放入4 ℃冰箱中反应6 h,调节pH 至4.5,离心(5000×g,30 min),取沉淀,水洗沉淀,将沉淀pH 调节至中性,倒入液氮快速冷冻,-80 ℃冰箱中放置24 h 后放入真空冻干机,得到核桃氧化蛋白,4 ℃冰箱保存[12]。
1.4.4 溶解度的测定
配制5 mg·mL-1蛋白溶液,离心(10 000×g,20 min),取上清液,用双缩脲法[13]测定蛋白质含量,计算其溶解度。
1.4.5 粒径及电位的测定
将核桃氧化蛋白用10 mmol·L-1、pH 7.0 的PBS 缓冲液进行稀释,过0.45 μm 滤膜,用纳米粒度及Zeta电位分析仪进行测定。
1.4.6 游离巯基含量的测定
采用DTNB 比色法[14]。称取15 mg 核桃氧化蛋白加入5 mL Tris-Gly-8 mol·L-1Urea 缓冲液中,使用漩涡振荡仪,在高速模式下振荡分散,加入50 μL DTNB 溶液(4 mg·mL-1),迅速混匀,室温静置1 h,以缓冲液为空白对照,测定其吸光度A412。
1.4.7 表面疏水性的测定
采用ANS 荧光探针法[15]。用10 mmol·L-1、pH 7.0 的PBS 缓冲液将核桃氧化蛋白进行溶解,再加入5 mL 8 mmol·L-1的ANS 溶液,测定荧光强度(激发波长395 nm、吸收波长470 nm),以荧光强度对蛋白质浓度作图,曲线斜率即为蛋白质表面疏水指数。
1.4.8 二级结构的测定
采用傅里叶红外光谱仪对核桃氧化蛋白进行全波段扫描,对蛋白进行结构分析。
1.4.9 内源荧光光谱的测定
用10 mmol·L-1、pH 7.0 的PBS 缓冲液将核桃氧化蛋白进行溶解,配制成1% 的蛋白溶液,离心(25 ℃,10 000×g,20 min),以PBS 缓冲液为空白对照,设定荧光光谱为295 nm,发射光谱为300~400 nm[16],测定其光谱。
1.4.10 数据处理分析
核桃氧化蛋白所测指标进行3 次取平均值,使用SPSS26.0、Origin21.0进行分析绘图。
2 结果与分析
2.1 蛋白质氧化对核桃氧化蛋白溶解度的影响
溶解度是指某种物质在溶剂中的溶解程度,常常被用来表示蛋白的聚集程度。溶解度好的蛋白在加工中应用较广,能有效促进生产[17],而核桃蛋白含有大量脂肪,溶解性较差。
测定不同氧化程度时核桃氧化蛋白的溶解度,由图1 可见,亚油酸添加量为0 mL 时,溶解度为27.97%,当亚油酸添加量从0 mL 增加到3 mL,从4.5 mL 增加到9 mL 时,溶解度呈现下降趋势,当亚油酸添加量为4.5 mL 时,溶解度上升,达到最大值,为45.81%,此时核桃氧化蛋白溶解性最好。在低亚油酸浓度氧化时,核桃氧化蛋白内部形成可溶性聚集物,溶解度有所提高,随着氧化程度的加深,可溶性聚集物通过共价互联转为不可溶聚集物,溶解度明显下降[18]。
2.2 蛋白质氧化对核桃氧化蛋白粒径的影响
蛋白质粒径大小是反映聚集程度的一个关键指标[19],与其在体系中的稳定性紧密联系[20]。如图2 所示,亚油酸添加量为0 mL 时,粒径最大,亚油酸添加量为3 mL 时,粒度分布向小的方向发生偏移,亚油酸添加量为4.5、7.5 mL 时,粒度分布均向大的方向偏移,亚油酸添加量为9 mL 时,粒度分布又向小的方向发生偏移。这种情况的出现,是因为核桃蛋白质在氧化反应后,内部分子结构被破坏、展开,粒径变小;随着反应的进一步进行,氧化加深,暴露的疏水基团开始聚集,生成可溶性聚集体,大于原来的疏水基团,粒径变大;在氧化进行到最后阶段时,又生成不可溶性聚集体,基团之间互相分开,相应的可溶性部分的粒径减小[21]。

图2 不同亚油酸添加量对核桃氧化蛋白粒径的影响Fig.2 Effects of various added amounts of linoleic acid on particle sizes of walnut oxidized protein
2.3 蛋白质氧化对核桃氧化蛋白电位的影响
Zeta 电位是指剪切面的电位,是粒子间的相互作用造成的。Zeta电位可以反映蛋白表面所带正负电荷的情况,与蛋白中氨基酸残基的离子化有关[22]。带电性的大小是表达蛋白分子稳定性的重要基础,Zeta 电位的绝对值越高,说明此时体系不易受外界影响,越稳定[5]。
如图3 所示,在亚油酸添加量不同的样品中,电位值均为负值,表明在核桃氧化蛋白中,存在较多的带负电荷的氨基酸。亚油酸添加量为0 mL 时,Zeta电位绝对值为6.71 mV,添加亚油酸后,核桃氧化蛋白电位绝对值先增大,在亚油酸添加量为3 mL时为最大值16.73 mV,说明此时体系最稳定,随着氧化的进一步加深,核桃氧化蛋白电位绝对值逐渐变小,吸引力的作用力明显超过了排斥力的作用力,核桃蛋白体系的分散被破坏,发生凝聚现象。

图3 不同亚油酸添加量对核桃氧化蛋白Zeta 电位的影响Fig.3 Effects of various added amounts of linoleic acid on Zeta potential of walnut oxidized protein
2.4 蛋白质氧化对核桃氧化蛋白巯基含量的影响
常见的蛋白质中通常都含有丰富的半胱氨酸,且以巯基的形式存在,巯基极易被氧化,氧化后其共价键会被破坏,生成新的二硫键,导致巯基含量下降,对蛋白质产生影响[23],通常可以用来观察蛋白质的氧化程度。
如图4 所示,巯基含量随着亚油酸添加量的增加呈现持续下降的趋势,从75.58 μmol·g-1下降到41.90 μmol·g-1。这种情况的出现,可能是因为氧化作用造成蛋白质的变性以及二硫键的生成,并且随着氧化的加深,多肽分子会继续发生反应,进一步形成其他物质如磺酸类或者其他产物,使得巯基含量进一步降低[24]。

图4 不同亚油酸添加量对核桃氧化蛋白巯基含量的影响Fig.4 Effects of various added amounts of linoleic acid on sulfhydryl content of walnut oxidized protein
2.5 蛋白质氧化对核桃氧化蛋白表面疏水性的影响
蛋白结构的稳定性大多依赖于分子内部的疏水基团,表面疏水性可以反映其氧化程度,同时在评价蛋白质理化性质以及结构变化方面也有着至关重要的作用[25]。
核桃氧化蛋白表面疏水性受亚油酸不同添加量的影响如图5 所示,随着亚油酸添加量的增加,表面疏水指数呈现先增加而后降低的趋势,亚油酸添加量为0 mL 时,疏水指数为19.29,亚油酸添加量为3 mL 时,疏水指数达到最大,为52.33。这主要是由于在脂肪氧合酶催化亚油酸的体系中,氧化作用改变了蛋白质的构象,随着亚油酸的增多,即氧化程度的加深,蛋白质内部的疏水基团开始暴露于空气中,并且开始相互作用产生反应,形成聚集体,疏水指数降低;或者是由于氧化使得蛋白结构展开,又发生了重新聚集,在此过程中疏水基团嵌入,有新的亲水基团形成,疏水指数下降[26]。

图5 不同亚油酸添加量对核桃氧化蛋白表面疏水性的影响Fig.5 Effects of various added amounts of linoleic acid on surface hydrophobicity of walnut oxidized protein
2.6 蛋白质氧化对核桃氧化蛋白二级结构的影响
红外光谱是一项具有测定所需样品少、无损、分辨率高、操作简单等优点的技术,广泛应用于定性定量分析蛋白质的二级结构[27]。酰胺Ⅰ带(1600~1700 cm-1)是主要表达C=O 的伸缩振动,以及它与NH 弯曲振动(酰胺II 带)、C-N 伸缩振动(酰胺III带)的偶合关系,然而伸缩振动的频率大小如何,主要还是依赖于C=O 和NH 之间的氢键特性,因此常常通过观察酰胺Ⅰ带的图谱趋势,来研究蛋白质的结构变化[28]。
由图6 中可以看出,不同亚油酸添加量下核桃氧化蛋白的红外光谱图变化趋势并无太大差异,对酰胺Ⅰ带进行二阶求导,可以得到各个特征峰[29],其中1614~1643 cm-1、1678~1685 cm-1处为β-折叠;1643~1651 cm-1处为无规则卷曲;1651~1664 cm-1处为α-螺旋;1664~1678 cm-1、1685~1700 cm-1处为β-转角。

图6 不同亚油酸添加量在酰胺Ⅰ带处图谱Fig.6 The spectra of different linoleic acid additions at the amide I band
由图7 可见,加入3 mL 亚油酸时,酰胺Ⅰ带最高峰位在波长1654.8 cm-1处,当亚油酸添加量大于4.5 mL 时,酰胺Ⅰ带最高峰位向低波长处发生移动,均到了1652.9 cm-1处,这说明核桃蛋白在脂肪氧合酶的影响下,结构开始不稳定,原来的结构受到破坏,被解离,氢键的作用逐渐加强,电子云密度降低,使得酰胺Ⅰ带的峰位开始向低波数的方向移动[30]。
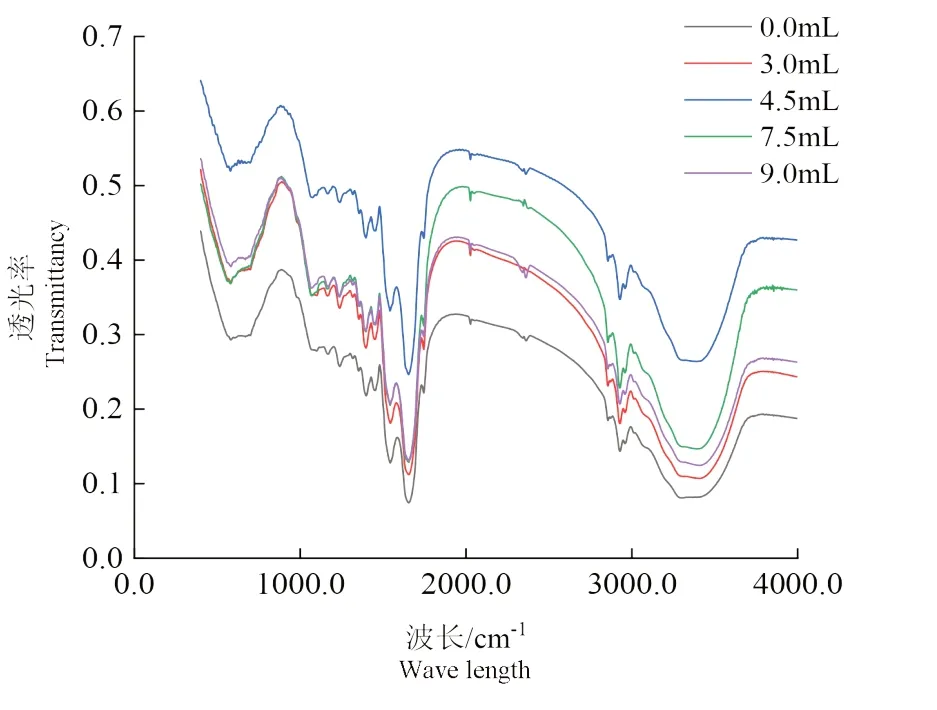
图7 不同亚油酸添加量在全波段处图谱Fig.7 The spectra of different linoleic acid additions at the full band
2.7 蛋白质氧化对核桃氧化蛋白内源荧光的影响
蛋白质本身就具有内源荧光,根据荧光光谱可以对蛋白质的组成以及分子构象等进行详细分析[31]。内源荧光吸收波长的最大值可以用来反映蛋白质中色氨酸残基的相对位置和变化,也可以反映蛋白质微环境的变化[32],由此反应结构的变化。
不同亚油酸添加量对核桃氧化蛋白内源荧光的影响如表3 所示,最大吸收波长并无明显变化,变化范围在323~325 nm 之间。荧光强度呈现持续降低的趋势,从155.35 降低到115.10。最大吸收波长向323 nm 处的转移说明氧化的加深会使得蛋白之间重新聚集在一起,发生凝聚,色氨酸残基的暴露量减小、暴露程度降低,内部物质转移到了更加疏水的环境中去[33]。而内源荧光强度的持续下降,可能是蛋白质中的更多侧链暴露出来,转移到更加亲水的环境中,从而引发结构的变化[34]。
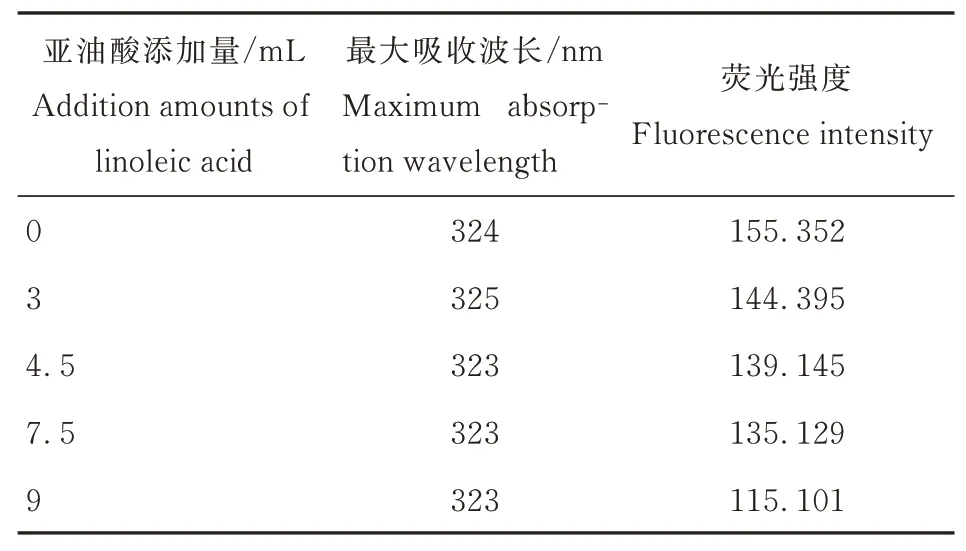
表3 不同亚油酸添加量对核桃氧化蛋白内源荧光的影响Table3 Effects of various added amounts of linoleic acid on intrinsic fluorescence of walnut oxidized protein
3 讨论
本文利用脂肪氧合酶催化亚油酸的氧化系统,对核桃氧化蛋白进行检测分析,结果表明:添加亚油酸后核桃氧化蛋白溶解度与粒径变化趋势一致,当亚油酸添加量为0~3 mL 时,溶解度下降,粒度分布向粒径小的方向发生偏移;当亚油酸添加量为3~7.5 mL 时,溶解度上升,粒径变大;亚油酸添加量为9 mL 时,溶解度下降,粒度大小向粒径小的方向偏移。随着氧化程度加深,Zeta 电位的绝对值先增大后减小,当亚油酸添加量为3 mL 时达到最大值,此时核桃氧化蛋白最稳定。表面疏水性呈现先增加而后持续降低的趋势,当亚油酸添加量为3 mL时,疏水指数达到最大为52.33。孙领鸽等[35]等在蛋白质氧化对核桃蛋白界面性质的影响研究中,发现随着氧化程度的加深,核桃蛋白粒径分布发生转移,低浓度的氧化使蛋白质分子解离,粒径变小,而过度的氧化使核桃蛋白分子结构重新展开,暴露出的内部分子与核桃蛋白结合形成新的聚集体,粒径增加,表面疏水性及Zeta 电位绝对值都先增大后减小。游离巯基含量呈下降趋势,从75.58 μmol·g-1下降到41.90 μmol·g-1,王丹丹等[36]采用不同浓度的AAPH 热降解形成烷过氧自由基代表脂质过氧化反应过程中产生的脂质自由基,对核桃分离蛋白进行不同程度的氧化修饰,随着氧化的加深,半胱氨酸的氧化还原状态被改变,蛋白质中巯基和二硫键的数量和分布被改变,巯基含量持续降低。廖钰等[21]研究了脂肪氧合酶催化亚油酸氧化对花生蛋白结构的影响,花生分离蛋白的荧光峰位随着亚油酸含量的增加先增加后减小,这与我们得出的结果一致,峰位红移表明氧化使蛋白结构展开,内部的色氨酸残基逐渐暴露,而峰位蓝移则表明进一步的氧化使蛋白重新发生聚集,色氨酸残基暴露程度降低。
4 结论
本研究结果说明核桃蛋白在经过不同程度的氧化后,蛋白结构均会发生变化,当亚油酸添加量为3 mL 时,抗氧化效果比较好。较低程度的氧化可以改善核桃的蛋白结构,提高了核桃蛋白的利用率,也为如何提高核桃产品的货架期奠定优良基础。近年来,核桃蛋白深受大众喜爱,市场潜力大,对核桃蛋白进行更深入的研究,能更好的促进核桃产品的加工产业化。

