独居石碱分解热力学研究
雷 鑫,徐略渭,何秉轩,胡皓东,梁 勇
(江西理工大学 材料冶金化学学部,江西 赣州 341000)
稀土元素被称作“工业维生素”与“工业黄金”[1-3],主要赋存于独居石、磷钇矿和氟碳铈矿中,独居石是一种轻稀土含量丰富的磷酸盐稀土矿[4-5],稀土含量占比为50%~68%[6]。目前,独居石处理方法主要有硫酸焙烧-浸出法和热碱浸出法[7]。硫酸焙烧-浸出法常被用于处理独居石与氟碳铈矿的混合矿[8-9],在200~230 ℃条件下采用浓硫酸将独居石中的磷酸稀土转变为可溶的稀土硫酸盐,然后通过调节浸出料液的酸碱度分离RE 和Th[10];热碱浸出法处理独居石,则是采用高浓度氢氧化钠溶液在高温、高压条件下将独居石中的P 转变为可溶的Na3PO4,稀土则转变为形成RE(OH)3,该法对独居石的分解率可达97%,具有较高的经济效益[11]。
查文献知[12],不同RE(La、Ce、Pr、Nd)形成RE(OH)3沉淀的Ksp各不相同,在碱分解处理独居石过程中,REPO4转变为RE(OH)3沉淀的pH 值区间及沉淀顺序存在显著差异,利用这一特性可以实现分离稀土的目的。Wantae Kim 等[13]采用机械化学法分解独居石,并分别研究了RE 的产率,试验数据表明几乎所有的独居石在120 min 内可形成水溶性的Na3PO4和RE(OH)3,实现稀土的分离与提取,但缺乏相关的理论支撑。目前关于独居石碱分解的理论研究相对较少,仅中南大学杨珍等[14]以LaPO4为代表做了初步的热力学研究,表明足够高的碱浓度可以彻底分解独居石,但没有对独居石中其他稀土元素(Ce、Pr、Nd)的转变规律进行补充阐明。
对此,本文选择以La、Ce、Pr、Nd 等4 个元素为研究对象,对独居石进行更全面的热力学研究。最终通过热力学平衡计算绘制出独居石RE-P-H2O 体系(RE 为La、Ce、Pr、Nd)的溶解组分lgc-pH 图、各组分离子总浓度lgc-pH 图,旨在从热力学的角度确定碱分解独居石的条件,为生产提供实践指导,完善独居石碱分解理论。
1 热力学平衡关系
本文选择某独居石作为目标矿物进行热力学计算,矿物稀土总量占比65%,稀土氧化物配分见表1。为方便热力学计算,本文将稀土百分含量转化为物质的量浓度,设定体系中P 元素初始浓度为1 mol·L-1,具体元素初始浓度见表2。

表1 独居石稀土氧化物总量配分[15]Table 1 Total distribution table of rare earth oxides in monazite

表2 独居石完全溶解时La、Ce、Pr、Nd 的初始物质的量浓度Table 2 Initial molar concentrations of La,Ce,Pr,Nd when monazite is completely dissolved
根据热力学平衡常数的定义,在25 ℃条件下,独居石碱浸溶液中存在式(1)~(28)所示的物料守恒关系。
在溶液体系无沉淀产生的条件下存在式(29)~(33)所示的物料平衡关系。
根据式(1)~(33)进行平衡浓度计算,求出独居石碱分解RE-P-H2O 体系的6 个沉淀稳定区间,分别为:①CePO4、PrPO4、NdPO4;②CePO4、PrPO4、NdPO4、LaPO4;③CePO4、NdPO4、LaPO4、Pr(OH)3;④NdPO4、LaPO4、Pr(OH)3、Ce(OH)3;⑤NdPO4、Pr(OH)3、Ce(OH)3、La(OH)3;⑥ Pr(OH)3、Ce(OH)3、La(OH)3、Nd(OH)3。
1)当体系中沉淀为CePO4、PrPO4、NdPO4时,存在式(34)~(36)所示的沉淀平衡关系。
从关系式可以看出,溶液中元素P、Ce、Pr、Nd的减少与CePO4、PrPO4、NdPO4沉淀的生成有关。当溶液体积一定时,由于REPO4沉淀中n(RE)∶n(P)=1∶1,故溶液中离子满足关系式(37)。
式中:c(P)为溶液中元素P 离子状态的总浓度;c0为稀土元素初始浓度;c1为溶液中稀土元素离子状态的总浓度。
2)当溶液中产生CePO4、PrPO4、NdPO4、LaPO4沉淀时,满足式(1)~(38)平衡方程。
3) 当溶液中产生 CePO4、NdPO4、LaPO4、Pr(OH)3沉淀时,满足(1)~(39)平衡方程。
此时溶液中存在关系式(40)。
4)当产生NdPO4、LaPO4、Pr(OH)3、Ce(OH)3沉淀时,满足(1)~(41)平衡方程。
5) 当产生 NdPO4、Pr (OH)3、Ce (OH)3、La(OH)3沉淀时,满足(1)~(42)平衡方程。
6) 当产生Pr(OH)3、Ce(OH)3、La(OH)3、Nd(OH)3沉淀时,满足(1)~(43)平衡方程。
在不同的沉淀稳定区,各组分的离子浓度由表3 关系式分别计算所得。

表3 25 ℃及160 ℃碱分解独居石RE-P-H2O 体系平衡反应及平衡常数Table 3 Equilibrium reaction and equilibrium constant of alkali decomposition monazite RE-P-H2O system at 25 ℃and 160 ℃
采用上述相同的计算方法,分别对25 ℃及160 ℃条件下溶液中P、La、Ce、Pr、Nd 的lgc-pH 关系进行计算梳理。
2 热力学平衡图绘制
2.1 25 ℃下碱分解独居石lgc-pH 图
2.1.1 RE-P-H2O 体系溶解组分lgc-pH 图
图1 为25 ℃条件下碱分解独居石RE-P-H2O体系溶解组分lgc-pH 图。计算发现,La、Ce、Pr、Nd等4 个元素在整个研究区间内共出现了与pH 值对应的6 个沉淀区间,为了简化图表及区分元素,用①、②、④~ ⑥线分别代表pH 值为0.08、14.62、15.06、15.24 及15.46 的划分线,对不同沉淀区间进行划分,并分别对应到4 个元素的沉淀行为上,③表示溶液中P 总浓度接近初始磷浓度的临界值,pH值为14.87,具体如图1 所示。

图1 25 ℃RE-P-H2O 体系溶解组分lgc-pH 图Fig.1 lgc-pH diagram of dissolved components in the 25 ℃RE-P-H2O system
0 14.62 而15.24 2.1.2 总浓度lgc-pH 图 绘制25 ℃总浓度lgc-pH 图,如图2 所示。 图2 25 ℃RE-P-H2O 体系各组分总浓度lgc-pH 图Fig.2 Total concentration of each component in the 25 ℃RE-P-H2O system lgc-pH diagram 同理绘制160 ℃条件下溶解组分lgc-pH 图和总浓度lgc-pH 图,如图3、图4 所示。 图3 160 ℃RE-P-H2O 体系溶解组分lgc-pH 图Fig.3 lgc-pH diagram of dissolved components in the 160 ℃RE-P-H2O system 图4 160 ℃RE-P-H2O 体系各组分总浓度lgc-pH 图Fig.4 Total concentration of each component in the 160 ℃RE-P-H2O system lgc-pH diagram 如图3 所示,Ⅰ、Ⅲ~Ⅴ表示不同沉淀区间的分界线,所对应的pH 值分别为10.70、13.17、13.29、13.37;Ⅱ表示溶液中磷浓度接近初始磷浓度的临界值,pH 值为11.65。图4 所示,随pH 值增加,溶液中La、Ce、Pr、Nd 总浓度总体呈减小趋势,在11.65 图3、图4 表明,0 综上表明,常温常压下高碱工艺可实现独居石的分解,而高温高压条件则可以明显促进该分解过程,降低碱用量与生产成本,故采取高温高压条件为工业分解独居石的常见措施。 本文分析了独居石碱浸工艺下25 ℃和160 ℃时RE-P-H2O 体系La、Ce、Pr、Nd 的lgc-pH 关系及RE 总浓度随pH 值的变化趋势,得到如下结论。 1)热力学分析表明,25 ℃时体系中LaPO4固相稳定存在的区域为0.08 2)通过现有的工艺条件进行分析,验证了理论分析的正确性,常温常压条件下,在pH >15.46 条件下,可实现独居石的分解。高温高压条件明显促进独居石分解过程的进行,在pH >13.37 时即可实现独居石的分解。 本文通过热力学理论计算,补充完善了独居石碱分解理论,从科学的角度解释了现有的独居石碱分解工艺的可行性。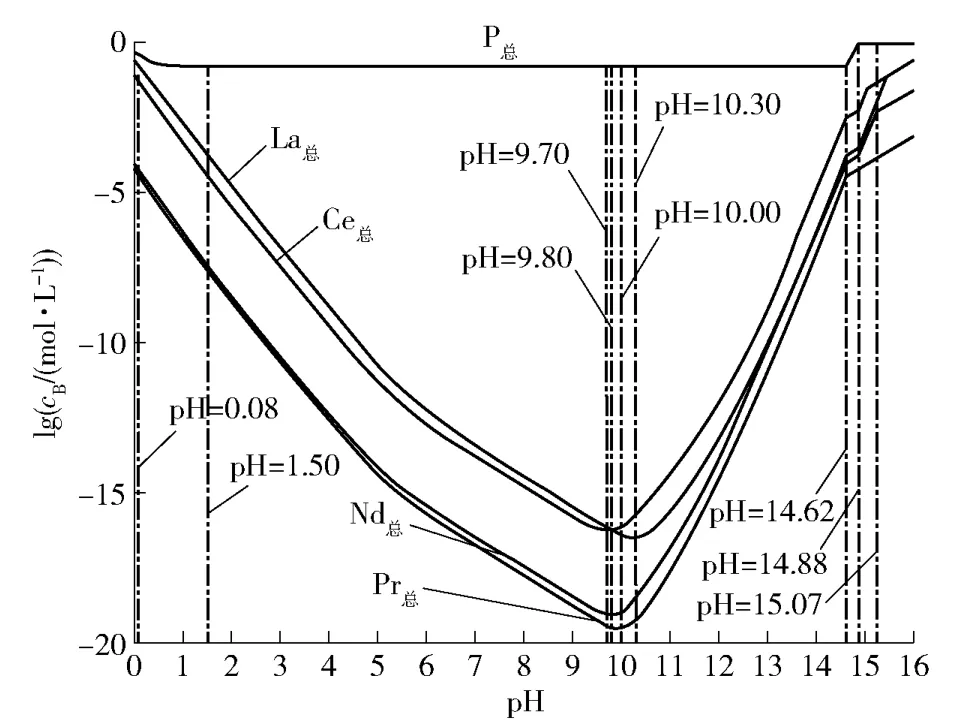
2.2 160 ℃下碱分解独居石lgc-pH 图


3 结论

