重金属废水处理技术研究进展
樊小磊 ,詹作泰 ,高 柏 ,张益硕 ,孙占学
(1.东华理工大学核资源与环境国家重点实验室,江西 南昌 330013;2.东华理工大学水资源与环境工程学院,江西 南昌 330013;3.江西省地质局,江西 南昌 330000;4.江西省地质建设投资集团有限公司,江西 南昌 330000;5.核工业华东建设工程集团有限公司,江西 南昌 330000)
金属冶炼、采矿、化工、纺织、制革、铸造与微电子等工业排放的废水中的重金属具有难降解性、长期积累性、毒害性、代谢困难及隐蔽性等特点,Pb、Cr、As、Cd、Hg 等重金属对生态环境和人类健康都构成了风险,如六价铬对人体的毒性很大,不仅会刺激呼吸道和消化道的黏膜,还有致癌危险。常用的重金属废水处理方法可以分为物理法、化学法和生物法等三大类。物理法主要有稀释法、吸附法、膜过滤法和物理絮凝法等。稀释法是指通过对废水中重金属浓度进行稀释,进而达到废水中重金属浓度达标;吸附法是利用各种吸附材料,通过吸附作用将废水中重金属吸附到材料表面,实现重金属的去除;膜过滤法主要是利用膜的选择透过性通过过滤作用去除废水中重金属;絮凝法是在废水中添加絮凝剂,在废水中形成絮状物,最终通过重力作用沉淀下来。
化学法常见的有化学沉淀法、离子交换法和电化学法。化学沉淀法通过加沉淀剂,改变废水pH或与废水中重金属反应,使废水中重金属变成沉淀物从而去除;离子交换法是通过离子交换剂与水体中重金属离子的离子间浓度差和交换剂上的功能基对离子的亲和能力使重金属离子与离子交换剂进行交换,以降低水体中重金属离子浓度,从而使废水得以净化的方法;电化学处理技术是通过施加电流或电位,使电子及重金属定向移动,以此实现重金属的去除与回收。
生物法处理主要有植物修复法及生物吸附法。植物修复法是利用植物生长过程中物质运输、新陈代谢等生命活动,吸收和积累重金属,并达到清除土壤污染物,从而实现污染修复的过程;生物吸附法是利用微生物与重金属的相互作用,使重金属固定在微生物中,从而实现废水中重金属的去除。
本文对目前常用的重金属废水处理方法机理及应用进行介绍及评价,期望对相关的研究提供参考。
1 常用处理方法及特点
目前常用的重金属废水处理方法包括稀释法、化学沉淀法、混凝-絮凝法及吸附法,这些方法的优缺点见表1[1]。

表1 现有水处理技术优缺点Table 1 Advantages and disadvantages of existing water treatment technologies
2 稀释法
稀释法通常应用于突发性重金属污染的前期与末期处理。稀释法并没有去除水体中的重金属污染物,并且对干净水体造成一定的损耗,但可以作为辅助技术,辅助其他水处理技术以减轻负荷,一般适用于污染范围小、重金属废水污染较轻的应急处理。
近10 年我国共发生突发环境事件1 900 多起,水体污染事件多达1 140 多起,生态环境部直接指导处置的污染达434 起,2021 年我国共产生污水589.64 亿m3,并有98.1%的污水治理采取稀释进行辅助处理,其中污染较为典型的事件有2015 年甘陕川锑污染、2016 年新疆阿勒泰地区克兰河污染、2017 年河南栾川钼污染、2017 年嘉陵江铊污染、2020 年黑龙江伊春鹿鸣矿业尾矿库泄漏等[2]。南方某江河发生严重的Cd 污染事件,采用调水方法对Cd 的浓度进行稀释,使水体中重金属浓度达标,有效避免了Cd 对生态环境的危害[3]。2015 年西南某水体发生了Sb 污染,同样采用了稀释法进行应急处理,这种方法的使用减轻了后续污水处理厂的运行负荷,确保排水达标[4]。
稀释法处理重金属废水可通过活性污泥(a)、絮凝(b)、化学沉淀法(c)及膜分离(d)等方法进行二次处理,以实现废水中重金属的彻底处理,稀释后的水处理工艺如图1 所示[3-5]。
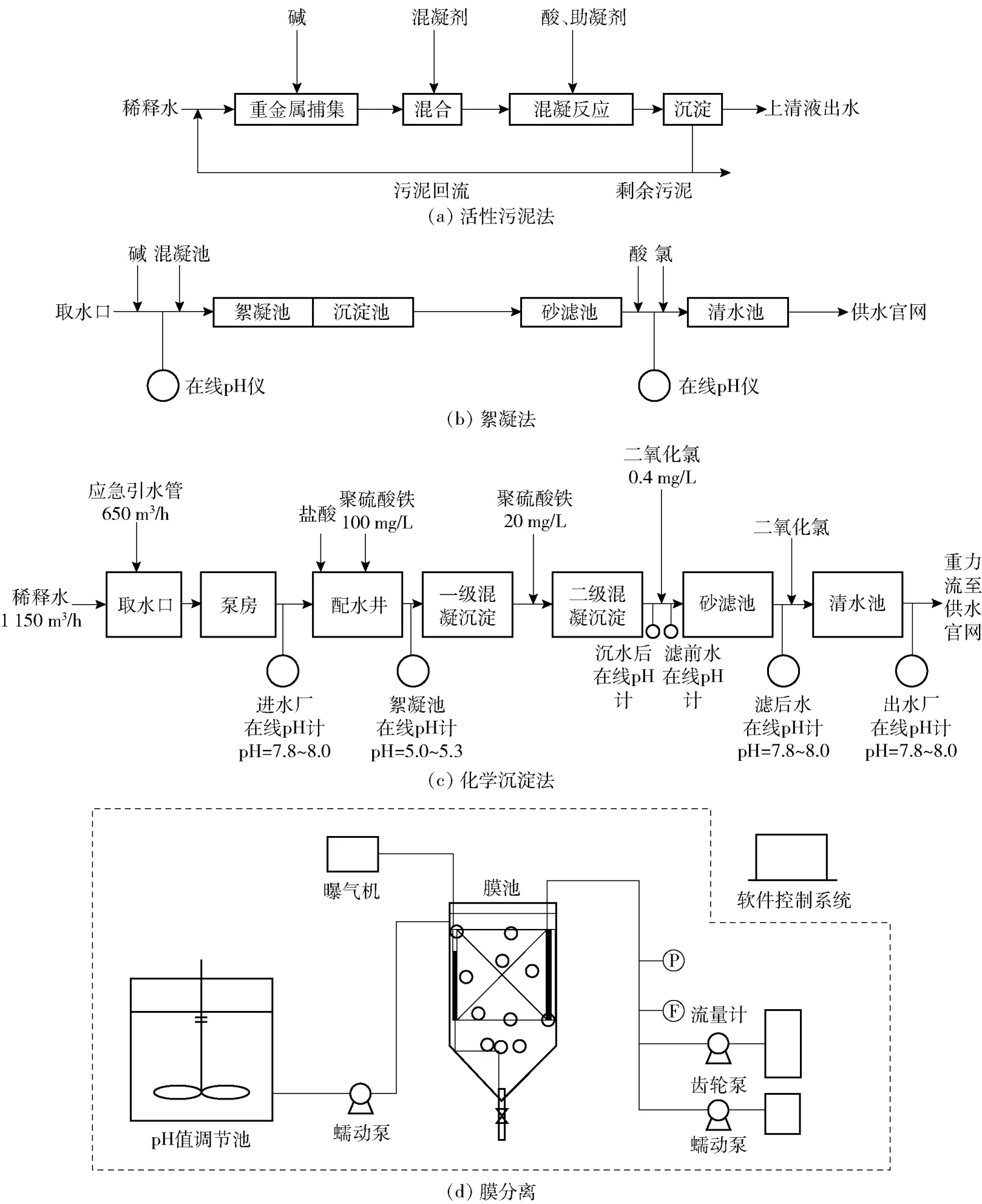
图1 重金属稀释后废水处理的4 种工艺简图Fig.1 Schematic diagrams of four processes for treating wastewater after heavy metal dilution
3 化学沉淀法
化学沉淀法一般包括铁氧体沉淀法、氢氧化物沉淀法、硫化物沉淀法、钡盐沉淀法以及还原沉淀法等。该方法对重金属废水具有去除效率高、管理与操作容易、处理成本低、设备较易设计等优点,因此逐渐被应用到重金属废水处理领域。
3.1 化学沉淀法去除机理
3.1.1 铁氧体沉淀法
铁氧体是由Fe3+、Fe2+以及少量其他二价或三价金属离子形成的复合磁性氧化物,在形成铁氧体的过程中,重金属离子通过包裹、夹带作用填充在铁氧体的晶格中,并紧密结合形成稳定的固溶物。铁氧体法是一种处理重金属废水的特殊沉淀方法,其可以同时去除多种重金属离子,但主要是针对高浓度重金属废水的处理,在低浓度重金属废水处理方面的应用较少。铁氧体法操作过程中生成的固体废物体积小,重金属离子不易浸出而造成二次污染。
3.1.2 氢氧化物沉淀法
当前,对氢氧化物沉淀法的技术研究较为成熟。这种机理可以概括为:废水中金属阳离子与氢氧根离子产生化学沉淀,形成溶解度较低的盐或氢氧化物而析出,然后结合混凝工艺促使水体中不易沉淀的重金属污染物形成絮体,进而达到去除重金属的目的。可以发现重金属氢氧化物沉淀的溶解度在碱性化学沉淀方式中起决定性作用。常见重金属氢氧化物溶解度示意图如图2 所示(图2 中右侧的金属氢氧化物溶解度大于左侧的溶解度,虚线下方表示完全沉淀),具体重金属去除机理与工艺如图3 所示。
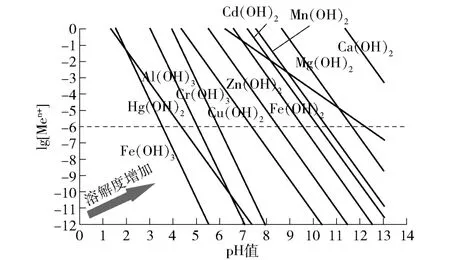
图2 常见重金属的氢氧化物溶解度示意Fig.2 Schematic diagram of the solubility of hydroxides of common heavy metals
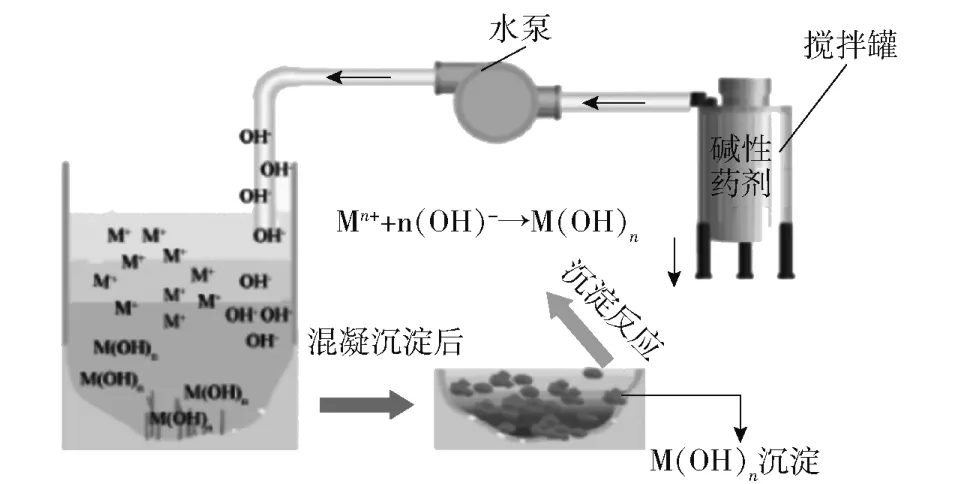
图3 化学沉淀法工艺流程与沉淀机理Fig.3 Schematic diagram of the process and precipitation mechanism of the chemical precipitation method
综合图2[2]与图3[2]可以得出,碱性化学沉淀法适用于钴、汞、铅、锌、镉、镍、铜、铬等重金属的去除。
3.1.3 硫化物沉淀法
硫化物沉淀法是利用Na2S、CaS、H2S 等能与重金属形成比较稳定的硫化物沉淀的原理去除重金属[6]。硫化物沉淀法具有沉淀效果好、残余金属浓度低等优点,但过量硫化物会成为水厂新的污染物。
3.1.4 钡盐沉淀法
钡盐沉淀法通常用于六价铬废水的处理,通过向六价铬废水中加入BaCO3或BaCl2等钡盐,使六价铬与钡盐反应形成铬酸钡沉淀,从而达到去除六价铬的目的。钡盐沉淀法操作简单,但不管加入何种钡盐,澄清液中均含有过高的残余钡含量,需处理后才能排放。
3.1.5 还原沉淀法
还原沉淀法利用硫酸亚铁、亚硫酸氢钠、铁粉等还原剂将废水中的重金属离子还原为金属单质或者价态较低的金属离子,然后往处理液中加入氢氧化物,使得低价态的重金属离子与氢氧化物反应形成沉淀。还原沉淀法具有投资小、运行费用低、处理效果好、操作管理简便的优点,但在采用此方法时,还原剂的选择至关重要。
3.2 化学沉淀法重要影响因素
3.2.1 pH 值的影响
由图2 可知废水溶液的pH 值决定了重金属存在形态,并影响重金属自身所带电荷,因此成为化学沉淀法成功与否的关键因素之一。Mirbagheri 等[7]通过向废水中添加石灰调节pH 值,当废水溶液pH值至8.7 时,铬由初始浓度30 mg/L 降至0.1 mg/L,去除率达到99.7%,处理含铬废水效果明显。张晓健[8]研究了我国南方某镉污染事件,采用了铁盐和铝盐化学沉淀法,并采用烧碱调节水体pH 值,当水体pH 值为7.5 时,去除率只有50%,随着pH 值上升至8.0,去除率达到80%以上,继续升高pH 值到9.0 左右,镉的浓度低于0.000 1 mg/L,出水达标。分析文献[9]可知,重金属废水溶液pH 值过低会使水体中OH-浓度偏低,受离子积常数的影响,溶液中重金属离子溶解度较高,不利于重金属离子沉淀析出;而pH 值过高会造成重金属废水的处理成本增加,而且一些两性金属(如Al)可能会出现反溶现象。因此,控制好pH 值不但可取得较好的去除效果,而且会产生经济效益。
3.2.2 重金属类型
重金属废水中重金属的种类、浓度和存在形态影响重金属的去除效果。根据Paneth-Fajans-Hahn 的理论,解离度较小的重金属离子较易沉淀[10]。例如在适宜的pH 值下,三价铬容易被Fe(OH)3沉淀,而六价铬则难以沉淀;以FeCl3为药剂时,三价锑比五价锑更容易沉淀,当废水中金属浓度较低时,要实现相同的沉淀效果,需要更高的药剂投加量。因此,低金属浓度废水的处理不易采用化学沉淀法。
3.2.3 投加量
理论上,投加量越大,沉淀剂表面积越大,去除率随沉淀剂的增加趋于扩大,之后逐渐平缓。从绿色化学与经济效益上考虑,沉淀剂的投加量满足要求即可。
3.2.4 温度
温度的改变会对水体中重金属离子的水解、沉淀的形成等过程产生影响,大多数沉淀反应为放热过程,过高的温度不利于沉淀反应的发生,温度对沉淀的影响复杂,因此应根据具体的沉淀类型控制好重金属污染水体的温度。TU Y-J 等[11]研究铁氧体沉淀法对水体中重金属的去除效果时提出了3 步处理法,其废水的温度分别为70 ℃、80 ℃、90 ℃,上述温度处理后,废水和污泥中重金属含量均得到了降低,但与常温相比,去除效果改善有限,而且浪费了热能,提高水处理成本。
3.2.5 杂质的影响
重金属废水中杂质会与目标重金属离子发生配合竞争与吸附竞争现象,从而影响重金属的去除率。Ciardelli 等[12]发现废水中的存在会影响目标污染物的去除。于文辉等[13]发现竞争性阳离子、无机配体、有机配体、电解质离子会对铜的去除产生影响。
3.3 化学沉淀法去除重金属废水的应用
3.3.1 铁氧体沉淀法
国内学者赵如金等[14]采用铁氧体去除废水中的重金属,发现n(M2+)/n(Fe2+)越小,且铁离子半径接近目标重金属离子半径时,目标重金属的去除效果较好,同时回收了部分重金属离子,废水经过处理后达到污水综合排放标准。Kumari 等[15]采用共沉淀法合成了镍铁氧体和碱土金属掺杂的镍铁氧体,在未掺杂镍铁氧体的情况下,Pb(II)和Cd(II)离子的去除率为83%和45%,对于掺杂的镍铁氧体,去除率达到97% 和80%。Asadi 等[16]制备了MnFe2O4和CoFe2O4尖晶石铁氧体纳米颗粒,用于去除废水中锌,MnFe2O4和CoFe2O4的比表面积分别为84.5 和50.4 m2/g,饱和磁化度分别为61.39 和37.54 emu/g;在最佳pH=6.0 时,MnFe2O4和CoFe2O4的吸附能力分别为454.5 mg/g 和384.6 mg/g。
3.3.2 氢氧化物沉淀法
刘亚鹏等[17]通过共沉淀法制备了弗里德尔盐(Fs)和钙矾石(Ett)2 种LDHs 重金属吸附剂,阐释了LDHs 对重金属的吸附机理;结果表明,当废水初始pH 值大于5.0 时,重金属去除率较为理想,均在80%以上,最佳pH 值为9.0。Chen 等[18]使用石灰(Ca(OH)2)、纯碱(Na2CO3)和硫化钠(Na2S)从水溶液中去除重金属(即Zn(II)、Cu(II)和Pb(II))的典型化学沉淀方法通过罐子试验进行了比较,在初始浓度为100 mg/L 时,3 种沉淀物对铜和锌的去除率达 99.99%。而硫化钠能有效地去除铅(99.75%),相比之下,用石灰或纯碱沉淀的最大铅去除率只有76.14%和97.78%。
3.3.3 硫化物沉淀法
Zeng 等[19]通过控制硫化过程中的传质和过饱和度,设计了一个用于去除Cu2+的气-液硫化物沉淀反应器,建立了反应器的计算流体动力学(CFD)模型,将硫化反应动力学与两相流流体力学相结合,并研究了H2S(g)气泡直径和流速的影响;根据CFD模拟,气-液硫化物沉淀反应的限速步骤是气-液传质过程;减小H2S(g)气泡直径或增加H2S(g)流速均可控制反应速率和系统中的过饱和度。Ye 等[20]首先采用微生物对尾矿中重金属进行浸出,提取了约0.82%的铅、97.38%的锌和71.37%的铁,再在生物浸出液中添加25 g/L 的Na2S,超过99%锌和75%铁被沉淀出来。
3.3.4 钡盐沉淀法
李航彬等[21]采用钡盐沉淀法处理六价铬电镀废水,钡盐法处理六价铬电镀废水的最优工艺参数为:预调pH 值至8.0,钡盐加入量为理论值的2.4 倍,双氧水破氰,液碱终调pH 值至10.0;采用最优工艺参数处理后,出水总铬含量为0.4 mg/L,镍含量为0.3 mg/L,铜未检出;用浓硫酸对处理废水所得铬酸钡沉淀进行转化反应后,六价铬的回收率可达65%。王群超等[22]首次采用钡盐沉淀法处理纳米银工业废水,最佳工艺条件如下:反应温度15 ℃,初始pH 值10.5,反应时间1 h,每100 mL 废水投加二水氯化钡8 g,纳米银工业废水中存在的醌-氢醌类化合物与溶液中的钡离子反应生成沉淀去除。
3.3.5 还原沉淀法
采用还原沉淀法研究了单质Fe、FeSO4、NaHSO3、Na2SO3等4 种常用还原剂对六价铬的还原效果[23]。结果表明:对于酸性含六价铬重金属废水,NaHSO3是还原六价铬的优选还原剂;对于中性及弱碱性废水,采用FeSO4对六价铬进行还原,可以避免反复调节pH 值,简化工艺,降低成本。马士龙等[24]选用Na2S2O5和FeSO4这2 种还原剂联合还原处理高浓度含铬废水,并用PAM 作混凝剂,利用正交试验对出水水质和重金属污泥产量的分析得出各阶段的最佳参数;结果表明,最终出水六价铬质量浓度为0.19 mg/L,总去除率为99.99%。
化学沉淀法对废水中重金属的去除效果见表2。从表2 可以看出不同的沉淀剂对同种重金属离子具有不同的沉淀效果,同种沉淀剂对不同的重金属离子也具有不同的沉淀效果,因此,应根据重金属的类型来选择合适的沉淀剂。
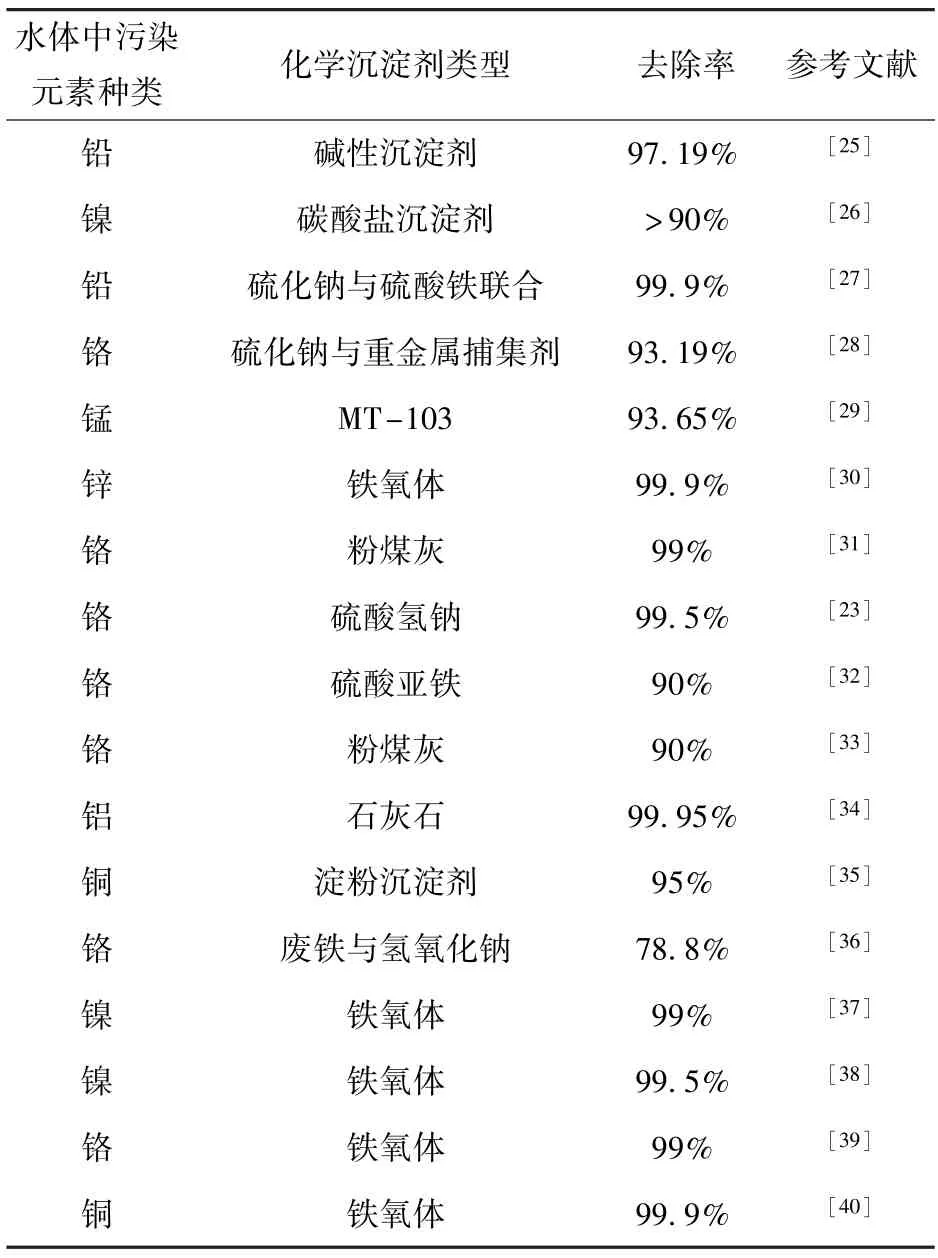
表2 化学沉淀法对重金属废水的应用Table 2 Application of chemical precipitation method for heavy metal wastewater treatment
3.4 小结
化学沉淀法的应用时间较长,工艺成熟且稳定,是应用较广泛的一种水处理技术,但其对污染物的去除需投加大量的化学药剂,易造成水体的二次污染。单一的化学沉淀技术有一定的局限性,与其他重金属废水处理技术连用可以拓宽化学沉淀法的应用范围,如采用电化学-沉淀、Fenton-沉淀、还原-沉淀等方法,可使沉淀物更稳定、减少二次污染并使贵重金属得到回收利用。如何开发出绿色、稳定、应用性较强的化学沉淀法,成为未来化学沉淀技术积极探索的研究方向。
4 混凝-絮凝法
混凝-絮凝法具有经济简便、应用广泛、快速和高效等优点,因此常作为重金属废水的处理方法。铝盐、硫酸亚铁、氯化铁、三硫代碳酸盐、三硫三嗪酸盐、二硫代甲酸盐、氨基二硫代甲酸盐是常见的混凝-絮凝药剂[41]。
4.1 混凝-絮凝法去除机理
传统絮凝剂对重金属离子的去除包括螯合与吸附双重作用,其中,螯合作用占主要地位。絮凝剂中—COO-、—CSS-等带负电的基团可以螯合废水中的重金属以达到去除污染物的目的。絮凝剂通过架桥螯合物形成微絮体,再通过优良的网捕卷扫性能,微絮体形成大絮体,加速沉降,同时稳定的絮凝剂母体分子链可以阻止螯合物的解离,保证了沉淀物的稳定性。在化学沉淀法、混凝-絮凝法和电解法等基础上发展起了电絮凝,一般采用铝和铁作为电极材料,在电絮凝装置中,电能转化为化学能,产生大量二价铁离子和三价铝离子,通过电泳迁移、絮凝、水解等反应形成吸附能力强、螯合能力强、比表面积较大的絮状物,最终去除废水中的重金属离子。传统絮凝原理和电絮凝原理如图4 所示[42-45]。
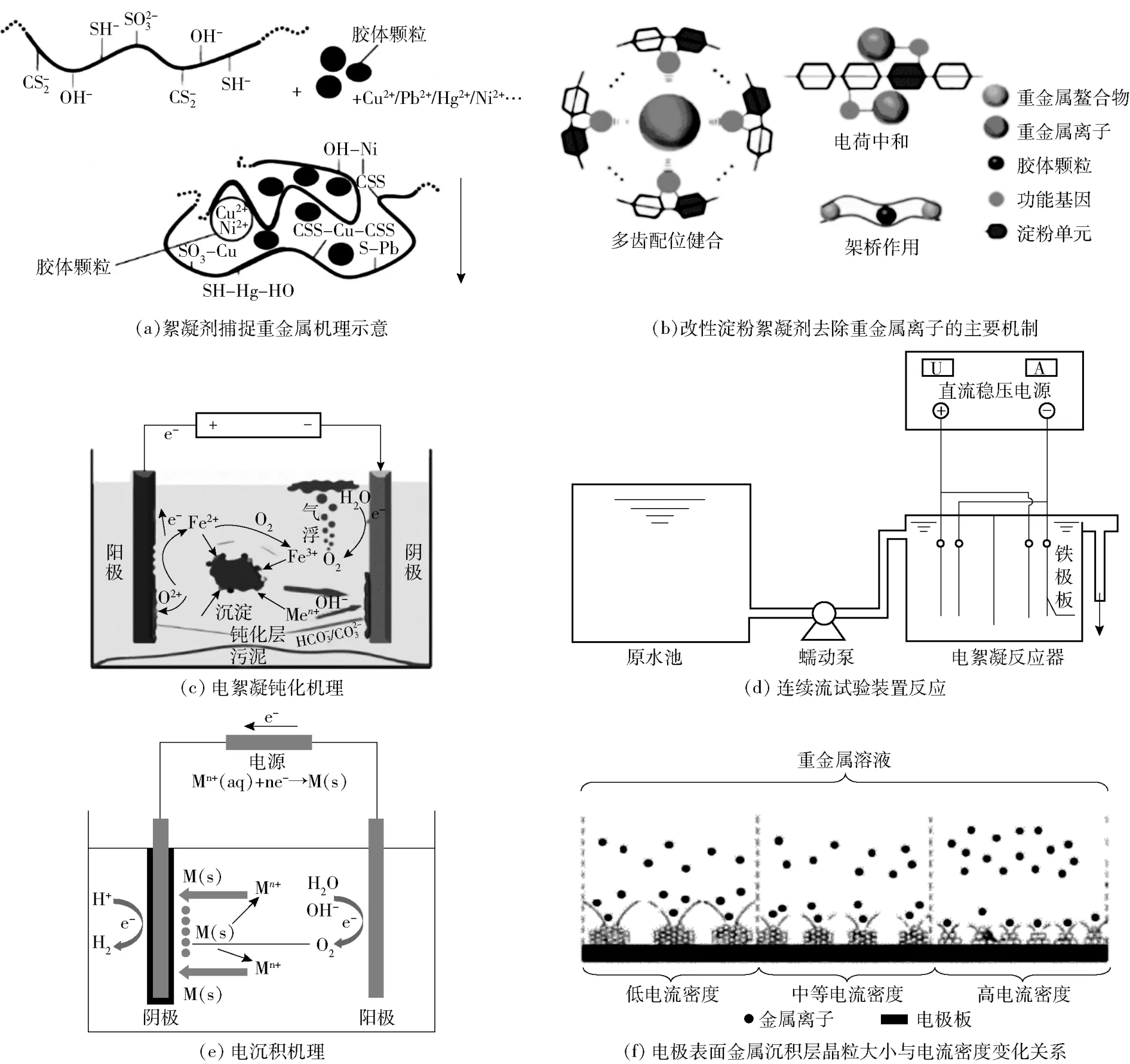
图4 传统絮凝与电絮凝机理Fig.4 Mechanism of traditional flocculation and electro-flocculation
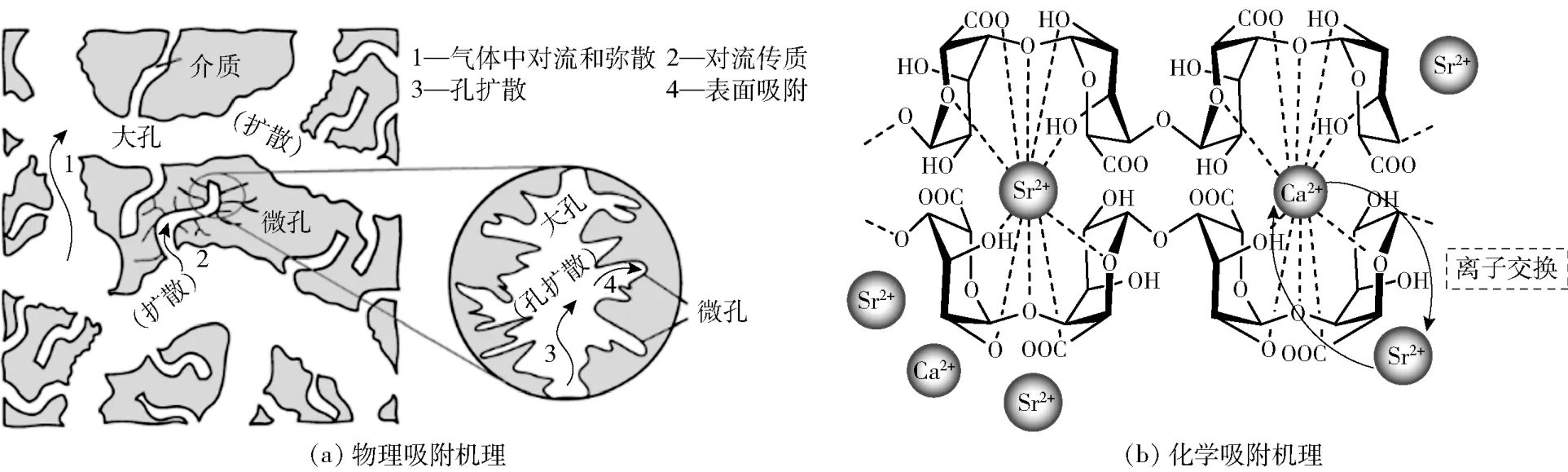
图5 吸附机理Fig.5 Adsorption mechanism
4.2 混凝-絮凝法
混凝-絮凝法对重金属的去除机理包括网捕卷扫、电中和、压缩双电层、吸附架桥等作用,上述作用可以降低胶体的ζ 电位,形成聚合度和稳定性很高的凝胶,从而去除水体中的重金属。絮凝类别主要有无机絮凝剂法、有机絮凝剂法、微生物絮凝剂法以及电絮凝法4 种。
4.2.1 无机絮凝剂法
Ölmez 等[46]采用二乙基二硫氨甲酸改性传统的絮凝剂,采用电凝聚法对1 470 mg/L 的Cr (VI)进行去除,在电流为7.4 A、电解质为氯化钠、时间为70 min 的条件下,实现了Cr (VI)接近100%的去除效果。Li Y 等[47]以二乙基二硫代氨基甲酸钠(DDTC)为捕集剂、聚硫酸铁和聚丙烯酰胺为絮凝剂处理含铜废水,研究得出DDTC 与Cu 物质的量比为0.8~1.2 时,铜去除率可达96%,并提出絮凝剂对水体中重金属的去除存在最优值。
4.2.2 有机絮凝剂法
Chang Qing 等[48]合成了MAC(高分子重金属絮凝剂巯基乙酰壳聚糖),通过研究絮凝机理发现巯基可以还原Cu2+并生成稳定的配合物进而将Cu去除。H Kaşgöz 等[49]采用磺甲基反应和Mannich反应使聚丙烯酰胺负载官能团。在pH 值为3.0~6.0、时间20 min、投加量2 mL、温度45~50 ℃、总反应时间180 min、聚丙烯酰胺∶甲醛∶二乙烯三胺物质的量比为1∶0.7∶0.84 的条件下对含铅废水的最大去除率为90%。
4.2.3 微生物絮凝剂法
祝瑄等[50]以解淀粉芽孢杆菌(ZWG)产生的微生物絮凝剂(MBF)去除废水中的Pb(II),并探究其去除Pb(II)的机理;结果表明:在最佳条件下,MBF对Pb(II)去除率为87.8%;MBF 的主要成分为多糖,MBF 上的羟基和羧基官能团吸附废水中的Pb(II),溶液中的Pb(II)会与阴离子型MBF 之间发生电性中和反应,并且MBF 可与水中的Pb(II)和黄药之间发生吸附架桥作用和卷扫作用。张云等[51]以污水处理厂的脱水污泥为原料,通过超声波细胞破碎制备微生物絮凝剂,研究了微生物絮凝剂对六价铬的去除效果;结果表明,微生物絮凝剂在pH 值为7.0、絮凝剂投加量40 mL 时,对Cr 去除效果最佳,去除率达到91%以上。
4.2.4 电絮凝法
Kabdasli I 等[52]采用电凝聚法对含Ni 和Zn 的电镀废水进行处理,在最佳条件下几乎完全去除重金属并使总有机碳(TOC)去除率达到66%。Navarro R R 等[53]采用PPEI(膦酰衍生物)对电镀废水进行混凝-絮凝处理,研究发现该方法即使在存在高浓度钠离子的情况下,也能有效处理电镀废水。
不同絮凝剂对重金属的去除率见表3。根据表3 可以看出,电絮凝优于传统絮凝技术,Golder A等[54]采用传统絮凝与电絮凝对Cr6+进行去除,也证明了电絮凝较优的观点。
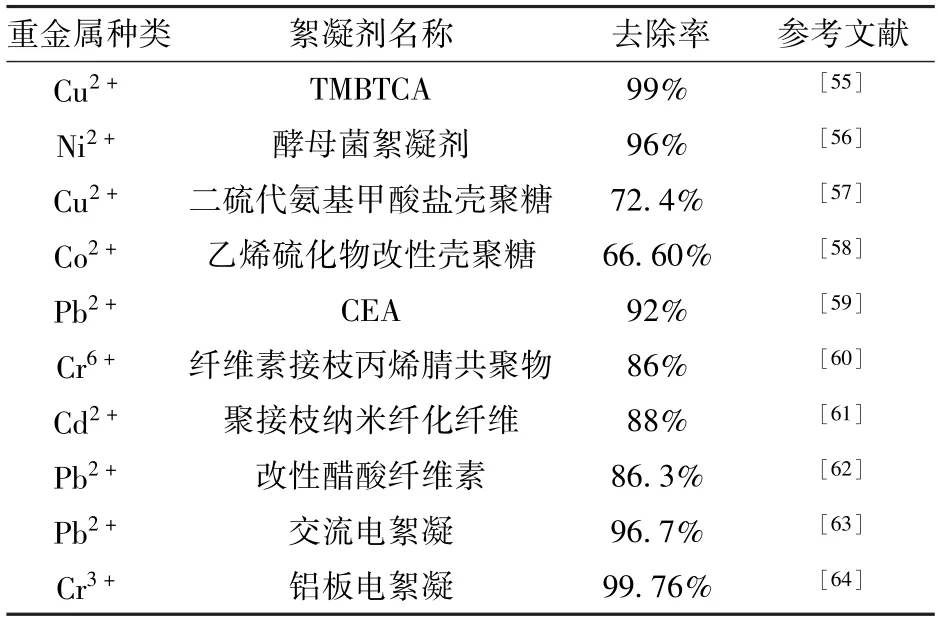
表3 絮凝剂对重金属的去除Table 3 Removal of heavy metals by flocculants
4.3 小结
作为对化学沉淀法和螯合法的改进技术,絮凝法在重金属废水处理中已经得到了广泛的试验与应用。其中天然改性、微生物、无机、有机絮凝剂均对重金属有显著的去除效果,从表3 可知,以往大部分研究中重金属的去除率均高于90%,但重金属废水日趋复杂,传统的絮凝剂具有一定局限性,其捕集重金属的效率在一定程度上被限制。因此,亟需开发高效、新型且大官能团量、聚合度高及pH 值适应范围广的絮凝剂。
电絮凝中,电极的钝化限制了电絮凝对重金属的去除效果,学者采用改变电絮凝处理模式、电源类型、pH 值、阴离子等方式解决了钝化问题,虽然有所改进,但对电钝化机理的研究还不够深入。因此,需从电源参数、电极材料、反应器的设计等因素深入研究,应朝着联合处理、降低电耗、深入研究机理、改进电源等方向进一步完善电絮凝技术,并朝着产业化应用方向努力。
5 吸附法
吸附剂利用自身的高比表面积或官能团对废水中污染物进行吸附,因其具有绿色、快速、简便、廉价和可循环等优点而受到广泛的关注[9]。吸附法研究的关键在于高效吸附剂的制备,当前,农业、矿业、工业等废弃物改性后可作为吸附材料,如生物炭、黏土矿物、废铁屑等[65]。吸附法通常存在选择性差、吸附剂需补充和再生、管理不便等问题。
5.1 吸附法机理
吸附剂结构由微孔、高比表面积、空腔以及发达的通道等构成并促进了物理吸附的作用[66]。Huang等[67]制备了新型石墨烯吸附剂,测得其比表面积高达400 m2/g,并用于水体中铅的去除,研究发现去除率随着pH 值的增加而增加,当pH 值为7.6 左右时,去除率几乎达到100%,其吸附为物理和化学共同作用的结果。
吸附剂中—COOH、—NH、—OH 等能发生交联、螯合作用的官能团可与废水中重金属形成网状结构的化合物或形成共价键、离子键进而去除水体中的重金属。以上吸附机理已在本课题组的研究中得到验证。Chen 等[68]采用插层水滑石对废水中六价铬与二价铜进行吸附去除,动力学拟合符合准二级动力学,表明其以化学吸附为主。Hamouz 等[69]合成了交联聚磷酸酯并对废水中铅和铜进行吸附,其吸附行为符合准二级动力学和Langmuir 模型,表明吸附剂以化学吸附为主。吸附机理如图(5)所示[70-71],化学吸附常见官能团见表4[72]。
5.2 重金属与吸附剂的相互作用
现今,排放的重金属废水中可能存在含有无机物和有机物的复合污染物,这些复合污染物之间会产生相互作用。因此,重金属的复合污染相比于单一污染处理更难。通过对文献进行调研,发现配合作用、浓度、组合关系会使吸附表现为协同或竞争效应。竞争作用不仅不利于重金属复合污染物的去除,而且增加了吸附难度。因此,研究重金属废水中复合污染物之间的相互作用可以促进复合污染的高效去除。
5.2.1 协同作用
当废水中含有多种重金属污染物时,某种重金属的存在利于另外一种污染物的去除称为协同作用[73]。静电引力、氢键以及π-π 相互作用力对协同作用有影响。Wu 等[73]采用磁性生物炭吸附水体中镉与砷时,发现当吸附剂先吸附砷时,会导致吸附剂负电荷密度增加使其对镉的吸附效果更好。因此,研究协同作用可提高重金属废水的处理效果。
5.2.2 竞争作用
复合污染物会竞争吸附位点,降低吸附剂的去除效果[74]。Wang 等[75]采用改性纳米纤维吸附铜和双酚A,研究发现,当两者共同存在时,铜会竞争—SH 的吸附位点,影响双酚A 的去除。因此,若要达到去除复合重金属污染物的目的,必须加强竞争作用的研究,控制好溶液体系的pH 值。
5.3 吸附法的应用
不同材料具有不同的组成部分,一般情况下,重金属离子吸附材料包括无机、有机、微生物与复合吸附剂等类型。
5.3.1 无机吸附剂
Xiong 等[76]采用磷酸对甘蔗渣进行改性,制备出PA-SCB 并将其应用于废水中铅的去除,对铅的吸附量为73.7 mg/g。Hao 等[77]采用共价结合合成了磁性纳米吸附剂,命名为(MNP-NH2),并对Cu2+进行吸附,最大吸附量为25 mg/g,虽然吸附量较低,但其具有较好的稳定性和重复利用性。Su 等[78]采用溶胶-凝胶法制备了羟基磷灰石,并对废水中U(VI)进行吸附,最大吸附量为111.4 mg/g。
5.3.2 有机吸附剂
Ge 等[79]采用分子印迹技术合成了交联印迹壳聚糖吸附剂,并对废水中铅进行吸附,达到良好的去除效果,模型拟合发现其适合于Langmuir 和准二级动力学模型。Li 等[80]通过简单的机械球磨,成功合成了2 种富含结构酰胺键的片状COFs 材料(COFTP 和COF-TE),COFs 上的酰胺基团通过多配位作为Pb2+捕获的有效吸附位点,单位质量的COF-TE上有更多的酰胺基团,使得其对Pb2+吸附容量可达185.7 mg/g,高于COF-TP 的140.0 mg/g。
5.3.3 微生物吸附剂
Tsukamoto 等[81]采用SRB 生物法处理矿山废水,在pH=2.5、T=6℃下对废水中Fe 的最大去除率为93%。徐韶足等[82]研究了拉乌尔菌(Raoultella sp.)对Cd2+的吸附作用。结果表明,随着pH 值增加,菌株对Cd2+的吸附量逐渐增加,在pH=6.0时吸附量最大(61.6 mg·g-1),pH 值继续增加,吸附量反而下降。
5.3.4 复合吸附剂
Zayed 等[83]采用丙烯酸与鱼骨进行聚合制成鱼骨炭吸附剂,并对重金属废水中的铅和镉进行去除,对两者的最大吸附量分别为855 mg/g 和785 mg/g。Zhong 等[84]通过水热法制备了具有β-酮烯胺连接的磁性共价有机框架(Fe3O4@ COF(TpPa-1)),对Cr(VI)吸附量可达245.45 mg/g,表现出优异的吸附能力,经过5 次循环,Fe3O4@TpPa-1 的吸附能力仍然保持在一个较高的水平。
当前主要吸附剂的应用见表5。
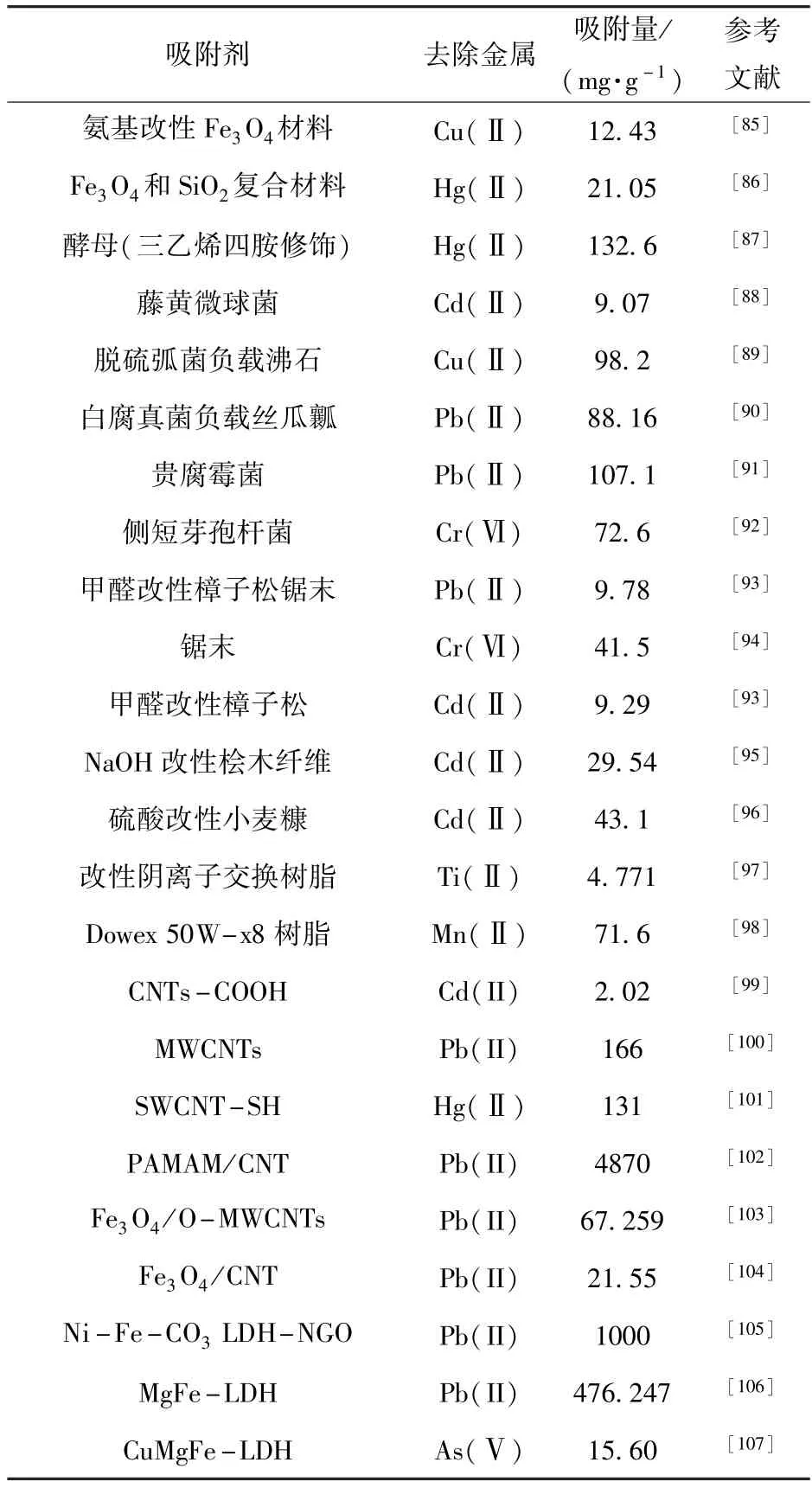
表5 吸附法对重金属的应用Table 5 Application of adsorption method for heavy metal removal
5.4 小结
未来研发的吸附剂应具有无污染、价格低、吸附快、选择性好、使用广、吸附容量高与可再生性。目前,我国环保部门对废水要求资源化利用,但现有吸附剂缺少可控性和设计性,并且分离较困难,因此开发出可再生、可回收、稳定性好以及寿命长的新型吸附剂成为亟需解决的问题。
对复合污染物吸附剂的研究较少。近年以来,废水的成分越来越复杂,需要能解决复合污染问题的吸附剂,但目前对于复杂重金属废水的处理还处于起步阶段,因此,对复合污染物去除的研究也应成为新型吸附剂的研发重点。
对于吸附剂的研发,还要重视工艺与成本等问题,成本与工艺控制不好,新型吸附剂会很难得到推广与应用。
6 思考与展望
尽管重金属废水处理技术已得到较大的发展,但普遍存在运行成本高、处理不彻底、可能造成二次污染等问题。随着重金属废水污染成为全世界最严重的污染问题之一,研发新型废水处理技术与工艺已成为当今学者亟需解决的问题。
针对目前许多重金属废水环境科学与工程问题,应进一步优化和简化重金属废水处理技术,减少二次污染并加强水处理技术机理研究,注重重金属回收工艺,以期实现重金属废水的“零排放”,并取得良好的经济、社会效益。对于水资源复合污染问题,重金属废水联合处理技术可达到更好的处理效果,因此,需加强联合工艺的研究并应用于实际废水。以后的深入研究,主要体现在以下几个方面。
1)运用交叉学科的知识,完善重金属废水修复工艺,以此建立重金属污染废水修复工艺资源库,便于快速应对突发的重金属污染。
2)在易受污染区域,建立长期的重金属废水环境检测生态站,研究该区域常见的重金属污染类型,为重金属废水修复提供基础保障,使重金属废水处理技术更加适用于我国的水体污染。
3)当今,实际重金属废水的污染物浓度偏低,而实验室研发的水处理技术对低浓度重金属废水的处理不佳,应结合国家对生态环境改善所制订的相关标准,开发出适用于实际重金属废水的处理技术,以满足我国对重金属工业废水的排放限值。
4)应注重基础研究,研究水处理技术的修复机理,增强重金属的选择性,开发出针对不同重金属污染的水处理技术。
5)对于复杂的污染,单一技术都具有一定局限性,应将成熟的水处理技术联合使用,使各技术的优势叠加,缺点相互抵消,以满足实际废水的处理。在重金属废水处理领域,复合技术将具有更好的应用前景。
6)目前,对水处理技术的评价,多以重金属的去除效率与去除动力学为关键指标,而忽略了处理技术所引发的环境效应,因此,在研究中要注重环境效应,以免二次污染的发生。
综上,科学有效的水处理技术应基于环境、经济、技术等多方面进行研究,对重金属废水的快速检测以及制订科学的治理方法成为亟需解决的问题。未来,水处理技术应朝着有效、绿色、及时、经济的方向发展。

