离子色谱HPAEC-PAD法测定杨树细胞壁非纤维素单糖组分
金小玲 吴慧敏 杨潮锋 张 进 卢孟柱 曾 为
(浙江农林大学林业与生物技术学院,亚热带森林培育国家重点实验室,杭州 311300)
离子交换色谱-脉冲安培检测法(HPAECPAD)是目前检测单糖的主要分析方式之一[1],单糖的电化学活性以及在强碱中呈离子化状态特征,使其较好保留在离子色谱柱上,无需衍生即可被离子型检测器识别及准确测定[2-3],因此建立一次进样测定植物细胞壁中9 种单糖的研究方法具有重要意义。
杨树(Populus)作为一种世界广泛分布的木本植物[4],有生长迅速、容易扩繁、基因组测序完成、容易转化等特征,被用于木本植物研究的模式植物。我国杨树人工林面积已达757 万hm2,位居世界第一[5]。作为速生丰产、应用广泛的树种,杨树在城市绿化、防风固沙和工业生产中发挥着不可替代的巨大作用[6]。木材的主要结构是树木的次生细胞壁。植物细胞壁是植物细胞外富含多糖的复杂结构,是细胞的第一道屏障,在提供机械支撑、维持细胞形状、控制细胞生长、调节物质运输和信号传导过程中发挥重要作用[7]。植物细胞的初生壁主要由多糖(纤维素、半纤维素和果胶)以及少量的糖蛋白组成,多糖占到了植物细胞壁的70%以上[8]。非纤维素多糖很大程度决定了细胞壁的理化性质,对于植物生长发育至关重要,而快速分析非纤维素细胞壁多糖也成为植物较为关键的研究之一。目前,检测植物中的单糖方法包括气相色谱、液相色谱、离子色谱等方法。但气相色谱法需要对样品进行衍生,操作复杂,且容易产生副衍生物而造成多峰、重叠峰等现象,造成定量不准确且衍生化的程度不完全使得检测准确性差、重现性差[9]。液相色谱则需要将单糖衍生为具有紫外或者荧光吸收的物质[10]。衍生过程操作繁琐,结果误差较大。灵敏度低,如果样品中单糖的含量不高,样品的杂质可能会掩盖单糖的峰[11],因此液相色谱也难以满足实际需求。本研究采用离子色谱脉冲积分安培检测法,检测5种不同的杨树细胞壁中非纤维素的单糖组成,以期为植物细胞壁功能基因组和糖生物学相关研究提供高效、可靠的技术手段。
1 材料与方法
1.1 仪器与试剂
Dionex-ICS-6000+型离子色谱,安培检测器,Au 工作电极,pH-Ag/AgCl 复合参比电极,Chromeleon 7 色谱工作站,AS-AP 自动进样器,CarboPac™(4 mm×50 mm),Dionex CarboPac™ PA100(4 mm×250 mm),默 克MilliQ 超 纯 水 机,德 国Retsch MM400 混合型碾磨仪,50%NaOH 液体购自美国Thermo Fisher 公司,岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸、葡萄糖醛酸和α-淀粉酶购自Sigma-Aldrich 公司,无水乙醇购自上海沪试,三氟乙酸购自麦克林公司。
1.2 材料的选择
5种代表性杨树:84K杨(Populus alba×P.glandulosa)、山新杨(P.davidiana×P.bolleana)、银中杨(P.alba×P.berolinensis)、717 杨(P.tremula×P.alba)、南林895杨(P.deltoides×P.euramericana)材料来自浙江农林大学亚热带森林培育国家重点实验室林木木材品质研究团队,南林895杨为南方种植树种,山新杨、银中杨、84K 杨为北方种植树种,717杨常用于功能基因组研究,均由组培苗扩繁而来。杨树幼苗培养条件为16 h/8 h(光照/黑暗),温度25 ℃,不同种类的杨树在同一时间和相同培养条件下进行扩繁,组培苗一般在Murashige-Skoog(MS)培养基中生长2 个月左右转移至土培,然后取茎段用于细胞壁单糖分析。
1.3 溶液配制
标准储备溶液:分别配制岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸和葡萄糖醛酸质量浓度为1 000 mg·L-1的储备液,4 ℃保存。
标准混合溶液:分别用超纯水配制9种单糖系列混合标准溶液,岩藻糖、鼠李糖、甘露糖、葡萄糖醛酸混合标准溶液系列质量浓度为0.5、1.0、2.0、3.0、5.0 mg·L-1,葡萄糖混合系列质量浓度为2、5、10、12、15 mg·L-1,半乳糖混合标准溶液系列质量浓度为5、10、15、20、30 mg·L-1,木糖混合标准溶液系列质量浓度为10、15、20、25、40 mg·L-1,阿拉伯糖混合标准标准溶液系列质量浓度为5、10、15、20、25 mg·L-1,半乳糖醛酸混合标准溶液系列质量浓度为40、60、80、100、150 mg·L-1。
1.4 色谱条件及淋洗液的选择
由于中性糖和糖醛酸在色谱柱中的保留强弱不同,采用梯度淋洗的方式洗脱。岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖和甘露糖,这7种中性糖保留性较弱且保留时间相似,试验开始时选择较低质量浓度的淋洗液进行洗脱。由于半乳糖醛酸和葡萄糖醛酸的保留性较强,因此将淋洗液的质量浓度提高,增强洗脱能力,最后的最佳淋 洗 程 序 为0~24.00 min 2 mmol·L-1NaOH 淋 洗液,24.01~40.00 min 450 mmol·L-1NaOH 淋洗液。在该淋洗条件下7 种中性糖和2 种糖醛酸一次进样均可得到基线分离。图1 为9 种单糖混合标准溶液色谱图。9 种单糖质量浓度均为5 mg·L-1,流动相为NaOH,流速为1.00 mL·min-1,安培检测器检测,进样量25 μL。淋洗梯度程序为0~24.00 min 2 mmol·L-1NaOH 淋 洗 液,24.01~40.00 min 450 mmol·L-1NaOH淋洗液。
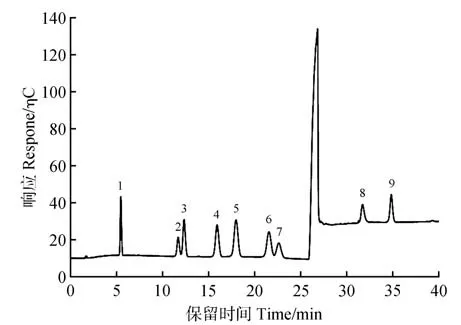
图1 9种不同单糖的标准色谱图1.岩藻糖;2.鼠李糖;3.阿拉伯糖;4.半乳糖;5.葡萄糖;6.木糖;7.甘露糖;8.半乳糖醛酸;9.葡萄糖醛酸Fig.1 Standard chromatograms of 9 different monosaccharides 1.Fucose;2.Rhamnose;3.Arabinose;4.Galactose;5.Glucose;6.Xylose;7.Mannose;8.Galacturonic acid;9.Glucuronic acid
1.5 样品的前处理
分别取84K 杨、南林895 杨、山新杨、银中杨、717 杨的茎段,置于烘箱中121 ℃杀青30 min,50 ℃烘干至恒质量,利用球磨仪机械性粉碎后过425 μm 目筛[12]。80%乙醇洗涤3 次至样品变为纯色,丙酮洗涤1 次,去上清,旋转蒸发去除多余丙酮,所得产物为不溶于醇物(AIR)。将AIR 悬浮于50 mmol·L-1pH=5.2乙酸钠中,加入α-淀粉酶(15 unit)于40 ℃酶解12 h 以去除淀粉[13]。加入体积分数75%乙醇,-20 ℃沉淀2 h以上。4 ℃,13 000×g,离心5 min,去上清,斜置干燥。加入2 mL 2 mol·L-1三氟乙酸于烘箱中120 ℃水解90 min,氮气吹干。加入500 μL 超纯水,过0.45 μm 微孔滤膜,迅速上机进样。
1.6 数据处理
依次按照1.4 中的色谱条件进行分析,并进行线性关系、精密度、检出限和定量限的考察,每个质量浓度样品分别测定3 次,取3 次所得峰面积的平均值,以峰面积(Y)为纵坐标,物质质量浓度(X)为横坐标建立9种单糖的标准曲线,另外分别取各表现的最低浓度的混合标准溶液重复进样6 次测定峰面积,计算RSD,并以3倍基线噪音(S/N=3)计算得到检出限,标准品的线性关系、精密度。
2 结果与分析
2.1 色谱条件的优化
2.1.1 色谱柱的选择
杨树细胞壁单糖组分包括多种中性糖和糖醛酸,采用PA20 或PA100 进行分离,通过试验分析可知,PA100在分离鼠李糖和阿拉伯糖2种中性糖的分离效果较优于PA20 分离柱,同时其他7 种中性糖均可达到基线分离的效果。因此采用PA100分析柱作为分离柱。
2.1.2 柱温的选择
由于柱温会影响色谱柱的分离效果,试验分别考察20、25、30、35、40 ℃在内的5 个不同柱温,对9种单糖分离的影响。试验结果表明,当柱温为30 ℃时,色谱峰达到最理想的分离效果(见图2)。

图2 9种单糖在不同柱温下的分离色谱图A.20 ℃;B.25 ℃;C.30 ℃;D.35 ℃;E.40 ℃Fig.2 Separation chromatograms of 9 monosaccharides at different column temperatures A.20 ℃;B.25 ℃;C.30 ℃;D.35 ℃;E.40 ℃
2.1.3 淋洗液浓度的选择
由于7 种中性糖的保留性较弱且保留时间相似,试验采用低浓度的淋洗液进行洗脱,因此考察淋洗液NaOH 浓度分别为2、5、8、10 mmol·L-1,对7 种中性糖分离的影响,试验结果表明,淋洗液浓度为2 mmol·L-1时,7 种中性糖均达到基线分离(见图3)。
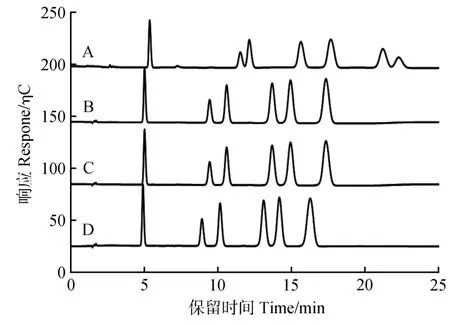
图3 7种中性糖在不同淋洗液浓度下的分离色谱图A.2 mmol·L-1;B.5 mmol·L-1;C.8 mmol·L-1;D.10 mmol·L-1Fig.3 Separation chromatograms of 7 neutral sugars under different eluent concentrations A.2 mmol·L-1;B.5 mmol·L-1;C.8 mmol·L-1;D.10 mmol·L-1
2.2 方法学研究
分别对9 种单糖的线性关系、检出限、重现性及保留时间进行分析,结果如表1 所示,相关系 数 为0.999 0~0.999 3,最 低 检 出 限1.57×10-3~1.41×10-2mg·L-1,重现性为1.09%~3.96%。表明9种单糖中相关系数及重现性良好,最低检出限符合试验需求。

表1 9种单糖线性方程、相关系数、线性范围、检出限、定量限及重现性Table 1 Regression equations correlation,linear,limits of detection(LOD),quantification limits(LOQ)and reproducibility(RSD)of IC determination of 9 monosaccharides
2.3 加标回收率及其标准偏差
选择5 种杨树中的南林895 进行加标回收率的测定,验证方法的可行性。加标试验结果见表2,南林895 杨细胞壁中9 种单糖均被检出,同时通过加标回收率在91.32%~109.25%,重现性在1.69%~4.86%,表明该方法重现性、加标回收率满足基本实验要求。

表2 南林895杨加标回收率及相对标准偏差Table 2 recovery and relative standard deviation of Nanlin 895 poplar sample spike
2.4 5种杨树细胞壁中单糖含量
5 种不同杨细胞树壁中9 种单糖含量测定结果如表3 所示,结果表明,5种不同杨树细胞壁中9种单糖均被检测出,但不同杨树细胞壁中单糖含量具有一定差异。

表3 5种不同杨树细胞壁中9种单糖含量Table 3 Contents of 9 monosaccharides in 5 different poplar cell walls
2.5 5种不同杨树细胞壁中单糖含量的分析
试验数据表明,5种杨树细胞壁单糖主要为岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸和葡萄糖醛酸,其中半乳糖醛酸占比最高,木糖次之,葡萄糖醛酸占比最少(见表4)。
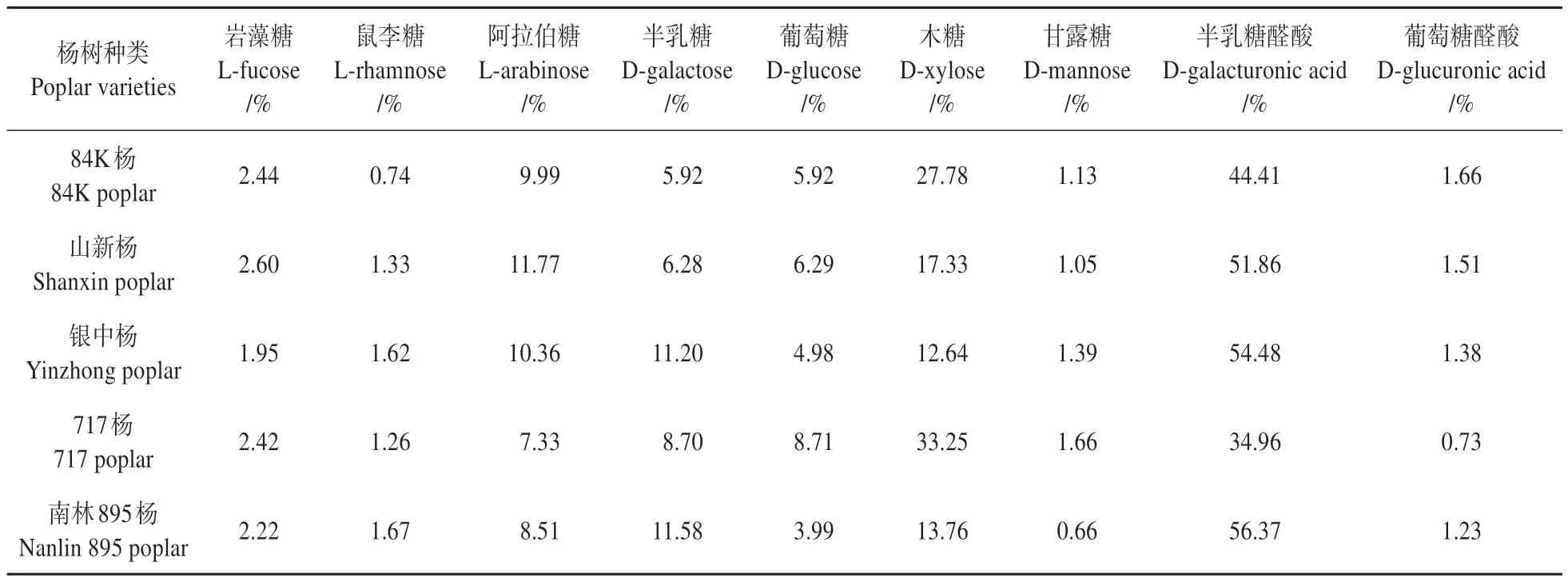
表4 5种不同杨树中9种单糖含量占总糖的相对比例Table 4 The proportion of 9 monosaccharides in 5 different poplars
3 讨论
植物细胞壁一般分为初生壁和次生壁2类[14],不同组织和种类的细胞壁多糖组成差别很大。而本试验取材为生长约2个月的组培苗茎段,正处于初生壁阶段向次生壁转化的阶段,此时茎段的树皮和髓部以初生细胞壁为主。双子叶植物杨树初生壁多糖的主要成分为纤维素、木葡聚糖和果胶,果胶包括同型半乳糖醛酸聚糖(HG)、鼠李半乳糖醛酸聚糖Ⅰ(RGI)和鼠李半乳糖醛酸聚糖Ⅱ(RGII),主要成分HG 由多个α-1,4 半乳糖醛酸残基连接形成的线性聚糖,占果胶的65%左右[15-16],由此推测这是半乳糖醛酸含量占比最高的原因之一。植物在生长过程初生生长结束以后,茎段逐渐木质化形成次生细胞壁。木聚糖是茎段次生壁主要的半纤维素[17]。木糖含量仅次之的部分原因是茎段木质部中含有较多的木聚糖,另外初生壁细胞中木葡聚糖也含有木糖[18]。细胞壁中的纤维素高度结晶化,不能被2M 三氟乙酸水解,因此样品中的葡萄糖单糖占比不高,不能反映出纤维素的含量。阿拉伯糖和半乳糖是RGI 和阿拉伯半乳聚糖蛋白(AGP 的主要组成成分),所以细胞壁中单糖组分占据一定比例。甘露聚糖主要存在于裸子植物细胞壁中,而杨树是被子植物,因此甘露糖在杨树细胞壁中占比较低。岩藻糖和鼠李糖存在于木葡聚糖、AGP、RGII 的末端[19],在单糖分析中占比较低。葡萄糖醛酸主要存在于木聚糖的侧链中且高度甲基化,在图4 中可见,葡萄糖醛酸之前的峰(约34 min)可能为甲基化的葡萄糖醛酸,为造成葡萄糖醛酸检测较低的部分原因。由于缺乏甲基化葡萄糖醛酸标样,今后的研究中可以进一步改进分析方法。

图4 样品色谱图A.84K 杨;B.银中杨;1.岩藻糖;2.鼠李糖;3.阿拉伯糖;4.半乳糖;5.葡萄糖;6.木糖;7.甘露糖;8.半乳糖醛酸;9.葡萄糖醛酸Fig.4 Chromatogram of sample A.Populus alba×P. glandulosa 84K poplar;B.Populus alba×P. berolinensis;1.L-fucose;2.L-rhamnose;3.L-arabinose;4.D-galactose;5.Dglucose;6.D-xylose;7.D-mannose;8.D-galacturonic acid;9.D-glucuronic acid
4 结论
为测定杨树细胞壁中的单糖组成,本研究建立了离子交换色谱-脉冲安培检测法测定7种中性糖(岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖和甘露糖)和2 种酸性糖(半乳糖醛酸和葡萄糖醛酸)的方法。该方法通过使用NaOH的单一淋洗液就能实现9 种单糖在40 min 之内达到基线分离的效果,同时前处理简单且无需任何衍生化处理。检测限为1.57×10-3~1.41×10-2mg·L-1,样品加标回收率在91.32%~109.25%,达到离子色谱加标回收率80%~120%的要求。本方法将为进一步研究细胞壁非纤维素多糖建立基础,并为其他木本植物细胞壁糖生物学研究利用提供参考。

