龙牙楤木Aeβ-AS基因的表达对烟草中皂苷含量的影响
霍清清 夏雨新 李佳乐 韩 薇 张书雅 张哲 夏美玲 郭雯华 由香玲
(东北林业大学生命科学学院东北盐碱植被恢复与重建教育部重点实验室,哈尔滨 150040)
龙牙楤木(Aralia elata(Miq.)Seem),又名辽东楤木,属五加科(Araliaceae)楤木属落叶小乔木或灌木。龙牙楤木主要分布在我国东北地区,以及俄罗斯、朝鲜和日本等地[1]。龙牙楤木具有较高的药、食两用价值,在保肝[2]、抗肿瘤[3-4]、抗炎[5]、降血糖[6-7]等方面有不同程度的药理作用。近年来已从龙牙楤木的根、茎、叶、芽等部位中分离出大量活性成分,其中研究最多的为楤木皂苷[8],其结构主要为齐墩果烷型五环三萜皂苷。
齐墩果烷型五环三萜皂苷主要是通过甲羟戊酸(MVA)途径合成[9-12],而β-香树素合成酶(β-AS)是皂苷合成途径中的一个关键限速酶,其作用位点为三萜皂苷生物合成途径的下游阶段[13],是生物合成三萜皂苷的第一步,将2,3-氧化鲨烯催化合成β-香树素。现已从人参(Panax ginsengC.A.Mey)[14]、拟南芥(Arabidopsis thaliana)[15]、甘草(Glycyrrhiza uralensis)[16]、竹节参(Pana japonica)[17]等植物中克隆得到编码β-香树素合成酶基因的cDNA 序列。Wu等[18]首次从辽东楤木中克隆得到Aeβ-AS基因,并在酵母中成功表达,但Aeβ-AS在植物中的表达尚鲜见报道。
本研究以龙牙楤木体胚苗为材料,应用分子生物学技术克隆齐墩果烷型皂苷生物合成途径中一个关键限速酶β-AS基因,并构建植物表达载体对烟草进行异源转化。该研究为进一步解析龙牙楤木中三萜代谢合成途径,利用基因工程手段来提高齐墩果烷型三萜皂苷的产量奠定基础。
1 材料与试剂
1.1 材料
本研究所用材料为龙牙楤木(Aralia elata)体胚苗,由东北盐碱植被恢复与重建教育部重点实验室龙牙楤木愈伤组织接种在分化培养基上培养得到,培养基配方为SH+3.0 mg·L-1IBA+30 g·L-1蔗糖;野生型烟草(Nicotiana tabacum)组培苗。
1.2 试剂
通用植物总RNA提取试剂盒(离心柱型)购自北京百泰克生物技术有限公司;质粒提取试剂盒、胶回收试剂盒购自北京BioFlux 公司;DNA marker、PCR 相关试剂、限制性内切酶、PrimeScriptTMRT reagent Kit with gDNA Eraser 均购自大连宝生物科技公司;TransStart®FastPfuDNA Polymerase,Trans1-T1 Phage Resistant Chemically Competent Cell,TransStart® Green qPCR SuperMix 均购于北京全式金生物技术有限公司;农杆菌(Agrobacterium)GV3101 由东北盐碱植被恢复与重建教育部重点实验室保存;植物表达载体pROKⅡ质粒由山东师范大学张慧教授惠赠;试验所用引物合成、测序服务由北京擎科生物科技有限哈尔滨分公司完成。
2 方法
2.1 目的基因的克隆
参照BioTeKe 公司RNA 提取试剂盒说明书,提取龙牙楤木体胚苗的总RNA,检测纯度和浓度后,以0.5 μg 总RNA 为材料,利用PrimeScriptTMRT reagent Kit with gDNA Eraser 试剂盒反转录合成第一链cDNA。根据龙牙楤木Aeβ-AS基因序列[19](GenBank:HM219225)并结合植物表达载体pROKⅡ序列的多克隆位点设计特异性引物扩增目的片段,所用引物见表1。PCR 反应体系为模板2 μL,引 物Aeβ-AS-F 1 μL、Aeβ-AS-R 1 μL、5×buffer 10 μL、FastPfu1 μL、dNTP 4 μL,用ddH2O 补足至50 μL,反应条件为95 ℃ 2 min;95 ℃ 20 s,58 ℃20 s,72 ℃ 2 min 40 s,共40 个循环;72 ℃ 5 min。反应结束后,取2 μL PCR 产物进行1%琼脂糖凝胶电泳分析。

表1 试验中所用的引物Table 1 Primer sequences used in this study
2.2 植物表达载体的构建及农杆菌转化
利用同源重组的方法将质粒与pROKⅡ载体按一定比例混合,在重组酶的催化下,37 ℃反应30 min,完成表达载体的构建,具体方法参照说明书。利用液氮冻融法将pROKⅡ-Aeβ-AS质粒转入到农杆菌GV3101感受态细胞内,随机挑取单克隆进行PCR 检测,扩增引物pROKⅡ-F 和pROKⅡ-R序列见表1。
2.3 转基因烟草获得及PCR检测
参照李爽等的烟草遗传转化方法,并进行修改。将生长状态良好的无菌野生型烟草叶片切成长宽1.0 cm 大小的叶片,浸泡到制备好的菌液中(OD 值为0.2~0.3)侵染10 min,共培养2 d 后,转移到含有40 mg·L-1卡那霉素和200 mg·L-1特美汀的分化培养基中,每隔1 d更换1次培养基直至无菌。待长出不定芽后,将不定芽转移到生根培养基中进行生根培养,得到再生植株。
对抗性植株进行分子检测,用CTAB法提取烟草叶片DNA,以pROKⅡ-F 和pROKⅡ-R 为引物进行PCR 反应,并用1%琼脂糖凝胶电泳检测,筛选出阳性转基因株系。
2.4 Aeβ-AS 基因在烟草中不同组织器官的表达模式分析
利用通用植物总RNA提取试剂盒(离心柱型)提取烟草转基因株系的T0 代纯合体叶片、茎和根的总RNA,以反转录后的cDNA 为模板,以Ntactin基因为内参基因,利用北京全式金生物技术有限公司的荧光定量试剂盒进行实时荧光定量PCR。反应体系:模板cDNA 2 μL,2×Mix 10 μL,上、下游引物各0.4 μL,Dye 0.4 μL,用ddH2O补足至总体积为20 μL。扩增条件:95 ℃ 5 min;95 ℃ 30 s,60 ℃34 s,40 个循环。利用2-ΔΔCt法对Aeβ-AS基因的相对表达量进行计算。
2.5 实时荧光定量PCR检测Aeβ-AS基因表达量
提取转基因株系的T0 代纯合体及野生型烟草叶片的总RNA。以反转录后的cDNA 为模板,以Ntactin基因为内参基因,进行实时荧光定量PCR。具体步骤参照2.4。利用2ΔCt法分析定量数据,计算不同株系中Aeβ-AS基因的相对表达量。
2.6 总三萜含量分析
以香草醛-冰醋酸法检测转基因烟草总三萜的含量[19-20]。将收获的T1 代纯合体烟草植株烘干并研磨,称取0.05 g 样品,以4 mL 95%乙醇浸泡24 h 后超声40 min,70 ℃水浴萃取1 h,精密移取100 μL 上清,70 ℃水浴蒸干,加入200 μL 新配制的5%香草醛-冰醋酸溶液及800 μL 高氯酸,摇匀,70 ℃水浴15 min,流水冷却至室温,加入4 mL乙酸乙酯,于551 nm 处测量吸光值。以齐墩果酸为对照绘制标准曲线,得到回归方程Y=4.9235X-0.002 3,R2=0.990 3(Y表示三萜含量,X表示A值),线性范围为0.002 5~0.080 0 mg。
2.7 转基因烟草关键酶基因表达分析
根据烟草FPS基因序列(GenBank:GQ410573.1)、SS基因序列(GenBank:MG770310.1)、SE基因序列(GenBank:XM016579303.1),并结合标准荧光定量PCR 引物设计原则设计烟草关键酶FPS、SS、SE基因的引物(表1),Actin为内参基因。
利用qRT-PCR 的方法检测烟草野生型与转基因烟草关键酶基因FPS、SS、SE的表达情况,其反应体系参照2.4,在调整计算域值和调整基线循环后,与Aeβ-AS基因一同进行实时数据的分析。
2.8 数据处理
用SPSS 22.0 对Aeβ-AS基因在转基因烟草中不同部位之间的表达量、各个转基因烟草株系中Aeβ-AS基因及其上下游的关键酶基因的表达量以及各个株系中的三萜含量进行差异显著性分析(Duncan),用Excel 2019作图。
3 结果与分析
3.1 龙牙楤木Aeβ-AS基因全长cDNA的克隆
基于NCBI 已知的龙牙楤木Aeβ-AS基因序列(GenBank:HM219225),以龙牙楤木体胚苗cDNA为模板,经PCR扩增后将PCR产物进行1%琼脂糖凝胶电泳检测,得到2 300 bp 左右的产物,与预期片段大小一致(图1)。
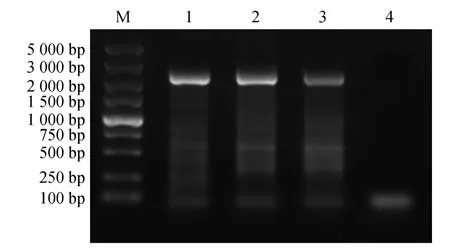
图1 龙牙楤木Aeβ-AS基因的克隆M.Marker;1~3.PCR产物;4.阴性对照Fig.1 Cloning of DNA of Aeβ-AS gene from A.elata M.Marker;1-3.PCR product;4.Negative control
3.2 植物表达载体的构建
利用同源重组的方法将上述PCR 产物与pROKⅡ载体按一定比例混合,在重组酶的催化下,37 ℃反应30 min,将其转入感受态细胞中,在抗性板上挑取转化子进行菌落PCR 验证(图2A),并提取阳性转化子的质粒送测序。最终结果表明,Aeβ-AS基因成功整合到植物表达载体pROKⅡ中,至此植物表达载体构建完成。
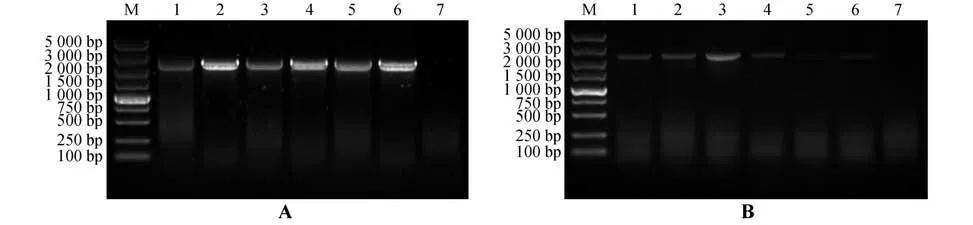
图2 植物表达载体pROKⅡ-Aeβ-AS的构建A.pROKⅡ-Aeβ-AS菌液PCR 检测(M.Marker;1~6.pROKⅡ-Aeβ-AS单菌落;7.阴性对照);B.农杆菌GV3101转化子的菌液PCR检测(M.Marker;1~6.GV3101农杆菌菌液PCR检测;7.阴性对照)Fig.2 Construction of plant expressional vector pROKⅡ-Aeβ-AS A.PCR identification of pROKⅡ-Aeβ-AS bacterial solution(M.Marker;1-6.pROKⅡ-Aeβ-AS single colony;7.Negative control);B.PCR identification of Agrobacterium GV3101 transforman(tM.Marker;1-6.PCR detection of GV3101 Agrobacterium;7.Negative control)
将测序正确的植物表达载体pROKⅡ-Aeβ-AS质粒,以冻融法转化农杆菌GV3101,涂含相应抗性的平板,随机挑选6 个单克隆经菌液PCR验证,得到6个目的条带(图2B),表明pROKⅡ-Aeβ-AS质粒成功转入农杆菌中,可进行下一步试验。
3.3 pROKⅡ-Aeβ-AS 载体在烟草中的遗传转化及PCR检测
用含有pROKⅡ-Aeβ-AS的农杆菌GV3101 侵染烟草叶片,共培养2 d(图3A)后,将其放于选择培养基上培养4 周左右,选择从叶片周围长出的抗性芽(图3B),切割分离后,接入含有卡那的生根培养基上生根培养4周(图3C)。非转基因的烟草会受到卡那霉素的抑制而生长缓慢,逐渐死亡,转基因烟草则会有抗性而正常生长。提取野生型和7个已获得抗性的转基因株系的基因组DNA,利用表1 中pROKⅡ-F 和pROKⅡ-R 为引物对其进行PCR 扩增检测(图3D),结果显示抗性植株中均含有目的基因,说明外源基因已经整合入烟草基因组中。

图3 转基因烟草的获得A.共培养烟草;B.筛选培养20 d;C.转基因植株;D.转基因植株的PCR 检测(M.Marker;P.阳性对照;WT.野生型;2、8、14、21、25、27、30.转基因株系;CK-.阴性对照)Fig.3 Identification of transgenic tobacco A.Co-cultured tobacco;B.Selected cultured for 20 d;C.Transgenic plant;D.PCR identification of different transgenic plants(M.Marker;P.Positive control;WT.Wild type;2,8,14,21,25,27,30.The transgenic plants with target gene;CK-.Negative control)
3.4 Aeβ-AS 基因在烟草不同组织器官表达差异分析
为了探究Aeβ-AS基因在烟草不同组织的表达差异,分别提取叶片、茎和根的总RNA,利用qRTPCR 检测Aeβ-AS基因的表达水平,同时以烟草Ntactin基因作为内参。结果如图4所示,结果表明Aeβ-AS基因在检测的不同组织中均有表达,且在叶片部位具有高表达,在根和茎部表达较低,存在明显的组织特异性。

图4 Aeβ-AS基因在转基因烟草中不同器官中的表达分析采用Duncan多重比较,不同小写字母表示差异显著(P<0.05);下同Fig.4 Expressional analysis of Aeβ-As gene in different organs of transgenic tobacco Duncan multiple comparison was used,and different lowercase letters indicated significant difference(sP<0.05);The same as below
3.4 转基因烟草Aeβ-AS 基因表达量及三萜含量检测
为了研究Aeβ-AS基因在不同转基因烟草株系中的表达情况,提取烟草叶片总RNA,进行实时荧光定量PCR 检测。结果如图5 所示:与野生型烟草相比,7 个转基因株系中均有Aeβ-AS基因的表达,基因相对表达量从高到低排序依次为:L30、L2、L8、L14、L25、L21、L27。随机选取4 个转基因株系及野生型烟草,并检测总三萜含量(图6),转Aeβ-AS基因烟草中三萜含量显著高于野生型烟草。

图5 Aeβ-AS基因在烟草中的相对表达量*表示与同期对照相比达显著水平(P<0.05);下同Fig.5 Relative expression level of Aeβ-AS gene in tobacco* Referred to a significant level compared with control group(P<0.05);The same as below
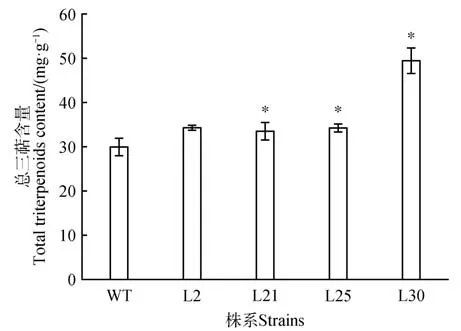
图6 烟草中三萜含量Fig.6 Triterpenoid content of tobacco lines
3.5 转基因烟草中关键酶基因表达分析
利用qRT-PCR 的方法检测了野生型与转基因烟草Aeβ-AS、NtFPS、NtSS、NtSE基因相对表达量,结 果 如 图7 所 示:转 基 因 烟 草Aeβ-AS、NtFPS、NtSS、NtSE基因的相对表达量显著高于野生型,其中株系L21 和L30 相对表达量显著高于其他株系及对照,株系L21 的NtFPS、NtSS基因的相对表达量最高;株系L30 的NtSE、Aeβ-AS基因的相对表达量最高。
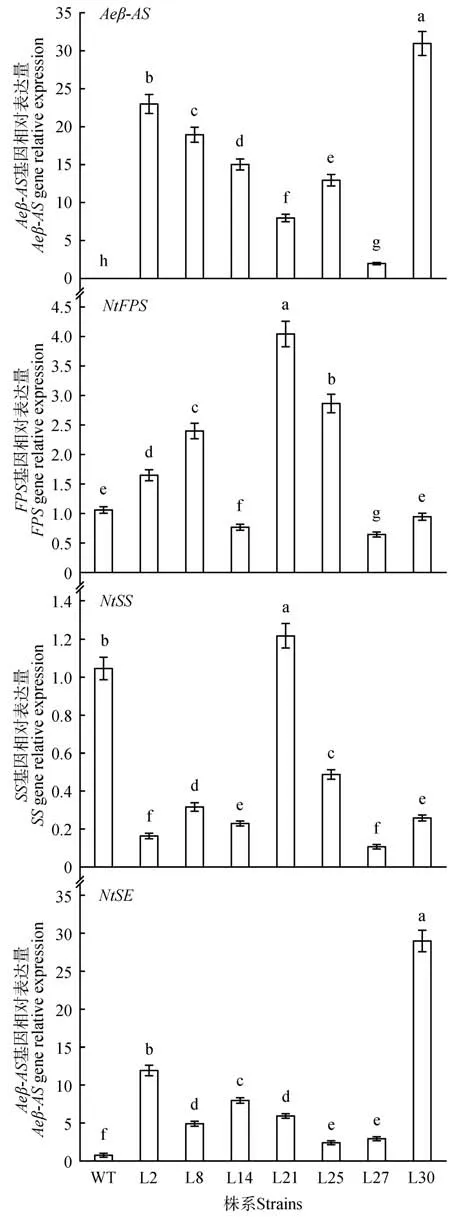
图7 烟草关键酶基因相对表达量Fig.7 Relative expression levels of key enzyme genes in tobacco
4 讨论
β-香树素合成酶(β-AS)为齐墩果烷型五环三萜皂苷合成途径中的一个关键限速酶,催化2,3-氧化角鲨烯合成β-香树素,进而影响植物体中三萜的含量。本研究旨在探讨龙牙楤木中Aeβ-AS基因对三萜皂苷合成的影响。查阅相关资料发现:张玉文等[21]通过RT-PCR 方法从藤茶(AmpeLopsis grossedentata)叶片cRNA 中扩增到香树脂醇合成酶基因,发现其在不同部位表达量不同。Jo 等[22]克隆得到了刺五加(Acanthopanax senticosus)Esβ-AS基因,并将其转入烟草中得到了β-香树素。本研究也将该基因转入烟草中,得到的转基因烟草也体现出了不同部位的表达差异,其中叶片中的表达量最高。将甘草和桔梗(Platycodon grandiflorus)β-AS基因分别转入酵母中,也可得到β-香树素[23-24],为提高三萜皂苷产量提供了新思路和参考。孙化鹏等[25]利用RACE 克隆技术克隆得到了洋常春藤(Hedera helix)中的β-AS基因,并通过qRT-PCR 技术分析发现了Hhβ-AS基因与常春藤皂苷含量之间存在明显的正相关性。部分研究发现,β-AS基因的表达量可以影响植物中三萜皂苷的含量。Zhao 等[26]对人参中Pgβ-AS基因进行干扰,发现β-香树素和齐墩果烷型皂苷的含量降低。陈勤等[27]在珠子参(Panax japonicus)细胞中同时过表达PjFPS和Pjβ-AS基因,发现了过表达PjFPS和Pjβ-AS的细胞系中,PJS 合成途径相关的多个关键酶基因的表达水平有不同程度的提高,且PJS的含量最高为普通细胞系的2.4 倍。虽然单独过表达PjFPS也可增加PJS的合成,但双基因(PjFPS和Pjβ-AS)协同调控PJS 合成的效果更好。本研究中获得的转基因烟草也可在β-AS基因的作用下利用其自身含有的β-香树素合成酶的前体物质2,3-氧化角鲨烯,合成相应的产物。对烟草总三萜含量进行检测,发现与野生型烟草相比,转基因烟草的总三萜含量显著升高,证明了合成Aeβ-AS基因并在烟草中进行异源转化,可以使转基因烟草内的总三萜含量显著升高。此结果为进一步将Aeβ-AS基因在龙牙楤木中过表达,研究其对产物含量的影响奠定基础。

