牛乳腺炎粪肠球菌cylA基因对牛外周血单核巨噬细胞完全吞噬功能的影响
王赞嘉,锡林高娃,吴金花,布日额,邢家辉,代牡兰
(1.内蒙古民族大学 生命科学与食品学院,通辽 028043;2.内蒙古自治区乳源性致病菌防控工程技术研究中心,通辽 028043;3.内蒙古民族大学 乳源性致病菌研究所,通辽 028043)
粪肠球菌(Enterococcusfaecalis)是革兰氏阳性兼性厌氧卵形球菌,其形成不同长度的链条状;粪肠球菌生存能力强,种类多样。具有在恶劣条件下(包括高盐环境)和宽幅度温度下(从10℃~45℃)生存的能力[1]。该细菌属于人及动物肠道中的常在菌,但同时也是一种机会致病菌,在动物免疫力低时可引起感染[2]。肠球菌属中有50多种成员,而且分布广泛,其中以粪肠球菌和屎肠球菌为主要成员,占环境分离菌株的80%以上,已成为仅次于金黄色葡萄球菌的第二大医源性感染致病菌[3]。
粪肠球菌的毒力基因聚集在一个毒力岛上。毒力岛基因长度在不同菌株之间只有微小差异,其长度约为150 kb,GC含量比基因组的其余部分低,两侧有末端重复序列[4]。尽管粪肠球菌具有致病潜力,但通常表现出较低的毒性水平,这可以从粪肠球菌作为大多数人类和动物胃肠道的天然定植菌,以及作为益生菌在人类和动物已使用了几十年实践来证明。在其毒力岛上,最主要的致病因子是cylA溶血素(Cytolysin,cylA),又称溶细胞素,在革兰氏阳性菌中较普遍存在,cylA溶血素对真核和原核细胞都具有杀伤作用[5]。可以使含有兔血的琼脂培养基上出现溶血现象。在各种动物模型中,携带cylA致病因子的粪肠球菌比不携带cylA菌株致病性更强[6]。
粪肠球菌在以往曾被用作“益生菌”菌株在使用,但是由于发现其携带重要致病因子cylA溶血素后,被重新审视其“益生性”而关注其“致病性”。导致粪肠球菌存在致病性的基因除cylA外,还有多种毒力因子,可以引起多种疾病,致病机制复杂,各种毒力因子共同协作,其毒力因子主要分为两种,其一为胞外分泌因子,如:丝氨酸蛋白酶(serine protease,sprE)、明胶酶(gelatinase,gelE),对宿主起到直接杀伤作用;另一种为表面蛋白,如:粪肠球菌表面蛋白(enterococcal surface protein,esp)、聚集物质(aggregation substance,AS)、胶原蛋白黏附素(adhesin of collagen,Ace)、肠球菌属亮氨酸富集蛋白(enterococcal leucine-rich protein A,elrA)、心内膜炎抗原(endocarditis antigen,efaA),多为黏附素并且参与生物膜的形成,负责细菌的粘附与定植。作为机会性致病菌,引起炎症反应需要具备相应的条件,免疫的第一道防线皮肤和黏膜会保护机体,不易被粪肠球菌感染。这时需要胞外分泌因子为粪肠球菌的粘附创造条件,而溶血素是分泌因子中最具杀伤力的,可以裂解真核细胞,使组织的完整性遭到破坏,为感染提供条件。因此,溶血素是使粪肠球菌具有致病性的主要毒力因子。
单核巨噬细胞是动物机体先天免疫系统的“第二道防线”[7],在动物机体抵御病原感染中发挥重要的吞噬、杀灭作用,对于维护机体的健康扮演着重要的角色,同时具有重要的免疫调节作用。单核巨噬细胞在遇到致病菌侵染时可以分泌IL-4、IL-10、TNF-α和NOS2等多种细胞因子,这些细胞因子中有的作为前炎性细胞因子,具有关键的免疫调节机制。粪肠球菌是乳腺炎的病原菌之一,通过未经巴氏杀菌的鲜牛乳的销售,有将致病性和耐药性的粪肠球菌通过食物链传递到人类的风险。因此,本实验拟观察牛乳腺炎粪肠球菌cylA基因对体外培养的牛单核巨噬细胞吞噬作用的影响,为研究粪肠球菌的免疫逃逸机制奠定基础。
1 材料与方法
1.1 菌株与细胞 奶牛乳腺炎粪肠球菌临床分离菌株BME1708和奶牛乳腺炎粪肠球菌cylA基因缺失突变株BME1708ΔcylA由“内蒙古自治区乳源性致病菌防控工程技术研究中心”保存备用;牛外周血单核巨噬细胞BMC-7购买自青旗(上海)生物技术发展有限公司。
1.2 主要试剂 DMEM、澳洲胎牛血清(FBS)购自GIBCO;台酚蓝、胰蛋白酶、PBS、100×三抗(青霉素、链霉素、两性霉素B)、DMSO、BHI培养基购自索莱宝公司。
1.3 主要仪器与设备 BSC-1100生物安全柜购自北京东联哈尔仪器制造公司;SHP-150智能生化培养箱购自上海鸿都电子科技公司;CKX41倒置显微镜、日本奥林巴斯、BPN-50CH CO2培养箱购自上海一恒科技有限公司;DM500光学显微镜购自德国莱卡。
1.4 牛乳腺炎粪肠球菌的鉴定 配制BHI固体及液体培养基,取出-80℃冰箱冻存备用的粪肠球菌菌株,于BHI液体培养基中活化。将活化后的粪肠球菌菌株于鲜血固体培养基上培养,12 h后观察结果是否出现溶血表型。挑取出现溶血表型的菌落接种于BHI液体培养基中,扩增后进行革兰氏染色镜检和糖发酵实验,对菌株进行鉴定。同时对cylA基因缺失突变株进行溶血活性检测。
1.5 牛外周血单核巨噬细胞的复苏 按90%DMEM+10%FBS+1% 100×三抗(青霉素、链霉素、两性霉素B)配制完全培养基。将冻存管从液氮罐中取出,直接浸入37℃温水中,并不时摇动令其尽快融化。用移液枪吸出细胞悬液,加到离心管并滴加5倍以上完全培养基混匀,1000 ×g离心10 min。弃去上清液,重悬离心管底部细胞沉淀,在T25培养瓶中加入5~6 mL完全培养基,计数,调整细胞密度,接种培养瓶,37℃培养箱静置培养。
1.6 牛外周血单核巨噬细胞的培养 将细胞分装至T25细胞培养瓶,加入完全培养基,置于37℃、5% CO2恒温培养箱中静置培养,每48 h换液一次。细胞愈合度达到80%时,进行传代,吸出完全培养基,PBS缓冲液轻冲洗3遍,加入胰酶2 mL消化(具体时间视细胞而定),待细胞成球形用完全培养基终止消化并将细胞冲洗下来。1000 ×g离心10 min,弃上清液收集细胞。重悬细胞,血细胞计数板计数。按每孔1.0×106个细胞,接种至12孔板,培养至贴壁。
1.7 牛外周血单核巨噬细胞的冻存 按90%FBS+10%DMSO配置细胞冻存液(现用现配)。取待冻存的细胞用2.0 mL胰酶消化2 min,用完全培养基将细胞冲洗下来。1000 ×g离心10 min,弃上清液收集细胞。加入1.0 mL细胞冻存液制成细胞悬液,装入3支冻存管中。冻存管在4℃下存放30 min,转放-20℃下放置1.5~2 h,再转入-70℃下放置4~12 h 后即可转移到液氮内(-196℃)。
1.8 粪肠球菌侵染牛外周血单核巨噬细胞台酚蓝染色观察 将粪肠球菌以100∶1的比例稀释后对巨噬细胞进行侵染,吸去细胞培养液,每孔加入1×108个BME1708或BME1708ΔcylA,37℃侵染30 min,加入三抗,PBS清洗两次,加入完全培养基。按照时间梯度2、4、8、12、24、48 h取样,台酚蓝染色,观察。计算吞噬率(phagocytic rate,PR)和吞噬指数(phagocytic index,PI)[8]。PR(%)=噬菌细胞数÷细胞总数×100%;PI=被噬菌总数÷噬菌细胞数。
2 结果
2.1 粪肠球菌溶血表型鉴定结果 野生型粪肠球菌在含有兔血的固体培养基上出现明显的β溶血圈,符合携带cylA溶血素基因的粪肠球菌溶血特性,cylA基因缺失突变株,无溶血素表达,无β溶血圈(图1)。
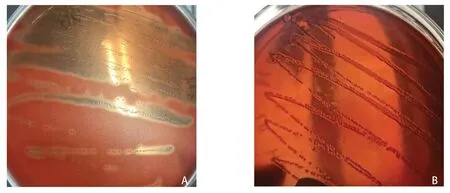
图1 粪肠球菌溶血表型鉴定Fig.1 Identification of hemolysis of Enterococcus faecalis
2.2 革兰氏染色镜检观察结果 活化后的BME1708菌株,经革兰氏染色后于光学显微镜油镜下观察,细菌呈紫色、椭圆形,形成长度不等的链条状排列(图2)。
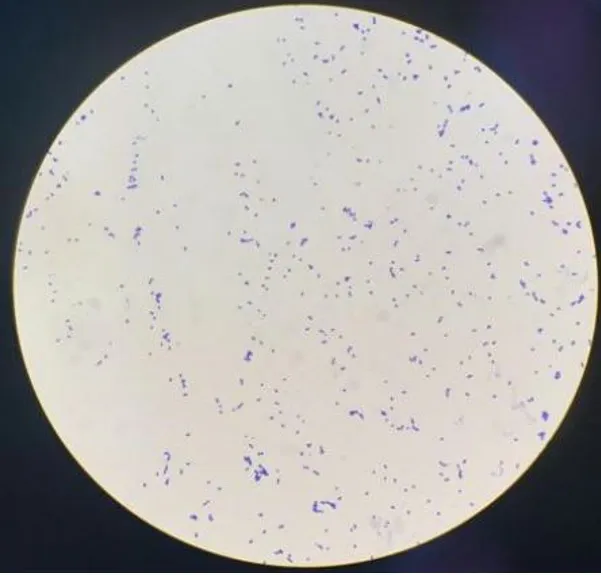
图2 粪肠球菌革兰氏染色镜检观察结果(2000×)Fig.2 Gram staining results of Enterococcus faecalis(2000×)
2.3 糖发酵实验结果 BME1708菌株对木糖、棉子糖发酵实验结果为阴性,对葡萄糖、果糖、半乳糖、蔗糖、乳糖、甘露醇、山梨醇和水杨素发酵实验结果为阳性,与粪肠球菌糖发酵特性相符。
2.4 牛外周血单核巨噬细胞培养结果 用倒置显微镜观察巨噬细胞生长状态。体外培养的巨噬细胞贴壁生长,呈梭形、圆形及椭圆形(图3)。实验发现0.25%的胰酶不易消化贴壁细胞,符合巨噬细胞具有强大贴壁能力的特点。
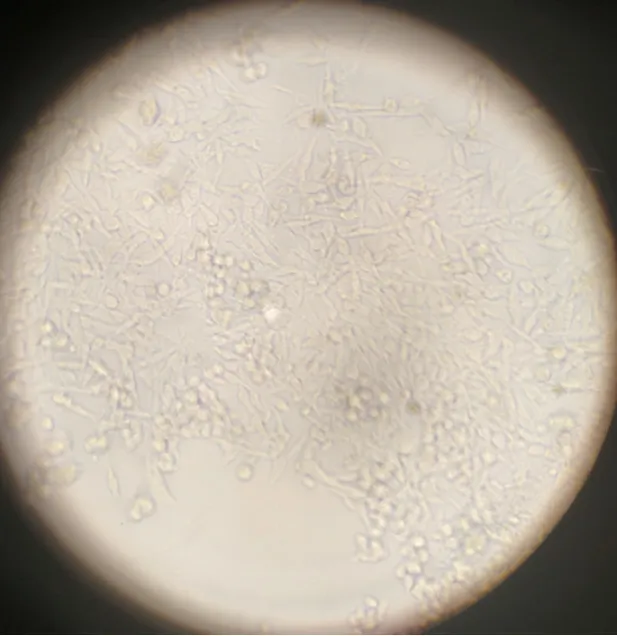
图3 巨噬细胞体外培养观察结果(1000×)Fig.3 Results of macrophage culture in vitro(1000×)
2.5 粪肠球菌侵染巨噬细胞台酚蓝染色观察结果 经利用BME1708和BME1708ΔcylA菌株对牛体外培养的单核巨噬细胞侵染实验后,结果表明,被巨噬细胞吞噬的粪肠球菌可以在细胞内存活,形成明显的吞噬泡,随着侵染时间的延长有部分巨噬细胞死亡(图4)。而且巨噬细胞对BME1708ΔcylA的吞噬率和吞噬指数明显高于BME1708,吞噬率和吞噬指数具有显著差异(P<0.05),表明牛乳腺炎粪肠球菌cylA基因对牛外周血单核巨噬细胞的完全吞噬功能具有一定的负调控作用。吞噬指数及吞噬率见表1和图5。
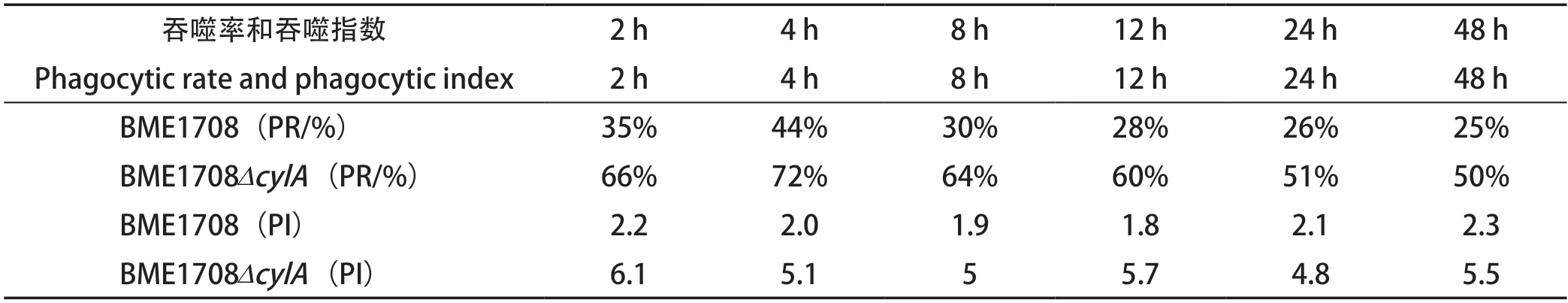
表1 吞噬率和吞噬指数Table 1 Phagocytic rate and phagocytic index
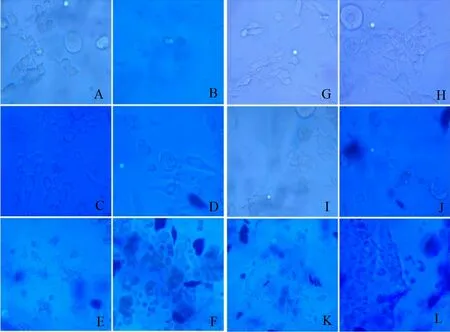
图4 粪肠球菌侵染巨噬细胞Fig.4 Enterococcus faecalis infection of macrophages
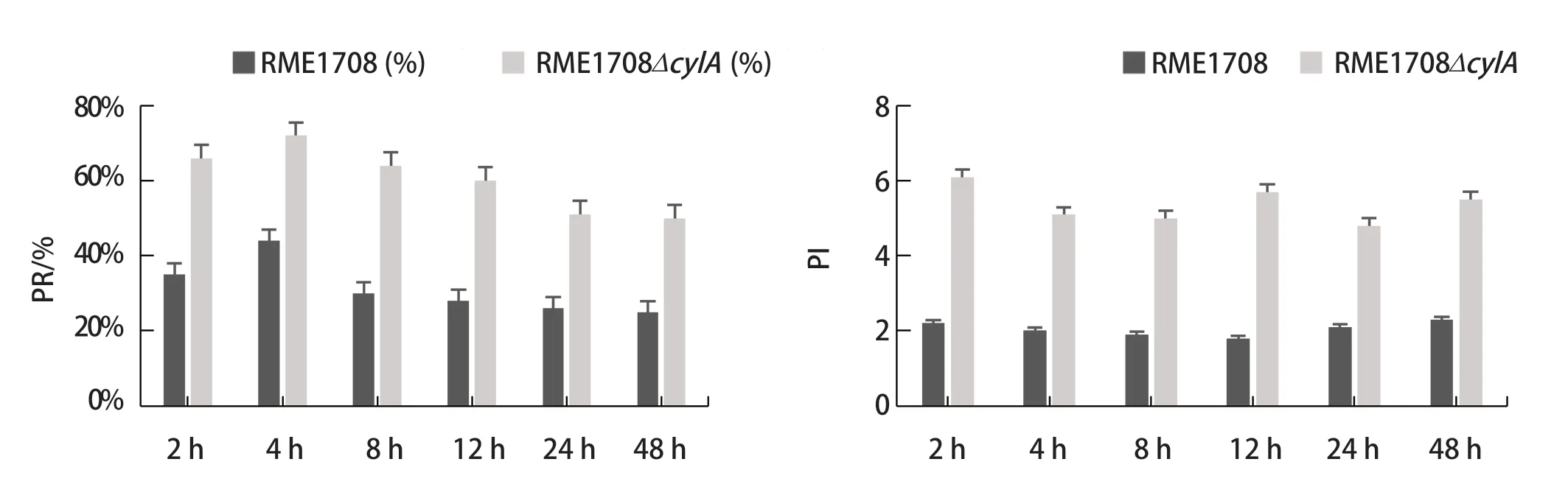
图5 BME1708及BME1708ΔcylA菌株侵染巨噬细胞的吞噬率(PR/%)和吞噬指数(PI)Fig.5 Phagocytosis rate(PR/%)and phagocytosis index(PI)of BME1708 and BME1708ΔcylA infected macrophages
3 讨论
过去,粪肠球菌在食品工业中被用作发酵剂,一些可以产生肠球素的菌株被用作生物防腐剂[9]。粪肠球菌的致病机制依赖于多种因素[10]。随着抗生素的过度使用,粪肠球菌的耐药性也逐渐增强,耐药性增强导致感染后的治疗难度加大,同时毒力基因更容易使粪肠球菌在宿主体内定植,使得近年来粪肠球菌感染率呈明显的上升趋势。
与其他致病菌不同的是粪肠球菌编码的毒力因子主要对宿细胞具有黏附作用。Różańska等[11]研究发现,从2000份患有乳腺炎的牛奶样本中分离出的肠球菌属的细菌中,粪肠球菌占85%,其中有45%的粪肠球菌具有3种以上的耐药表型。Yun等[12]对乳制品公司的散装牛奶中乳腺炎病原体的检测发现,粪肠球菌的含量仅次于葡萄球菌位居第二。Yoon等[13]从乳制品公司的散装牛奶中分离肠球菌,其中粪肠球菌占90.23%。这些研究成果表明,该致病菌在牛乳中的存在,足以构成牛乳及其产品的生物危害风险和公共卫生危害。
粪肠球菌现已成为奶牛乳腺炎的主要致病菌,根据对内蒙古自治区东部地区奶牛乳腺炎乳样的菌株筛查发现,粪肠球菌的分离率高达70%。在本研究中采用的奶牛乳腺炎粪肠球菌临床分离菌株BME1708的全基因组测序中发现,该菌具有27种抗生素耐药基因和82个相关毒力因子,并且发现了p38-MAPK信号通路的存在[14]。我们主要研究其中的关键毒力因子溶血素,而cylA基因编码的蛋白在溶血素的形成过程中起到最关键的激活功能[15]。本研究以粪肠球菌cylA基因阳性野生型菌株和cylA基因缺失突变株侵染巨噬细胞,发现cylA基因可以抑制单核巨噬细胞对粪肠球菌的吞噬作用。在48 h后野生型菌株在巨噬细胞内仍有“内生”的现象,推测cylA与粪肠球菌被单核巨噬细胞吞噬后的“内生”现象有关。
本研究为下一步利用BME1708和BME1708ΔcylA基因缺失突变株侵染巨噬细胞,根据IL-4、IL-10、TNF-α和NOS2等多种细胞因子的转录及表达差异情况,以及p38-MAPK信号通路的激活情况,来获得粪肠球菌“逃逸”单核巨噬细胞的吞噬及清除功能的分子机制奠定实验基础。为有效防控该致病菌提供新的思路。

