弓形虫GRA6-GRA2蛋白表达及检测应用
张 宁,刘 伟,吴铭洁,夏霖亚,王 蕾,殷玉和,石 晶,吴丛梅
(1.长春工业大学化学与生命科学学院,长春 130000;2.长春西诺生物科技有限公司,长春 130000)
弓形虫是一种胞内的原生动物寄生虫,感染几乎所有温血动物,全世界大约有30%的人口感染弓形虫[1-2]。在没有弓形虫疫苗上市的情况下,弓形虫给人类和畜牧业造成了严重的威胁。因此,弓形虫抗体的检测对于弓形虫病的早期诊断和治疗具有重要意义。
目前,王钊哲等[3]利用大肠杆菌对弓形虫表面抗原SAG1-SAG2重组抗原进行表达并纯化,将此蛋白作为检测抗原制备了胶体金试纸。朱传刚等[4]利用大肠杆菌BL21将GRA1-GRA7蛋白进行表达及纯化,并将GRA1-GRA7蛋白为标记抗原制备胶体金试纸检测猪弓形虫抗体。研究表明,弓形虫多种蛋白均可刺激机体产生免疫反应,所以筛选出敏感高、特异性强的抗原是研制弓形虫检测试剂的关键[5]。因此,本研究拟采用大肠杆菌表达GRA1-GRA7、SAG1和GRA6-GRA2三种蛋白,通过ELISA方法进行检测比较,选择具有较强敏感性的蛋白制备成胶体金免疫层析试纸,以期制备出敏感性高和特异性强的检测猫弓形虫抗体的试纸,为弓形虫病的早期治疗提供切实可行的检测手段。
1 材料与方法
1.1 材料与实验动物 感受态细胞ER2566由吉林大学艾滋病疫苗国家工程实验室提供和保存;DNA marker购自TaKaRa公司和北京全式金生物技术有限公司;限制性内切酶NdeⅠ和HindⅢ购自TaKaRa公司;氯金酸购自生工生物工程(上海)技术有限公司;硝酸纤维素膜(NC膜)购自德国赛多利斯公司;HRP标记羊抗猫IgG抗体、金黄色葡萄球菌A蛋白(SPA)、BSA购自Sigma公司;弓形虫间接血凝试剂盒购自中国农业科学院兰州兽医研究所。猫弓形虫阳性血清由事科学院军事医学研究院军事兽医研究所提供。猫细小病毒阳性血清、猫杯状病毒阳性血清和猫疱疹病毒阳性血清由长春西诺生物科技有限公司提供。
1.2 表达载体的鉴定 为了在大肠杆菌中表达和纯化GRA1-GRA7、SAG1和GRA6-GRA2蛋白,利用GeneOptimizer软件对弓形虫RH虫株的GRA1(GenBank登录号:HM067753.1)、GRA7(GenBank登录号:DQ459443.2)、SAG1(GenBank登录号:X14080)、GRA6(GenBank登录号:MH675993.1)和GRA2(GenBank登录号:HM014012.1)基因序列进行了密码子优化,由南京金斯瑞生物有限公司合成后连入载体pET-28a中,重组质粒经限制性内切酶NdeⅠ和HindⅢ酶切鉴定以及测序分析确认。
1.3 GRA1-GRA7、SAG1和GRA6-GRA2蛋白的表达和纯化 将重组质粒pET28a-GRA1-GRA7、pET28a-SAG1和pET28a-GRA6-GRA2分别转化至感受态细胞ER2566中,将重组质粒菌液分别接种于5 mL含卡那霉素抗性的LB培养基中,37℃、220 rpm摇菌过夜。以1∶100比例接种于500 mL含卡那霉素抗性的LB培养基中,37℃条件下220 rpm至OD600值为0.7左右。加入异丙基硫代-β-D-半乳糖苷(IPTG)使其终浓度为1 mmol/L,继续25℃、220 rpm培养16 h。10 000 ×g离心10 min,收集上清液和沉淀,采用His亲和层析柱对表达的重组蛋白进行纯化,最后进行SDS-PAGE电泳分析和Western blot鉴定。
1.4 ELISA检测蛋白敏感性 每孔加入3 μg/mL的目的蛋白100 μL,4℃包被过夜;PBST洗板3次,5 min/次,加入5%BSA封闭2 h;洗板后将猫弓形虫阳性血清作分别按1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128、1∶256、1∶512、1∶1024、1∶2048进行稀释,每孔加样100 μL,37℃孵育2 h;二抗选用HRP标记羊抗猫IgG抗体,最后检测三种蛋白敏感性,分别设置空白对照和阴性血清对照。根据检测结果选择出具有较好敏感性的蛋白。
1.5 胶体金最适pH和最适蛋白标记量的确定
1.5.1 最适pH的确定 用0.2 mol/L的K2CO3调节1 mL胶体金,分别加3、6、9、12 μL充分混匀,再向各管中加50 μL目的蛋白,混匀,静置30 min。再加入10%NaCl,充分混匀,静置2 h。观察颜色变化。选择开始无聚集胶体金颜色为红色的离心管,作为胶体金溶液最适K2CO3量,即最适pH值。
1.5.2 最适蛋白标记量的确定 用PBS缓冲液将待标记的1 mg/mL目的蛋白2倍稀释至1∶256,每个稀释度各取30 μL,并且加入调好pH的胶体金溶液125 μL,15 min后,每个稀释度加入125 μL 100 mg/mL的NaCl溶液,静置15 min,观察胶体金的颜色变化。
1.6 目的蛋白的胶体金标记 取调好pH值的胶体金溶液100 mL,快速搅拌下加入375 μL目的蛋白至胶体金溶液中,继续搅拌1 h。加入浓度为100 mg/mL的牛血清白蛋白使终浓度为10 g/L,封闭2 h。以7500 ×g离心20 min,吸取上清液溶液,沉淀物为初步纯化的金标抗原结合物,将沉淀用重悬液溶解,4℃保存备用。
1.7 胶体金试纸条的制备
1.7.1 组装 将标记好的金标抗原结合物用喷金划膜仪均匀的喷在300 mm×5 mm的玻璃纤维上,制成金标垫,37℃鼓风干燥2 h后,加入干燥剂于室温密封保存,选用的NC膜用喷金划膜仪将SPA作为检测线(T线)、兔抗弓形虫目的蛋白IgG作为质控线(C线),置于37℃ 2 h后,密封保存备用;然后按照包被好的NC膜、胶体金标记的玻璃纤维和吸水纸的顺序,依次贴在PVC底板上。
1.7.2 检测结果判定 首先将组装好的试纸条平放于桌面上,吸取适量待测血清于加样孔,室温静置10 min,判定结果。当T线和C线出现红色线时,结果判定为阳性;当T线未有红色线,C线处出现红色线,结果判定为阴性;当C线不出现红色线时,说明此试纸条无效。
1.8 胶体金试纸条的评价
1.8.1 试纸条敏感性检测 将阳性血清进行不同倍数稀释,按照上述1.7.2检测方法操作,每个稀释度检测3次,观察试纸条检测结果。
1.8.2 试纸条特异性检测 用组装好的试纸条检测已知的猫细小病毒阳性血清、猫杯状病毒阳性血清和猫疱疹病毒阳性血清,并根据上述标准进行结果判定。
1.9 临床样本检测 用组装好的胶体金试纸对长春地区某宠物医院的289份猫血清进行检测,并与间接血凝法(indirect heamagglutination assay,IHA)进行比较。
2 结果
2.1 表达载体的构建 将优化的GRA1-GRA7、SAG1和GRA6-GRA2基因序列连入载体pET-28a,用限制性内切酶NdeⅠ和Hind Ⅲ分别对pET28a-GRA1-GRA7、pET28a-SAG1和pET28a-GRA6-GRA2进行双酶切。结果表明,重组质粒pET28a-GRA1-GRA7、pET28a-SAG1和pET28a-GRA6-GRA2构建正确(图1)。
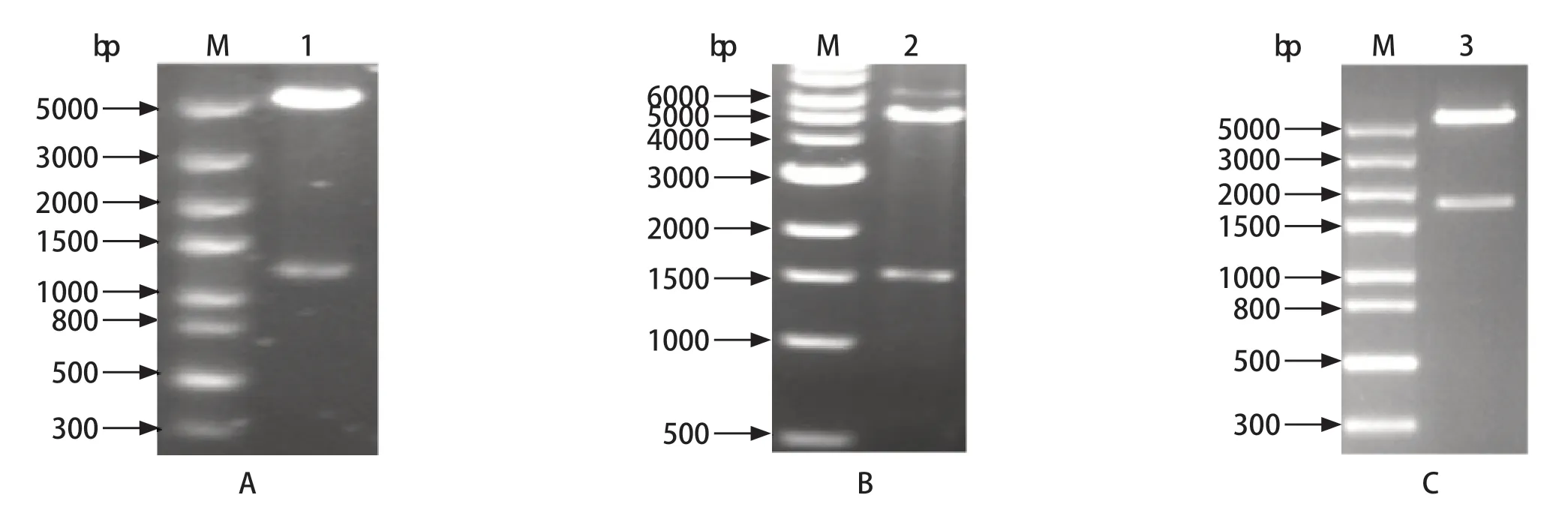
图1 重组质粒pET28a-GRA1-GRA7(A)、pET28a-SAG1(B)和pET28a-GRA6-GRA2(C)双酶切鉴定Fig.1 Identification of recombinant plasmids pET28a-GRA1-GRA7 (A),pET28a-SAG1 (B) and pET28a-GRA6-GRA2 (C)
2.2 GRA1-GRA7、SAG1和GRA6-GRA2蛋白的表达和纯化 pET28a-GRA1-GRA7、pET28a-SAG1和pET28a-GRA6-GRA2经IPTG诱导后收集菌体,进行SDS-PAGE,以pET-28a载体为对照,GRA1-GRA7蛋白在约50 kDa处可见特异性条带(图2),SAG1蛋白在约56 kDa处可见特异性条带(图3),GRA2-GRA6蛋白在约64 kDa处可见特异性条带(图4),分子质量与目的蛋白一致,并且收获到的蛋白纯度高于85%。Western blot结果显示目的蛋白能与鼠源弓形虫阳性血清产生特异性反应(图2B、图3B、图4B),证明表达产物有较好的抗原特异性。

图2 GRA1-GRA7蛋白SDS-PAGE和Western blot鉴定Fig.2 SDS-PAGE and Western blot analysis of GRA1-GRA7 protein
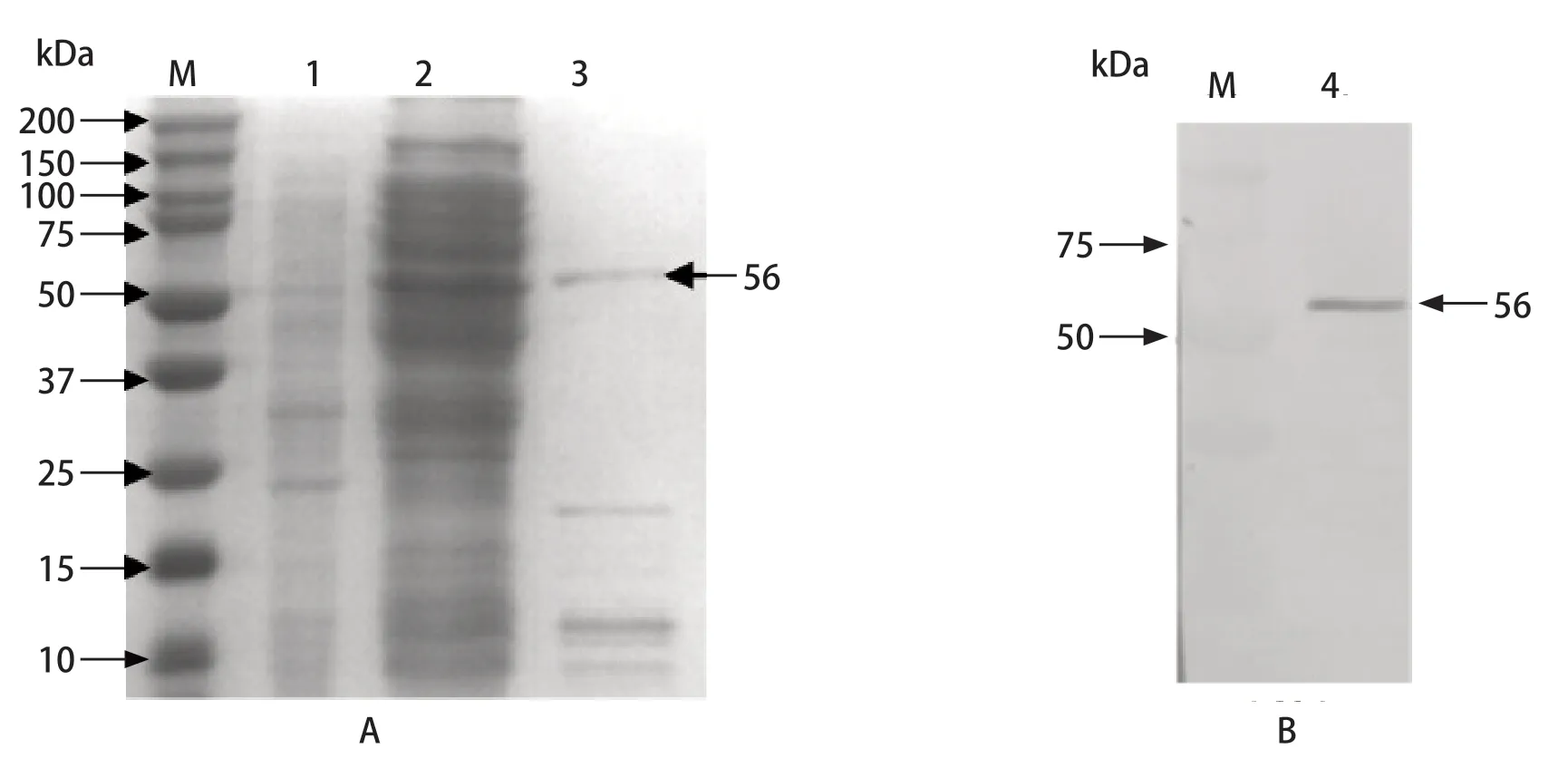
图3 SAG1蛋白SDS-PAGE和Western blot鉴定Fig.3 SDS-PAGE and Western blot analysis of SAG1 protein
2.3 ELISA检测蛋白敏感性结果 分别利用GRA1-GRA7、SAG1和GRA6-GRA2蛋白进行包被,倍比稀释猫弓形虫阳性血清作为一抗进行孵育,ELISA检测三种蛋白的敏感性,结果可知,GRA6-GRA2蛋白具有较好的抗原反应性(表1)。
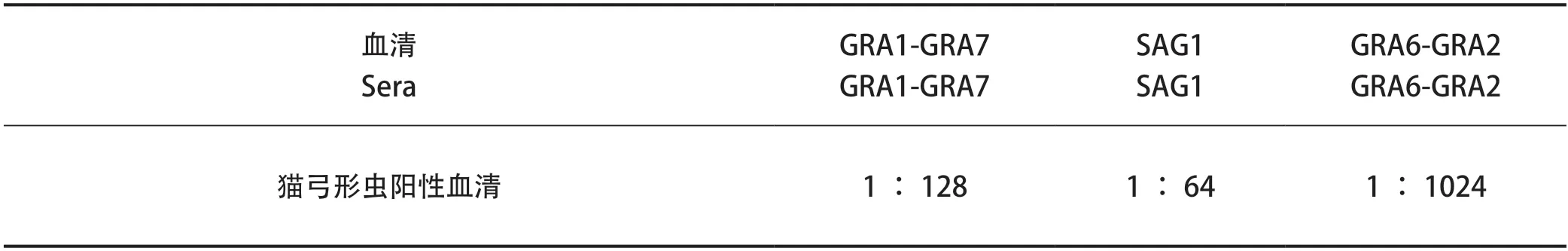
表1 ELISA检测蛋白敏感性结果Table1 The result of protein sensitivity of ELISA test

表2 临床样本胶体金免疫层析检测试纸检测结果Table 2 The results of colloidal gold immunochromatographic test strip in clinical samples
2.4 胶体金最适pH和最适蛋白标记量的确定 用0.2 mol/L K2CO3调节胶体金的pH值,1 mL胶体金当加入12 μL的0.2 mol/L K2CO3时,胶体金溶液的颜色由蓝色变红色,结果可知,最终结果表明1 mL胶体金加入12 μL 0.2 mol/L K2CO3为最适pH值(图5)。调节胶体金pH值后,加入GRA6-GRA2蛋白,用蛋白浓度梯度的方法,结果可知,在第6到第7个孔处溶液有红变蓝,最终表明第6孔处为最适标记蛋白标记量,蛋白标记量为3.75 μg/mL(图6)。

图5 胶体金标记GRA6-GRA2蛋白最适pH值确定Fig.5 Determination of the optimal pH value of GRA6-GRA2 protein labeled with colloidal gold

图6 最适标记蛋白标记量的测定Fig.6 Determination of optimal labeling protein labeling amount
2.5 敏感性检测 将猫弓形虫阳性血清倍比稀释,如图7所示,检测弓形虫阳性血清稀释至1∶256时,试纸条的检测结果判定为阳性,弓形虫阳性血清稀释至1∶1024时,检测结果为阴性。本试纸条可检测稀释至1∶256的弓形虫阳性血清。

图7 弓形虫抗体胶体金免疫层析试纸条敏感性的检测结果Fig.7 The detection result of sensitivity test of Toxoplasma antibody colloidal gold immunochromatographic test strip
2.6 特异性检测 用弓形虫抗体胶体金免疫层析试纸条对已知的猫弓形虫阳性血清、猫细小病毒阳性血清、猫杯状病毒阳性血清和猫疱疹病毒阳性血清进行特异性检测,结果见图8,试纸条检测猫细小病毒阳性血清、猫杯状病毒阳性血清和猫疱疹病毒阳性血清时,只有质控线出现一条红的线,检测线不出现红色条带,为阴性结果,说明试纸特异性良好。
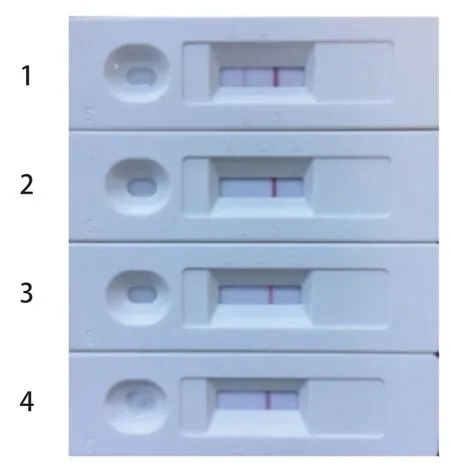
图8 弓形虫抗体胶体金免疫层析试纸条特异性的检测结果Fig.8 The detection result of specificity test of Toxoplasma antibody colloidal gold immunochromatographic test strip
2.7 临床样本检测结果 对长春6家宠物医院共289份猫待检血清进行检测,结果表明,采用胶体金试纸条检出7份阳性血清,阳性率为2.42%;IHA检出6份阳性血清,阳性率为2.07%,二者检测的符合率为99.5%,这可能与猫处于弓形虫感染早期抗体水平低有关,由于检测样本为临床样本,很难追踪猫个体情况,因此未对此差异样本进行进一步的分析检测。
3 讨论
研究表明可作为诊断抗原的有SAG1、SAG2、SAG3、GRA1、GRA7、GRA6和GRA2蛋白等。SAG1为弓形虫的表面蛋白,是诱导宿主免疫应答的主要靶抗原,可以诱导机体产生IgG、IgM、IgA、IgE等多种抗体,也是目前国内外研究较多的具有强免疫原性的诊断分子[6]。GRA1、GRA7、GRA2和GRA6蛋白都属于致密颗粒蛋白(dense granule,GRAs),它们参与弓形虫在宿主细胞内的纳虫空泡(PV)和PV膜的修饰以维持细胞内寄生,保护纳虫泡内虫体的存活[7]。本研究选择SAG1、GRA1-GRA7和GRA6-GRA2蛋白进行筛选,结果表明GRA6-GRA2蛋白的敏感性高于SAG1、GRA1-GRA7蛋白的敏感性,最高可检测稀释至1∶1024的猫弓形虫阳性血清,因此,GRA6-GRA2蛋白检测弓形虫抗体具有良好的抗原反应性。
GRA2蛋白在弓形虫的缓殖子时期和速殖子时期均存在,是潜在的抗原标记物,可诱发较强的抗体反应[8]。GRA2是由185个氨基酸组成的多肽,其中185个氨基酸中包含3个α螺旋的两性区域,其中一个α螺旋区域可以结合该蛋白的C端和N端,从而诱导纳虫泡的形成[9]。目前研究表明GRA2在感染弓形虫急慢性期中是普遍存在的,它至少有3个B细胞表位和1个T细胞表位,可以诱发机体产生一系列的抗体,激活CD4+T细胞,诱导机体产生免疫保护[10]。Ching等[11]用重组蛋白GRA2蛋白采用Western blot方法对弓形虫阳性血清进行检测,结果表明GRA2蛋白抗原能区分近期感染和既往感染。GRA6蛋白具有比较强的抗原活性,可以刺激机体产生抗体,在缓殖子和速殖子期均可表达,它不含内含子,是单拷贝基因,有一个开放阅读框大小为735 bp,可以编码230个氨基酸。Lecordier等[12]将GRA6开放阅读框序列基因全部导入pGEX表达载体中,结果发现只有编码N端的重组抗原能被感染弓形虫的人血清所识别,表明GRA6 N端多肽含有抗原表位能被B淋巴细胞识别,用GRA6 N端的亲水蛋白多肽构建的重组抗原可以检测弓形虫感染者血清IgG(ELISA)并且敏感性可达96%。而GRA2同GRA6可以形成一个多聚复合体,它是构成纳虫泡网络结构形成的关键因子[13]。Amina等[14]研究结果表明GRA6可能通过稳定GRA2诱导膜小管对纳虫泡管网络的形成起重要作用。因此,本研究独特的选用了GRA6-GRA2进行重组,对于猫弓形虫阳性血清表现出较高的敏感性,可以作为弓形虫抗体检测的特异性抗原,为弓形虫抗体检测技术的开发提供了保障。
弓形虫病是一种常见的人畜共患病。目前,对该病的诊断和检测方法主要有IHA法,但此方法的敏感性较低,易出现漏检现象。而ELISA、PCR技术等虽然敏感性较高、特异性较强,但操作较复杂,不适合大规模筛查检测,存在普遍的局限性。为了提高弓形虫检测的敏感性,缩减检测的时间,并减轻检测人员的工作负担,本研究利用GRA6-GRA2重组蛋白作为胶体金试纸的诊断抗原进行猫弓形虫抗体检测。此试纸可以检测到阳性血清稀释至1∶256的结果,同时还具有良好的特异性,适用于弓形虫病的早期诊断。
经流行病学调查显示,2016年,张启龙等[15]对北京地区835份猫血清进行检测,检出弓形虫阳性率为1.92%;2017年,夏春芳等[16]针对伊宁市40份猫血清进行检测,检出弓形虫阳性率为33.3%;2018年,禹海杰等[17]对嘉兴市256份猫血清进行检测,检出弓形虫阳性率为11.3%;2019年,韩云珍等[18]对福州城区221份猫血清进行检测,检出弓形虫阳性率为2.71%,说明不同地区的猫都存在着一定的弓形虫流行率。本研究针对2020年长春6家宠物医院共289份猫血清进行胶体金检测,并与IHA进行对比,结果胶体金试纸条阳性检出率为2.42%,IHA阳性检出率为2.07%,二种方法的符合率为99.5%,这一结果与王艳华等[19]的比较胶体金试纸与IHA两种方法的结果相符合,同时说明长春地区的猫存在着一定的弓形虫流行率,威胁着人与动物的生命健康,因此对弓形虫病的诊断试剂盒的开发和研究有着重要意义。
本研究结果表明,利用GRA6-GRA2重组蛋白制备的胶体金试纸,具有良好的敏感性和特异性,可以应用于弓形虫病的早期诊断。

