弓形虫鸡尾酒DNA 疫苗的免疫保护作用研究
何金灵,杜荣起,郑淇月,宋淇淇,张东超,通信作者,金天明
(1. 天津农学院 动物科学与动物医学学院 天津市农业动物繁育与健康养殖重点实验室,天津 300392;2. 天津市农业科学院,天津 300192)
弓形虫又称刚地弓形虫(Toxoplasma gondii,T. gondii),于1908 年由法国学者在北非刚地梳趾鼠的肝脾单核细胞内发现[1],是严格的专性细胞内寄生虫,几乎能够侵染所有温血动物的有核细胞[2]。弓形虫病传播范围广,全球约有30%的人口遭受弓形虫威胁[3-4]。虽然大多数人感染弓形虫症状轻微或无症状,但当机体在免疫缺陷情况下(如艾滋病人、器官移植病人或放射治疗病人)或妊娠期妇女在孕期感染弓形虫将会出现严重的临床症状,甚至引发死亡[5-6]。还有研究发现,弓形虫感染也可能会导致自闭症、精神分裂、精神抑郁等精神性疾病[7-8]。此外,弓形虫病还会给畜牧养殖业带来巨大的经济损失,严重阻碍畜牧养殖业发展[9]。目前,乙胺嘧啶和磺胺嘧啶联合用药是治疗弓形虫病最有效的策略。然而,药物具有明显的副作用,且仅能杀灭速殖子阶段弓形虫[10]。因此,目前亟需研制安全且有效的弓形虫疫苗来防控弓形虫病。
棒状体蛋白(ROPs)是弓形虫入侵宿主早期分泌的一类重要蛋白。其中,ROP5 蛋白是在弓形虫入侵宿主细胞的过程中合成的,可以与ROP17结合;将ROP5 敲除后弓形虫强毒株将失去毒力,这表明ROP5 是弓形虫入侵宿主细胞过程中关键的毒力因子[11]。ROP9 蛋白在弓形虫入侵过程中发挥重要作用,弓形虫ROP9 基因缺失可导致弓形虫感染力下降[12]。ROP17 能够磷酸化宿主细胞的Irgb6 并阻断其向弓形虫纳虫泡聚集,从而使弓形虫逃避巨噬细胞清除,是ROP2 家族中重要的毒力因子之一[13]。而且,此三种蛋白均具有较好的致病性和免疫原性。因此,ROP5、ROP9 和ROP17可以作为弓形虫疫苗的候选抗原。
本研究通过构建重组真核表达载体pVAX1-ROP5、pVAX1-ROP9 和pVAX1-ROP17,混合制成鸡尾酒DNA 疫苗,免疫小鼠,检测小鼠的体液免疫和细胞免疫反应,评估疫苗对小鼠免疫后攻虫保护效果。研究结果将为弓形虫新型疫苗研发提供参考和借鉴。
1 材料与方法
1.1 载体、细胞、虫株和感受态细胞
大肠杆菌感受态DH5α 购自生工生物工程(上海)股份有限公司,pVAX1 载体和HE293 细胞由天津农学院预防兽医学实验室保存,引形虫RH株由华中农业大学申邦教授惠赠。
1.2 试验动物
48 只18~20 g健康的雄性SPF级昆明小鼠[许可证编号:SCXK(京)2017-0005],购自中国食品药品检定研究院。
1.3 主要试剂
DNA 限制性内切酶XhoⅠ、EcoR I 和BamHⅠ购自生工生物工程(上海)股份有限公司。2×TaqMaster Mix 酶、DL2502marker、T4DNA 连接酶均购自上海捷瑞生物工程有限公司。RIPA 裂解液和Lip2000 购自北京索莱宝科技有限公司。HRP标记的山羊抗鼠IgG、Flag 标签鼠单克隆抗体IgG均购自上海碧云天生物技术有限公司。小鼠IL-6 ELISA 检测试剂盒、小鼠IFN-γ ELISA 检测试剂盒购自武汉默沙克生物科技有限公司。
1.4 引物设计
根据 NCBI 数据库中 ROP5(GenBank:EF466101.1)、ROP9(GenBank:XM_002366831.2)和ROP17(GenBank:XM_002365031.1)的基因CDS 序列,分别设计其特异性引物,在5'端添加保护性碱基和酶切位点序列,下游引物添加标签序列(见表1),引物序列及目的基因CDS 序列由生工生物工程(上海)股份有限公司合成,合成的目的基因连接至pMD19-T 载体。

表1 目的基因的引物序列及PCR条件
1.5 重组真核表达质粒 pVAX1-ROP5/ROP9/ROP17 构建
利用选取的DNA 限制性内切酶BamH I/Xho I、BamH I/EcoR I 和BamH I/Xho I 分别双酶切质粒pMD-ROP5、pMD-ROP9、pMD-ROP17 和真核表达质粒pVAX1,再根据胶回收试剂盒说明书回收目的基因和pVAX1 载体片段。使用T4DNA 连接酶将回收的目的基因与pVAX1 载体片段连接,并转化连接产物至大肠杆菌感受态DH5α,挑取单克隆,进行菌液PCR 并测序验证阳性菌。菌液PCR反应体系为:1 µL 上游引物F、1 µL 下游引物R、10 µL 2×Taq Master mix、6 µL ddH2O、2 µL 菌液。设置PCR 条件:94 ℃预变性5 min,{94 ℃变性30 s,退火45 s(退火温度见表1),72 ℃延伸1 min},共30 个循环,72℃总延伸10 min。将构建成功的真核表达载体分别命名为pVAX1-ROP5、pVAX1- ROP9 和pVAX1-ROP17。
1.6 目的蛋白在真核细胞中表达验证
利用质粒大提试剂盒分别提取无内毒素质粒pVAX1-ROP5、pVAX1-ROP9 和pVAX1-ROP17。取24 μL Lip2 000 分别与4 µg 上述质粒混匀后,转染至长有80% HEK293 细胞的6 孔培养板中,48 h 后加入胰酶消化细胞,1 000 r/min 离心10 min收集细胞。用含有1%蛋白酶抑制剂的RIPA 裂解液冰上裂解细胞,制备蛋白样品。各蛋白样品进行Western blot 检测,Flag 标签小鼠单克隆抗体作为一抗,小鼠抗GADPH 单克隆抗体为内参蛋白的一抗;HRP 标记的山羊抗鼠作为二抗。
1.7 疫苗混合免疫小鼠
将48 只小鼠随机分成3 组,每组16 只,分别为混合免疫组(pVAX1-ROP5、pVAX1-ROP9和pVAX1-ROP17 质粒按照1∶1∶1 混合免疫)、空载体组(pVAX1 质粒免疫)和生理盐水组。免疫组和空载体组按照100 μg/只的剂量对小鼠进行腿部肌肉注射,生理盐水组进行等体积肌肉注射。初次免疫后四周,加强免疫一次。
1.8 血清中抗体水平分析
免疫后,每两周尾尖采血一次,分离血清。从小鼠体内收集并纯化弓形虫速殖子5×108个,加入5 mL 1×PBS 重悬虫体,利用超声破碎仪破碎虫体,获得全虫抗原,将浓度稀释为5 µg/mL包被ELISA 酶标板。利用间接ELISA 方法检测血清中抗体水平,在波长450 nm 下测定吸光度值。
1.9 淋巴细胞增殖分析
加强免疫后两周,取每组6 只小鼠,处死后,采集脾脏研磨,收集脾细胞,制成密度为1×107个/mL 脾细胞。按照1×105个细胞/100 µL/孔将各组脾细胞加入96 孔培养板中,每组设3 孔重复。各组分别加入50 µL 全虫抗原刺激,并将96 孔板置于37℃、5% CO2培养箱中培养72 h,利用CCK8试剂盒和酶标仪检测OD450,并计算增殖指数(SI)。
1.10 细胞因子检测
按照1.9 中方法体外培养脾淋巴细胞,利用全虫抗原刺激脾淋巴细胞,并收集脾细胞培养上清液。利用细胞因子ELISA 检测试剂盒,根据说明书检测上清液中IFN-γ 和IL-6 细胞因子的水平。
1.11 免疫小鼠的攻虫保护效果
收集和纯化感染弓形虫RH 株的小鼠腹腔中的虫体,计数后并用1×PBS 将虫体重悬。小鼠加强免疫后14 天,分别对各组10 只小鼠按500 个/只的计量腹腔注射虫体,每日观察小鼠的状态和存活情况。
1.12 统计学分析
采用GraphPad Prism 7.0 进行统计分析和制图,利用双因素方差分析各免疫组间抗体水平差异,单因素方差分析各免疫组间淋巴细胞增殖及细胞因子水平差异,免疫小鼠攻虫后的生存曲线利用Logrank(Mantel-Cox test)和 Gehan-Breslow-Wilcoxon test 方法统计分析。“**”表示P<0.01,为差异极显著;“*”表示P<0.05,为差异显著;P>0.05,为差异不显著。
2 结果
2.1 重组真核表达质粒构建
分别对构建的3 种重组质粒进行双酶切和PCR 扩增验证。产物电泳结果显示:pVAX1-ROP5经BamH I 和Xho I 双酶切后,约在1 686 bp 左右出现目的条带,经测序发现与目的基因ROP5 片段大小完全一致,且无碱基突变、缺失和增添(图1A)。pVAX1-ROP9 和pVAX1-ROP17 质粒经双酶切后,与pVAX1-ROP5 相似,分别获得1 128 bp和1 836 bp 大小的条带,经测序与预期ROP9 和ROP17 基因片段大小均相符,且无碱基突变、缺失和增添(图1B 和图1C)。

图1 重组真核表达载体的双酶切与PCR 鉴定结果
2.2 目的蛋白表达验证
重组质粒pVAX1-ROP5、pVAX1-ROP9 和pVAX1-ROP17 转染至HEK293 细胞后,Western blot 检测发现,分别在约为62、41 和68 kDa 处出现目的条带,与预期蛋白分子量大小相符(图2)。且内参蛋白GAPDH 在各转染细胞中均可检测到。
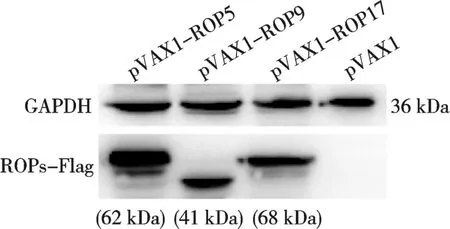
图2 重组真核表达质粒在HEK293细胞中表达的Western blot 验证
2.3 抗体水平检测
抗体检测结果发现,初次免疫时,混合疫苗组(pVAX1-ROP5/ROP9/ROP17)与生理盐水组和空载体组(pVAX1)小鼠之间的抗弓形虫抗体IgG 水平差异不显著(P>0.05,图3);在初次免疫后28天及加强免疫后14 天,混合疫苗组小鼠产生的抗弓形虫抗体IgG 水平均极显著高于生理盐水组和空载体组(P<0.01)。在整个免疫过程中,生理盐水组和空载体组相比,其小鼠产生的抗弓形虫抗体IgG 水平差异均不显著(P>0.05,图3)。
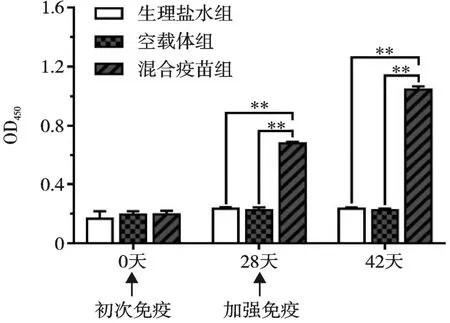
图3 小鼠免疫后的抗体水平
2.4 小鼠脾淋巴细胞增殖分析
小鼠脾淋巴细胞在体外经全虫抗原刺激后,检测发现混合疫苗组小鼠脾淋巴细胞的SI 值极显著高于空载体组和生理盐水组(P<0.01),且空载体组与生理盐水组之间差异不显著(P>0.05,图4)。
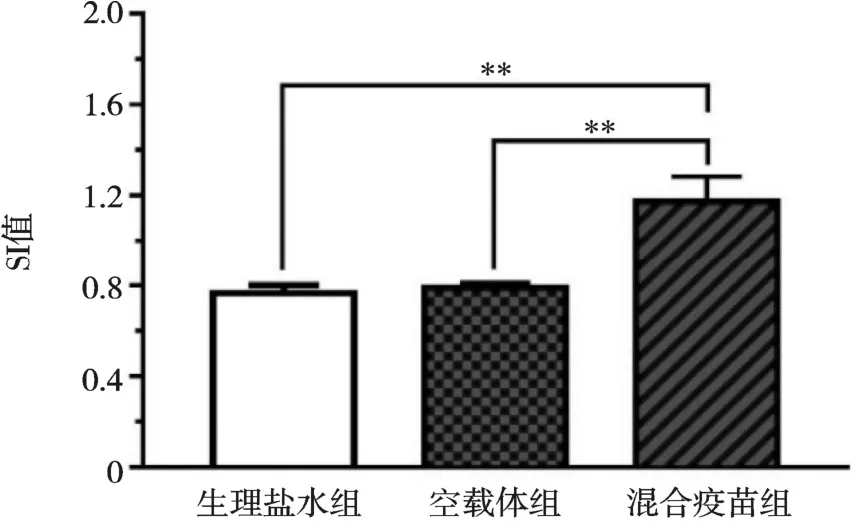
图4 免疫小鼠脾淋巴细胞增殖水平
2.5 细胞因子的检测结果
加强免疫14 天后,利用ELISA 试剂盒检测小鼠脾淋巴细胞经全虫抗原刺激后产生的细胞因子水平。结果显示:混合免疫组小鼠淋巴细胞产生IFN-γ 的水平极显著高于空载体组和生理盐水组(P<0.01,图5A),与其相似,混合免疫组小鼠淋巴细胞产生IL-6 的水平极显著高于空载体组和生理盐水组(P<0.01,图5B)。无论是IFN-γ 还是IL-6 水平,在空载体组和生理盐水组之间差异均不显著(P>0.05,图5A 和图5B)。

图5 免疫小鼠脾淋巴细胞经全虫抗原刺激后产生的IFN-γ(A)和IL-6(B)水平测定结果
2.6 免疫小鼠的攻虫保护效果
生理盐水组和空载体组小鼠在攻虫后第8~10 天内全部死亡;而混合疫苗组小鼠攻虫后12天内均无死亡,从第13 天开始出现死亡,直至第19 天全部死亡(图6)。混合疫苗组小鼠平均存活时间(16.1±2.07)比空载体组小鼠(9.2±0.74)和生理盐水组小鼠(9.0±0.77)的平均存活时间极显著延长(P<0.01)。而且,空载体组和生理盐水组小鼠之间平均存活时间差异不显著(P>0.05,图6)。

图6 免疫小鼠攻虫后的生存曲线
3 讨论
弓形虫病是由弓形虫引起的一种全世界范围内的人兽共患食源性寄生虫病,严重威胁着人类和动物的健康,给畜牧养殖业带来巨大的经济损失。疫苗免疫是预防和控制传染病的有效方法[14]。目前,Toxovax®是唯一商品化的弓形虫疫苗,但仅能应用于绵羊[15]。当前弓形虫疫苗研发面临着诸多问题,如灭活疫苗免疫保护力低下、弱毒疫苗存在毒力返强风险、亚单位疫苗免疫原性低、基因缺失疫苗不成熟等[15]。因此,研发新型弓形虫疫苗是防控弓形虫病的新思路。本研究构建了新型弓形虫鸡尾酒DNA 疫苗,并对其诱导小鼠产生的体液免疫反应、细胞免疫反应及免疫后攻虫保护效果进行了评价。
当前弓形虫疫苗研制有多种类型且免疫策略各异,对小鼠的免疫保护效果各有不同。目前,对于弓形虫鸡尾酒疫苗研制已有报道,疫苗均表现出较好的免疫效果。KHOSROSHAHI 等[16]用构建的真核表达质粒 pcDNA3.1-SAG1-ROP2 和pIL-12 混合免疫小鼠,能够刺激小鼠产生体液免疫,且Th1 型细胞免疫水平(IFN-γ和IL-2 细胞因子水平)显著高于单基因对照组。王燕娟等[17]将构建的真核表达质粒pShuttle-SAG1、pLVXZsgreenMIC3 和pLVX-rfp-ROP2 混合免疫小鼠,诱导机体产生的抗体水平显著高于单基因免疫组小鼠。RAHIMI 等[18]利用构建的pcROM4、pcGRA14及佐剂CaPNs 混合免疫小鼠,与单基因对照组相比,能够诱导小鼠产生较高水平的体液免疫,而且小鼠接种弓形虫RH 强毒株后,明显延长了存活时间。本研究将构建的真核表达质粒pVAX1-ROP5、pVAX1-ROP9 和pVAX1-ROP17 混合免疫小鼠,加强免疫一次后,能够极显著提高小鼠抗弓形虫的特异性抗体和细胞因子水平,极显著延长小鼠的存活时间,本疫苗的免疫保护效果与上述文献报道的结果相似。
弓形虫棒状体蛋白在虫体入侵过程中发挥重要作用。其中,ROP5 是弓形虫入侵宿主细胞的一个重要毒力因子,研究发现,用pROP5/ROP7 重组DNA疫苗免疫小鼠可激发小鼠的体液免疫和细胞免疫反应,并能减少小鼠脑包囊和延长小鼠的存活时间[19]。ROP9 是弓形虫入侵宿主细胞的早期分泌蛋白,小鼠免疫pVAX1-TgROP9 DNA 疫苗,不但能够诱导高抗体水平和分泌大量IFN-γ、IL-2,而且接种T. gondiiRH 速殖子小鼠的存活时间也明显延长[20]。ROP17 在弓形虫入侵宿主过程中与ROP5 和ROP18 协同发挥免疫作用,逃避宿主细胞的杀伤作用, 利用 DNA 疫苗 p3 ×Flag-CMV-14-ROP17 免疫小鼠,可诱导小鼠的体液和细胞免疫反应,且可显著延长接种强毒RH株弓形虫小鼠的存活时间[21]。本研究分别将上述三种基因构建至真核表达载体,研制新型鸡尾酒DNA 疫苗,以期获得更优的免疫保护效果。
细胞免疫在抗弓形虫感染中,尤其是急性感染的早期起到重要作用,感染或适应性免疫可刺激机体T 淋巴细胞和巨噬细胞分泌产生多种细胞因子(如IFN-γ、IL-2、TNF-α、IL-6 以及IL-12等)[15]。尤其Th1 型T 淋巴细胞分泌的IFN-γ 能够抑制弓形虫繁殖、激活巨噬细胞、上调NK 细胞以及促进B 细胞分泌特异性抗弓形虫抗体,在宿主清除弓形虫感染过程中发挥着关键作用[22]。IFN-γ 还可以上调免疫相关GTP 酶和鸟苷酸结合蛋白表达,后者可破坏弓形虫的纳虫泡[23]。此外,Th2 型T 细胞分泌的细胞因子在机体免疫反应过程中起到调节作用,如IL-6 可调节B 细胞生长和分化,增强CTL、NK 细胞的杀伤效应。本研究中鸡尾酒DNA 疫苗免疫小鼠,可激发小鼠脾脏淋巴细胞增殖能力,并且能够刺激小鼠产生高水平的IFN-γ 和IL-6,此结果为免疫小鼠产生高水平抗体和免疫小鼠攻虫后存活时间明显延长提供佐证。
4 结论
本研究成功构建了弓形虫鸡尾酒DNA 疫苗pVAX1-ROP5/ROP9/ROP17,免疫小鼠后,能够激发小鼠的体液免疫反应和细胞免疫反应,并增强小鼠对弓形虫感染的抵抗能力。

