新生儿心脏手术术后肺部并发症的危险因素和死亡预测模型构建
龚孝珏 张小蝶 王江梅 黄文芳 高静 周夏青 赵佳莲 刘喜旺 胡瑶琴
浙江大学医学院附属儿童医院 1麻醉科,2心脏外科 (杭州 310003)
先天性心脏病(congenital heart disease,CHD)是新生儿最常见的先天性异常,多数需要手术治疗[1]。大约3%的新生儿死亡是由先天性心脏病导致的[2]。在中国,新生儿先心病手术死亡率为12.2%[3]。术后肺并发症(postoperative pulmonary complication,PPC)是心脏手术后的重要并发症和主要死亡原因,同时PPC 还延长了住院时间,增加了术后费用[4-5]。目前关于PPC 的研究主要集中于体外循环(cardiopulmonary bypass,CPB)手术[6-7]。最近的研究表明,较长的CPB 时间、心脏手术类型和输血都是体外循环术后PPC 的危险因素[8]。目前国内外鲜见有研究对新生儿所有类型心脏手术进行分析,并研究其PPC 和术后死亡的危险因素。本研究旨在确定心脏手术PPC 和术后死亡的危险因素,同时描述体外循环手术与非体外循环手术之间的病死率和PPC 的差异,最终构建术后30 d内死亡的预测模型。希望能利用患者的术前和术中信息,更好地协助麻醉医生和临床医生正确预测PPC 和术后死亡。
1 资料与方法
1.1 研究对象本研究回顾性分析了2018 年9 月至2022 年2 月在医院接受心脏手术的新生儿。所有数据由两名研究人员独立输入数据库。如果有任何疑义,将由第三人来解决。本研究的纳入标准为接受择期或急诊心脏手术的新生儿(< 28 d)。诊断包括:动脉导管未闭、房间隔缺损、室间隔缺损、主动脉缩窄、大动脉转位和肺动脉狭窄;手术类型包括:开胸体外循坏手术、腔镜体外循环手术、开胸非体外循环手术、腔镜非体外循环手术以及心导管手术。排除标准为:(1)术前存在肺炎、气胸、胸腔积液、急性呼吸窘迫综合征(ARDS)或术前机械通气;(2)严重临床资料缺失。本研究最初纳入162 例心脏手术患儿。其中19 例因术前肺炎被排除,3 例因术后缺少机械通气时间被排除。最终纳入140 例患儿进行数据分析。浙江大学医学院附属儿童医院伦理委员会批准了这项研究。
1.2 研究方法收集相关患儿的基本资料(性别、年龄、胎龄、出生体质量),术前情况(急诊/择期手术、ASA 分级、体温、体外循环/非体外循环手术),术前影像学检查结果,术中情况(输红细胞、输白蛋白、使用血管活性药物、手术时长、出血量),术后情况(拔管时间、再次插管),术后影像学检查特征及术后30 d 内死亡情况的临床资料。PPC 的定义为包括以下任何一种:(1)术后7 d 内肺部影像学检查提示新发肺不张、肺炎、胸腔积液或气胸;(2)术后机械时间> 24 h;(3)非计划再次插管。
1.3 统计学方法数据分析采用 SPSS(Version 26.0,International Business Machines Co.,Armonk,NY,USA)和R 软件(Version R 4.1.3,奥地利维也纳R统计计算基金会)。所有患儿数据中符合正态分布的连续变量采用独立样本t检验分析并以均值±标准差表示,偏态分布的连续变量采用Mann-WhitneyU检验并以中位数(四分位数)表示,分类变量以频率(百分比)表示,采用χ2检验分析。P< 0.1为差异有统计学意义,被纳入多因素logistic回归分析,以P< 0.05 为阈值进行前向最大似然比选择,建立回归模型并绘制nomogram。通过接受者操作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)研究了辨别能力。内部验证通过200 次bootstrap 法,验证模型效能。通过c 指数和AUC 来研究模型区分能力。绘制校准曲线,用于评估校准。此外,本研究还进行了ROC 分析,以确定各危险因素的最佳临界值,最佳截断值定义为ROC 曲线上约登指数(敏感度+特异度-1)最高的点。
2 结果
2.1 患儿一般情况和术后肺部并发症在162 例心脏手术病例中,最终纳入数据分析的病例为140 例。PPC 的发生率为60.7%。如表1 所示,所有患儿的年龄和出生体质量中位数分别为17 d 和3 130 g,其中早产儿占17.1%。择期手术占80%。在所有病例中,85 例(60.7%)术后合并PPC。其中术后新发肺不张、肺炎、胸腔积液或气胸为79 例,占所有PPC的92.9%、术后机械通气> 24 h占1.5%,而非计划再次插管占17.6%。接受CPB 的患者合并PPC 的风险高于接受非体外循环手术的患者(69.1%vs.41.9%,P=0.002)。术中输血和输注白蛋白的患者PPC 发生率明显较高,且发生PPC的新生儿手术时间更长(P=0.014),见表2。进一步logistic 回归分析发现,只有体外循环手术和术中使用白蛋白是PPC的独立危险因素(表3)。
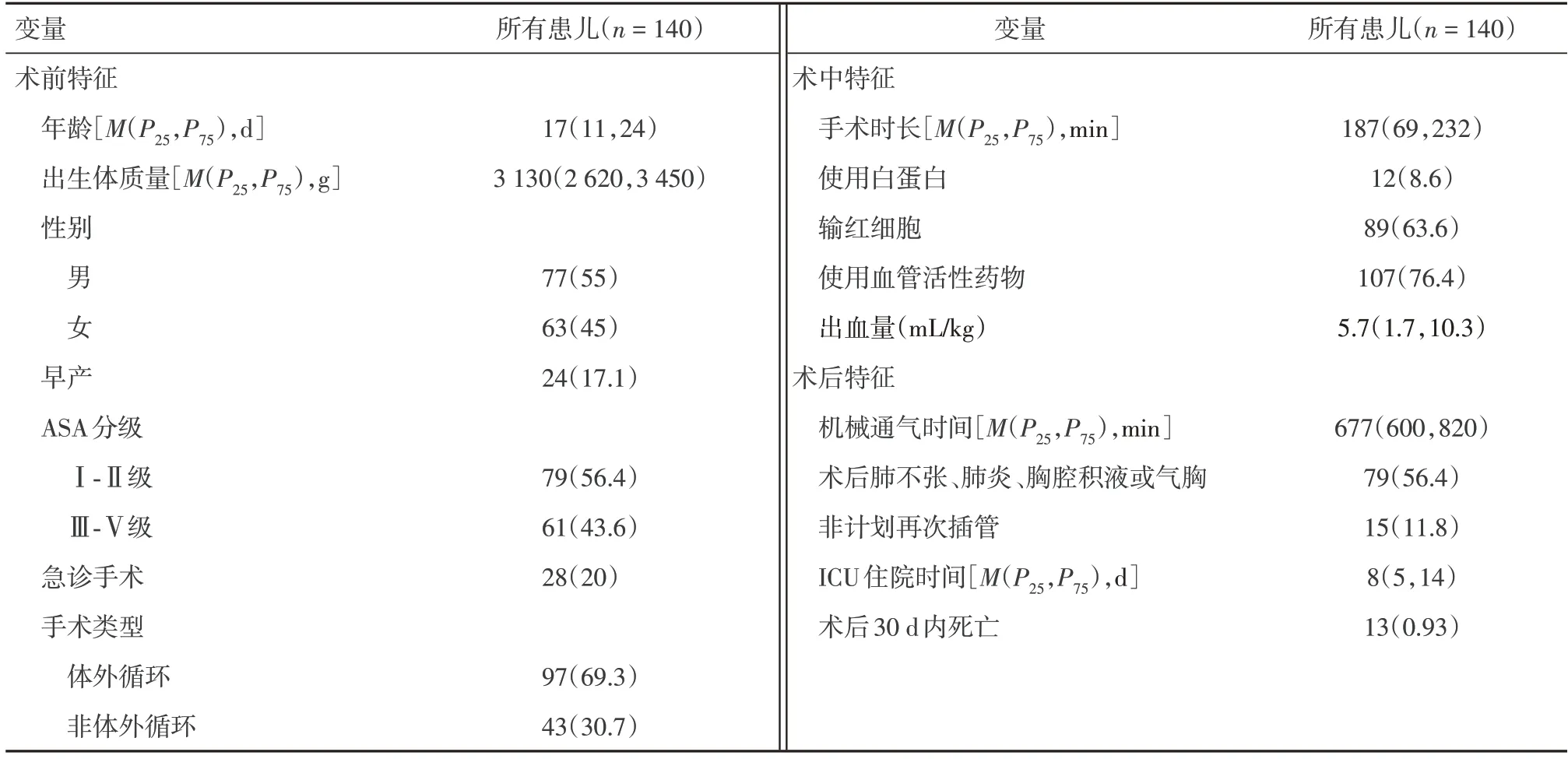
表1 所有患者的基本特征Tab.1 Baseline characteristics of all patients例(%)
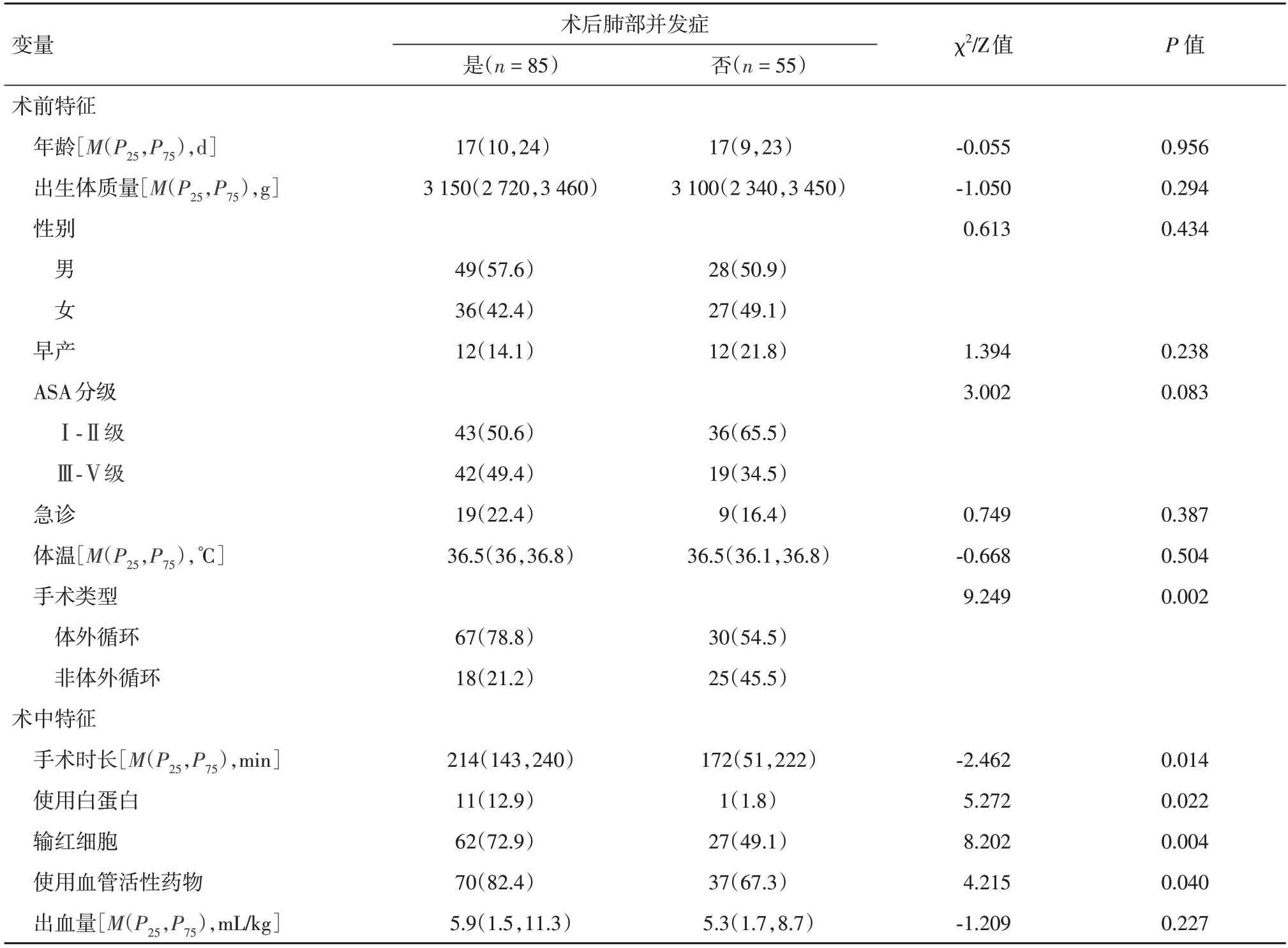
表2 术后肺部并发症的单因素分析Tab.2 Univariate analysis of postoperative pulmonarycomplication例(%)
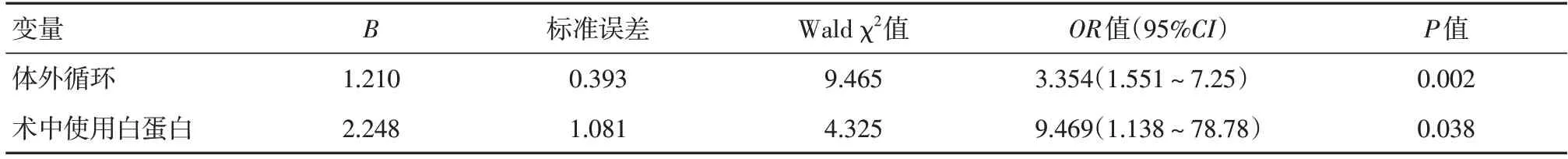
表3 术后肺部并发症的多因素logistic 分析Tab.3 Multivariate logistic regression analysis of postoperative pulmonarycomplication
2.2 术后30 d 内死亡的危险因素140 例患儿中有13 例在术后30 d 内死亡,病死率为0.93%。6 例(46.2%)死亡患儿ASA 分级为Ⅰ-Ⅱ级。术后30 d内死亡与年龄、早产、急诊和手术时长相关(表4)。所有患者术后均转入ICU,其中7.1%的患者第2 天转回普通病房。多因素logistic 回归模型显示,早产(P=0.01)、急诊手术(P=0.009)和手术时间(P=0.001)是术后30 d 内死亡的独立危险因素(表5)。
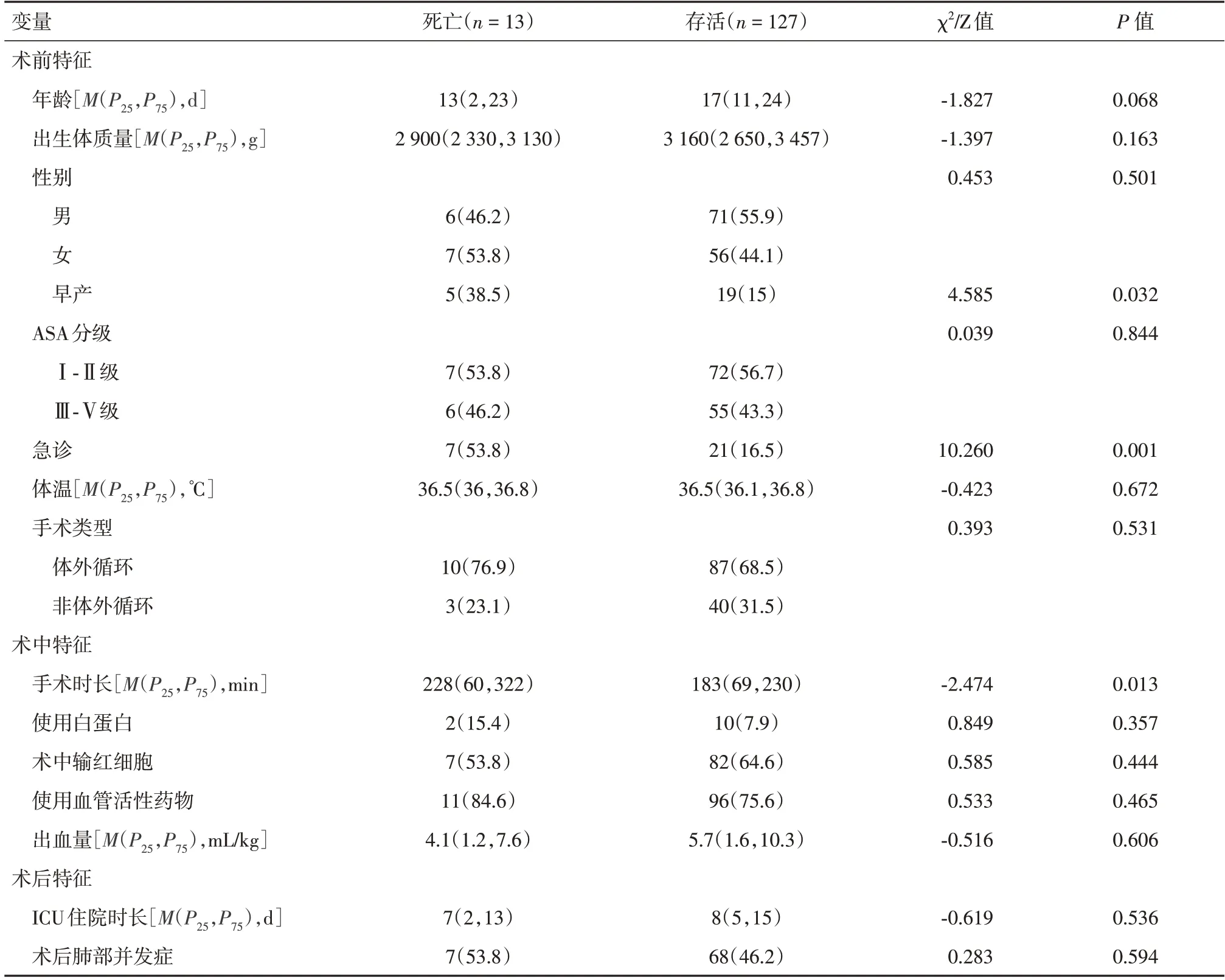
表4 术后30 d 内死亡的单因素分析Tab.4 Univariate analysis of 30-day mortality例(%)
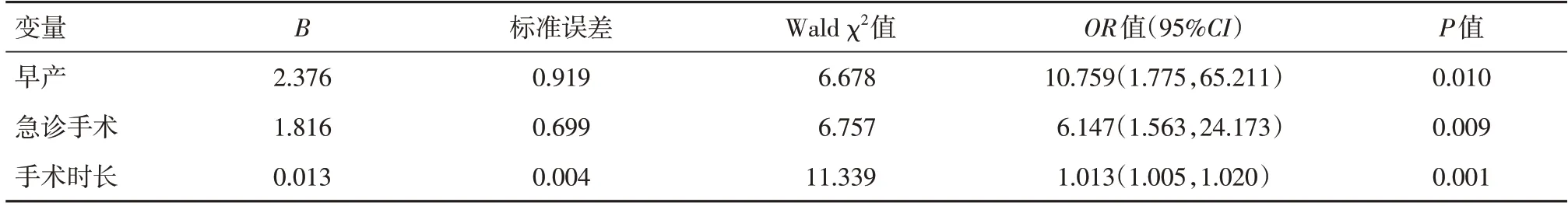
表5 术后30 d 内死亡的多因素logistic 分析Tab.5 Multivariate logistic regression analysis of postoperative mortality within 30 days
2.3 术后30 d 内死亡的预测模型开发和评价列线图预测模型(图1)由3 个独立的术后30 d 内死亡预测因子开发而成。模型通过汇总3 个变量的得分来预测术后死亡的可能性,最终模型c 指数为0.862(95%CI:0.758~0.966)。ROC 曲线显示AUC 为0.862(95%CI:0.754~0.969)(图2),校准图见图3,模型拟合良好。综合各项得分后计算总分,总分越高,术后死亡率越高。内部验证通过200 次bootstrap 法,得出平均AUC 为0.857(95%CI:0.848~0.866),模型有较好的预测能力。
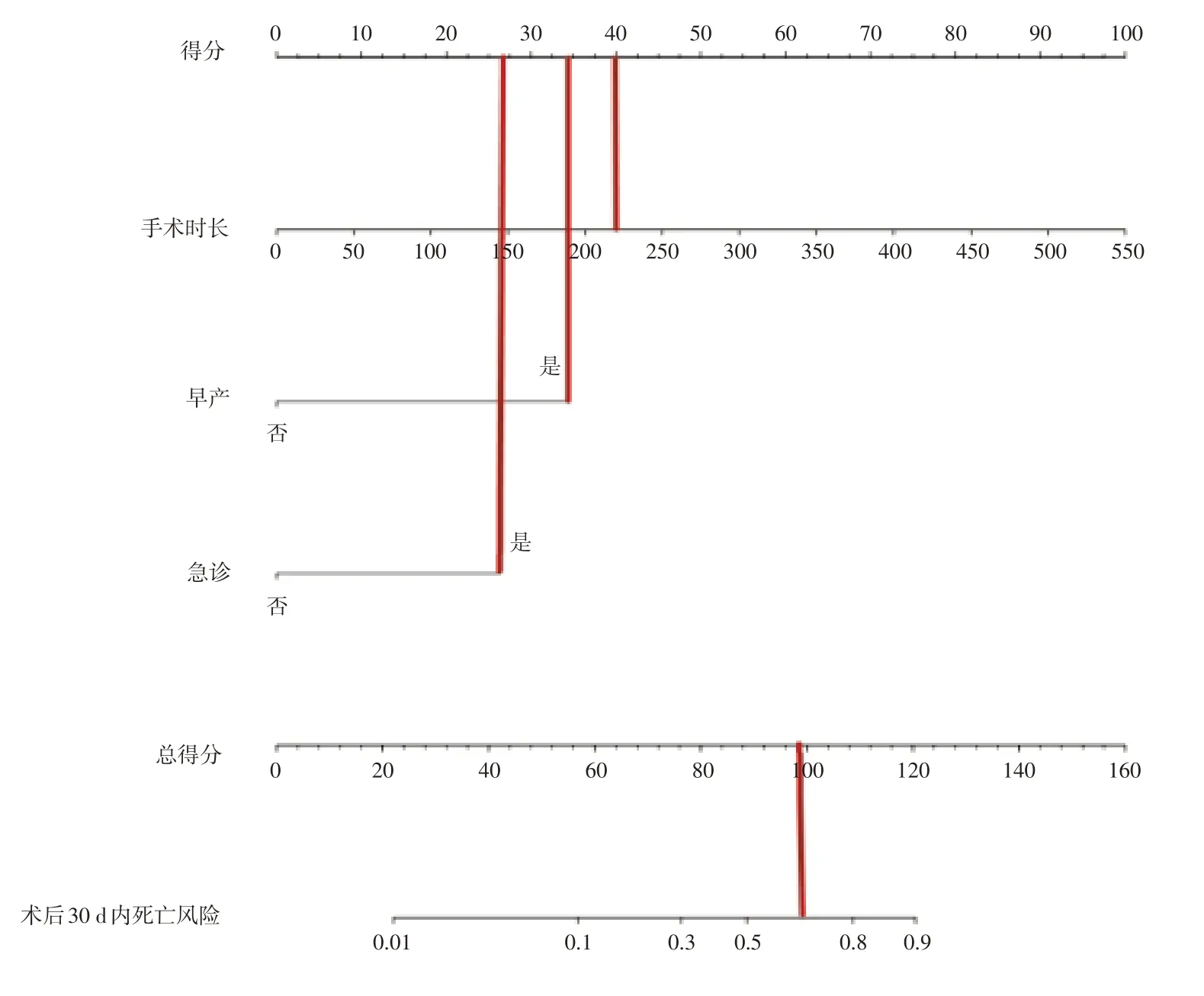
图1 术后30 d 内死亡预测模型Fig.1 Prediction model ofpostoperative mortality within 30 days
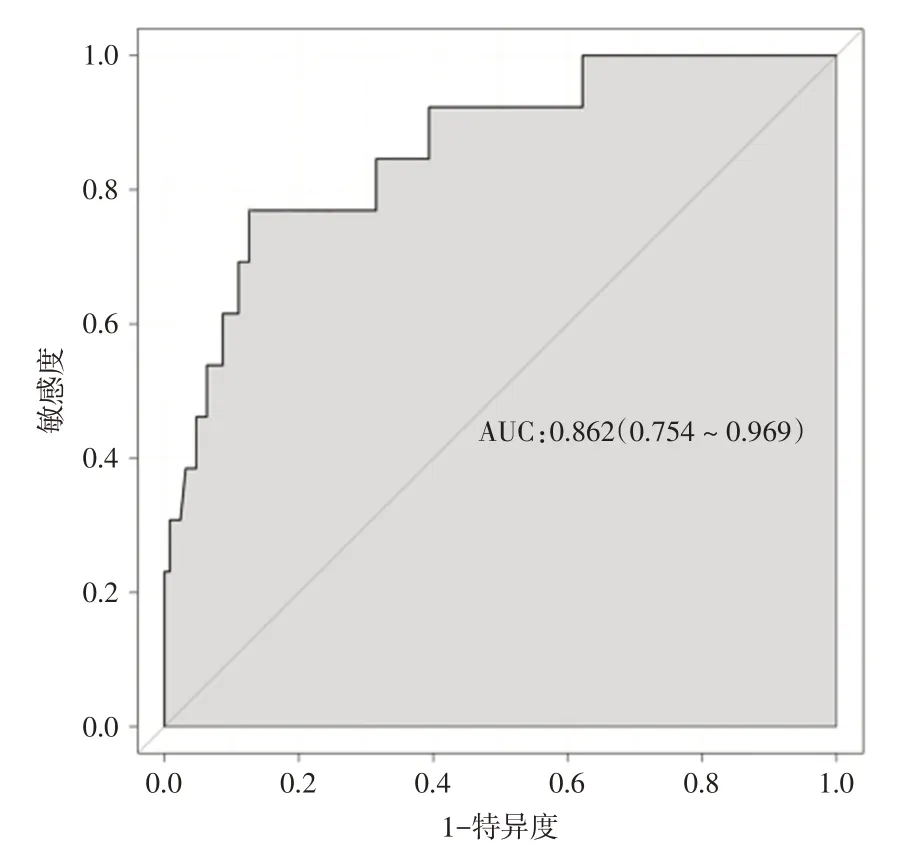
图2 预测模型的ROC 曲线Fig.2 ROC curve of prediction model
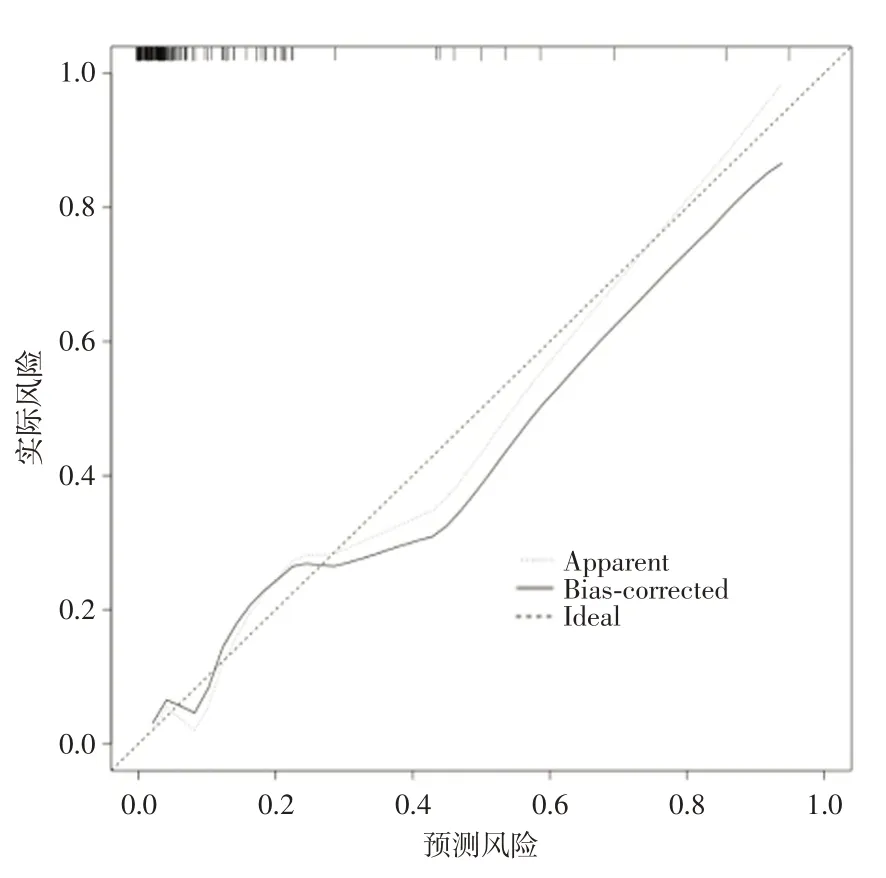
图3 预测模型校准图Fig.3 Calibration diagram of prediction model
2.4 手术时长预测术后死亡的最佳临界值预测模型中使用ROC 分析确定手术时长的最佳临界值(图4)。手术时间> 220 min,是预测新生儿术后30 d 内死亡的最佳临界值(AUC:0.709,敏感度:69.2%,特异度70.9%)。
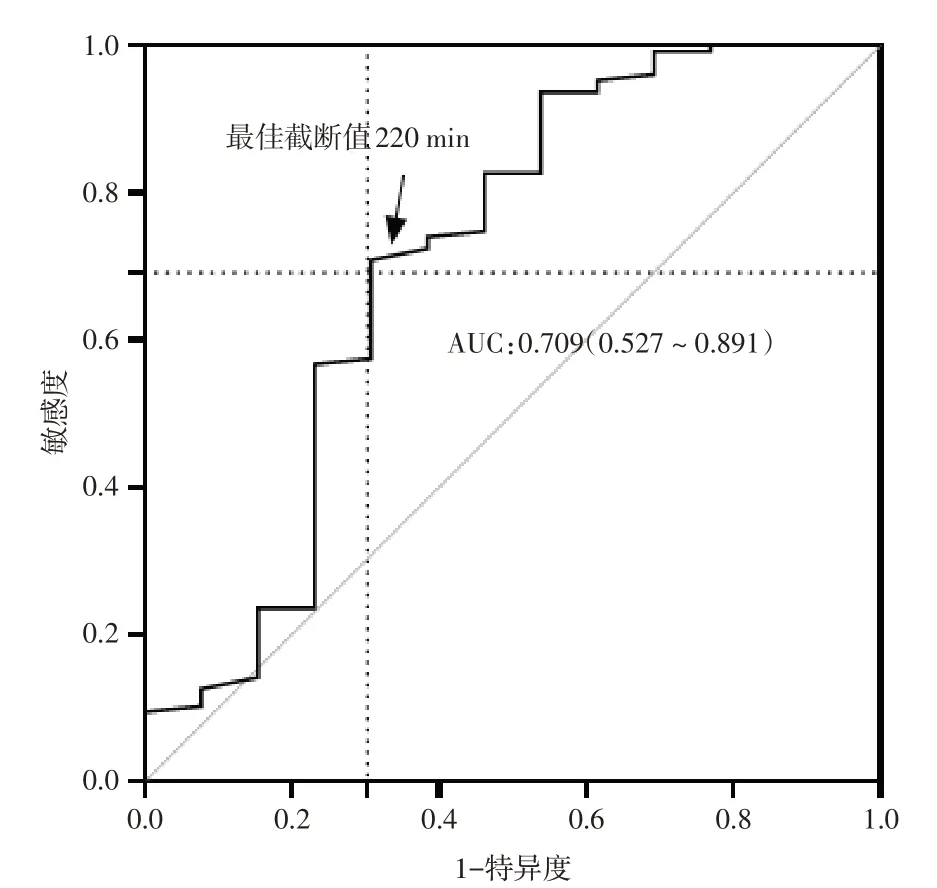
图4 手术时长在预测术后30 d 内死亡的ROC 曲线Fig.4 ROC curve of surgery length for 30‑day mortality
2.5 体外循坏和非体外循环手术PPC 比较根据手术类型进一步将患者分为体外循环组和非体外循环组。体外循环组和非体外循环组患者术后机械通气时间中位数分别为636 min 和727 min,非计划再插管的比例分别为9.3%和14%。此外,体外循环组术后肺不张、肺炎、胸腔积液或气胸的比例明显高于非体外循环组。对于术后30 d 死亡率虽然两组间差异无统计学意义,但是体外循环组死亡率约为非体外循环组的1.5 倍(表6)。
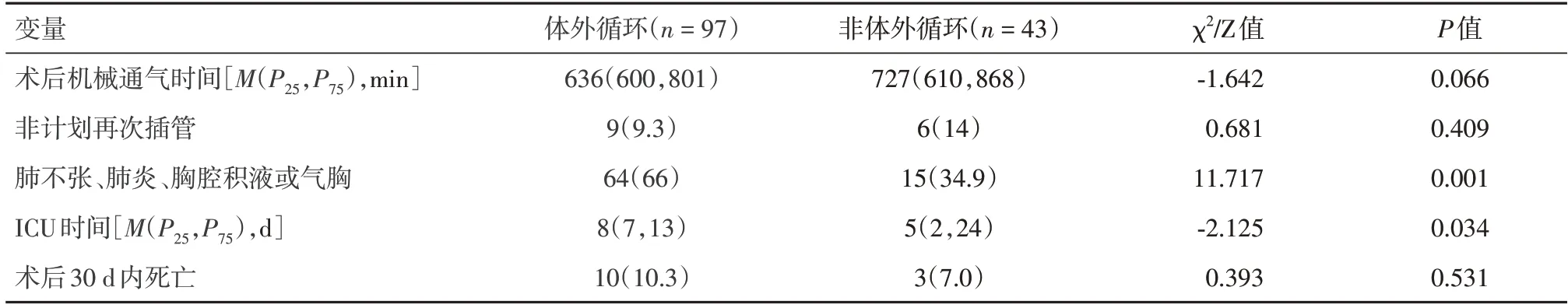
表6 不同手术类型的术后肺部并发症和病死率Tab.6 Postoperative pulmonary complications and mortality in different types of surgery例(%)
3 讨论
本研究发现60.7%的心脏手术患儿术后合并PPC,在分析了所有变量后,笔者确定体外循环手术和白蛋白是术后肺部并发症的独立危险因素。目前在成人和儿童的研究中,对于心脏手术后肺部并发症的危险因素研究都集中于体外循环手术,但并未有研究基于数据说明只纳入体外循环患者进行研究的原因。本研究为此提供了数据支持。目前术中低血压的治疗多为补液和应用血管活性药物,而白蛋白作为维持胶体渗透压的重要物质,在新生儿手术中常被用于扩容。有研究[9]显示,液体推注治疗后1 h,接受白蛋白治疗的新生儿与接受生理盐水治疗的新生儿相比,其动脉血压表现出更大程度的改善。术中白蛋白的应用在一定程度上提示了术中血容量不足,这可能导致术中肺灌注不足,从而导致PPC。本研究显示术中输注白蛋白是PPC 的独立危险因素,这与GAJIC 等[10]提出的肺损伤预测评分一致。
体外循环在多个研究中被证实是术后肺部并发症的危险因素。体外循环产生的促炎、促凋亡的细胞因子和体外循环导致的缺血-再灌注损伤,都会使患者更易出现PPC[11]。本研究进一步根据手术类型将患者分为两组,并比较两组在各项术后肺部并发症和术后30 d 内死亡方面的差异。总体而言,体外循环组患者30 d 内死亡率、术后肺不张、肺炎、胸腔积液、气胸等并发症发生率均高于非体外循环组。这可能与手术创伤、手术复杂程度和感染发生率有关[12-16]。但非体外循环组术后非计划再插管率均明显高于体外循环组。这是一个值得注意的现象。CPB 会引起各种非生理性改变,如血液稀释,CPB 过程中为避免栓塞和溶血都需要降低血细胞比容,然而,当血细胞比容达到22%时,会导致肺水肿[17]。同时血液流过CPB 回路时会释放炎性细胞因子,这些因子会通过增加肺间质的通透性直接或间接地导致肺损伤,最终使得PPC 发生率增加[18]。但本研究却发现非体外循环组术后非计划内再插管率高于体外循环组,这可能与体外循环组术后拔管时间较早有关。有研究[19]显示术后机械通气时间超过16 h 与住院时间延长和病死率增加相关。在小儿心脏外科手术中,早期拔管与较低的再插管发生率、病死率和ICU 住院时间相关[20]。早期拔管甚至可以降低呼吸道并发症的发生率[21]。所以对于心脏手术患儿,术后早期拔管对患儿的预后十分重要。
PPC 在术后死亡的危险因素分析中虽然不是危险因素,但其心脏手术患儿术后PPC 发生率远高于其他非心脏手术PPC 的发生率。由于术后肺部并发症的定义仍未达成共识,所以目前报道的术后肺部并发症发生率根据定义的不同而有所差异,约为5%~33%[22-23]。我们的研究中PPC 发生率为60.7%,约为先前研究的2 倍。虽然统计学上并无差异,但是PPC 的发生率从侧面上显示了PPC 的高发生率可能是心脏手术术后30 d 内死亡率较其他手术更高的原因[24]。
同时早产、急诊手术和手术时间与术后30 d内死亡独立相关,这与之前的几项研究一致[12,25]。根据约登指数计算的手术时长最佳临界点来判断,若患儿手术时长> 220 min,且同时为早产儿和急诊手术,则术后死亡率约为70%左右。这一结果也说明,对于心脏手术患儿,术前情况和手术难易程度可能是决定术后能否存活的关键。
本研究存在一些局限性。首先,本研究样本量相对较小,由于样本量的限制,一些重要数据如术前、术中实验室检验结果、术中生命指标等并未被纳入研究进行分析。其次,本研究构建的预测模型虽然在内部验证时表现良好,但仍需进行外部验证,进一步评价模型效能。

