沉默信息调节因子1基因多态性与广西人群显微镜下多血管炎的病例对照研究
冯菲 蓝晶晶 薛超
1广西医科大学第二临床医学院(南宁 530021);2广西医科大学第二附属医院肾内科(南宁 530007)
抗中性粒细胞胞浆抗体(ANCA)相关性血管炎(AAV)是一种罕见的异质性疾病,主要表现为中小血管的炎症和坏死。AAV 通常包括以下临床亚型:肉芽肿伴多血管炎(GPA)、显微镜下多血管炎(MPA)和嗜酸性肉芽肿伴多血管炎(EGPA)[1]。既往研究表明,地理和民族差异导致AAV 在不同地区的临床表型存在差异。肉芽肿伴多血管炎(GPA)是北欧人群AAV 的主要类型,而显微镜下多血管炎(MPA)是亚洲人群AAV 的主要类型[2]。据报道,MPA 的发病率为0.5~24.0 例/百万人年,患病率为9.0~94.0 例/百万人年,发病年龄为55~75 岁[3]。
AAV 的发病机制未阐明,流行病学的显著差异[4]提示了AAV 具有遗传易感性背景。研究发现,AAV 与CTLA-4、FCGR2A、PTPN22、SERPINA1、TLR1 和TLR9 等遗传变异之间存在显著相关性,这些变异均来自非MHC 区域。不同临床亚型其遗传背景不同。例如,GPA 与HLA-DP1 有关,MPA与HLA-DQ 有关,EGPA 与HLA-DRB4 有关。上述成果不仅有助于解释AAV 的病因,还可为诊断和靶向治疗提供生物标志物[5]。Sirtuins 家族,其独一无二的烟酰胺腺嘌呤二核苷酸(NAD+)依赖的去乙酰化酶功能引起了人们的广泛关注。沉默信息调节因子1(SIRT1),sirtuins 家族成员之一,承担了p53、叉头盒O(FoxO)等多种转录因子和协同调节因子的去乙酰化。SIRT1 可通过调节细胞分泌参与糖代谢、神经内分泌功能、炎症和肿瘤发生等生理过程[6]。此外,SIRT1 可影响多种自身免疫性疾病的发病,如:类风湿性关节炎(RA)、系统性红斑狼疮(SLE)、炎性肠病(IBD)、多发性硬化症(MS)等,是自身免疫性疾病的潜在治疗靶点[7]。然而,目前未见SIRT1 基因变异与MPA的关联性研究。为此,本研究选择rs1467568 和rs4746720 为候选SNP,探索SIRT1 突变是否影响广西人群MPA 的发生。
1 资料与方法
1.1 一般资料本研究的病例组源于2005-2020年在广西医科大学第二附属医院肾内科、风湿病科确诊为MPA的患者,共208例。纳入的MPA患者中,包括78 例男性(37.5%)和130 例女性(62.5%),平均年龄为(54.6±14.9)岁。其严格参照2012 年Chapel Hill 国际血管炎命名会议标准进行诊断[8],排除了由感染、药物治疗、系统性红斑狼疮(SLE)、类风湿性关节炎(RA)和类风湿性紫癜(HSP)等引起的继发性血管炎。同时,选取了211 例与MPA组年龄、性别较为匹配的健康志愿者作为对照组。其中包含了83 例男性(39.3%)和128 例女性(60.7%),平均年龄为(51.2±12.6)岁。一切遵循世界医学协会《赫尔辛基宣言》原则,已获得广西医科大学第二附属医院医学伦理委员会批准(编号:2018 KY-0100)。所有受试者均签署了书面知情同意书。
1.2 方法
1.2.1 资料收集收集MPA 患者的一般资料、临床资料与实验室生化指标。一般资料包括受试者的年龄、性别、血压等。临床资料的收集以MPA患者发病所伴随的咳嗽、发热、水肿等一系列临床症状为主。实验室生化指标,即红细胞、白细胞、血小板计数以及其他检测指标。
1.2.2 基因组DNA 的提取采集所有受试者的外周静脉血5 mL 置于EDTA 抗凝采血管,根据DNA提取试剂盒[天根生化科技(北京)有限公司]操作说明提取外周血DNA。所纳入的DNA 样本:DNA纯度(A260/A280):1.8~2.0,DNA浓度> 50 μg/mL,将标本放置-20 ℃冰箱以供后续实验。
1.2.3 目的SNP 的选取利用Ensembl 浏览器(https://ensemblgenomes.org)对中国南方汉族人群(CHS)和中国北京汉族人群(CHB)进行基因座选择。其筛选标准如下:(1)最小等位基因频率(MAF)≥ 0.05;(2)遵循哈迪-温伯格平衡(Hardy‑Weinberg Equilibrium,HWE),P> 0.05;(3)已有文献证明目标位点与自身免疫性疾病相关。
1.2.4 基因分型通过多重聚合酶链反应(PCR)结合高通量测序法[生工生物工程(上海)股份有限公司]对目标位点进行检测。首先,需设计并合成引物池,然后通过两步PCR 法扩增SNP 位点序列制备一个Illumina 测序文库。首轮扩增体系如下:DNA 模板(10 ng/μL)2 μL;上游引物池(10 μmol/L)1 μL;下游引物池(10 μmol/L)1 μL;2×PCR Ready Mix 15 μL (总体积25 μL)(Kapa HiFi Ready Mix)。待反应体系配制好后,通过PCR 仪(BIO-RAD,T100TM)完成如下扩增:98 ℃预变性5 min;98 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,共8 个循环;98 ℃变性30 s,66 ℃退火30 s,72 ℃延伸30 s,共25 个循环;72 ℃延伸5 min。待反应完成,温度维持在4 ℃以保存产物;利用1%琼脂糖胶电泳检测扩增产物,产物将被AMPure XP 磁珠纯化回收。
第二轮的扩增须以首轮产物为模板,目的是获得测序带分子标签的文库。反应体系如下:DNA 模板(10 ng/μL)2 μL,通用P7 引物(含分子标签,10 μmol/L)1 μL;通用P5引物(10 μmol/L)1 μL;2×PCR Ready Mix 15 μL (总体积30 μL)。体系准备就绪后,进行如下扩增:98 ℃预变性5 min;94 ℃变性30 s,55 ℃退火20 s,72 ℃延伸30 s,共5 个循环;最后72 ℃延伸5 min,反应结束,产物仍在4 ℃中进行保存。PCR 产物仍以AMPure XP 磁珠纯化回收方式进行回收。待所有扩增产物混合后,将通过HiSeq XTen 测序仪(Illumina,San Diego,CA)展开测序。引物序列依次为:F1:5′-CCAATGAAGTTCTTTCTACAGCACA-3′,R1:5′-ATGCAGTATGAAAAAGTTCGAGAGC-3′,F2:5′AAAAGTAAAGA‑CAACCGAGTGCTCT-3′,R2:5′-AGTTTTCAAAAAGCCATCGGAATGT-3′。
1.3 统计学方法对于正态分布/近似正态分布的定量资料,采用(±s)描述其平均水平;而偏态分布的计量资料则用M(P25,P75)表示。利用χ2检验或Fisher 精确概率检验来估计两组间的基因型和等位基因频率分布。通过SHEsis 生信软件进行连锁不平衡(LD)和单体型分析。应用SNPstats 生信网站进行年龄分层分析,计算和评估五种遗传模型下的基因型与MPA 发病风险之间的关系,计算优势比(ORS)和95%置信区间(CIS)。采用SPSS 26.0 统计软件进行统计学分析,以P< 0.05 为差异有统计学意义。
2 结果
2.1 基因型、等位基因频率的比较MPA组与对照组均符合Hardy‑Weinberg 平衡(MPA 组:χ2=0.569,P=0.451;对照组:χ2=0.641,P=0.423),即证明所纳入的研究对象具人群代表性。Rs1467568、rs4746720 的基因型、等位基因频率在两组中的分布差异均无统计学意义(P> 0.05),见表1。
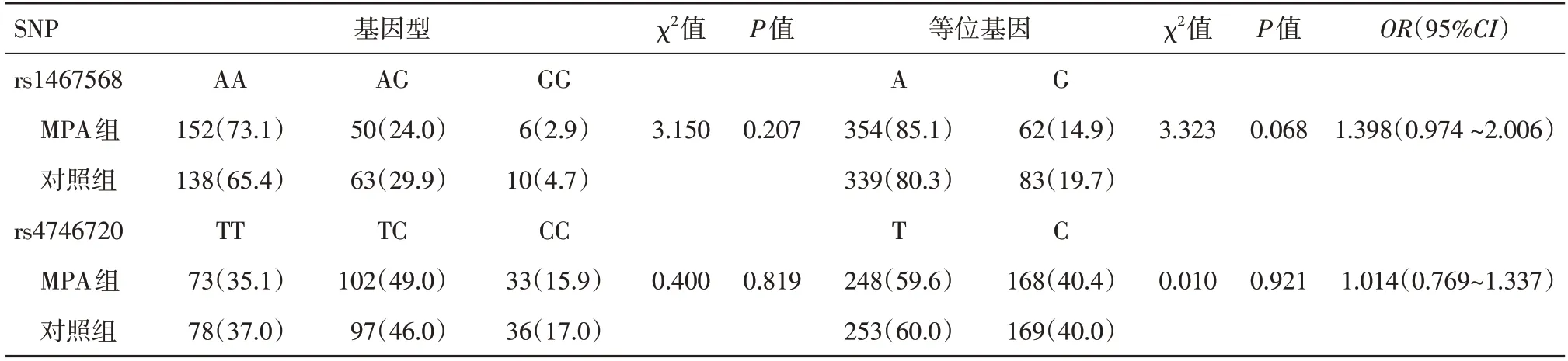
表1 SIRT1 rs1467568、rs4746720 基因型和等位基因在MPA 组和对照组中的分布Tab.1 Distribution of SIRT1 rs1467568 and rs4746720 genotype and allele in MPA group and control group 例(%)
2.2 按年龄分层后的遗传模型分析Rs1467568的显性模型(OR=0.50,95%CI:0.27~0.92,P=0.026)、超显性模型(OR=0.49,95%CI:0.26~0.92,P=0.026)和加性模型(OR=0.57,95%CI:0.33~0.99,P=0.045)均能降低老年组(≥ 54 岁)MPA 的发病风险。而rs4746720 的各遗传模型均显示两个不同年龄组的个体与MPA 的发病风险缺乏相关性,差异均无统计学意义(P> 0.05),见表2。
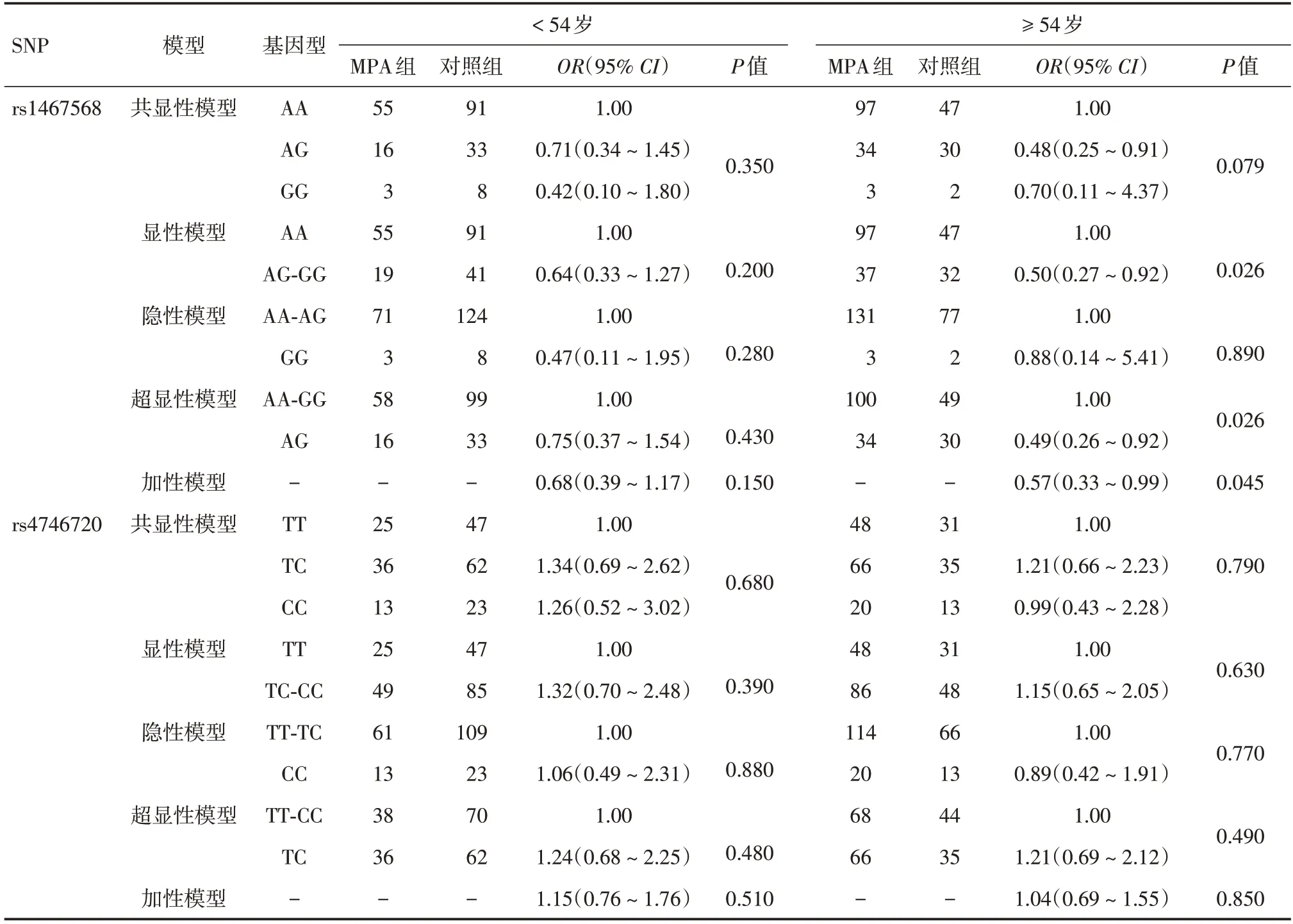
表2 SIRT1 基因多态性在不同年龄段人群中的分布以及与MPA 发病风险的相关性Tab.2 Distribution of SIRT1 gene polymorphisms in different age groups and its association with the risk of MPA
2.3 基因型与临床症状的相关性分析Rs1467568、rs4746720 各基因型与发热、咳嗽、水肿、咯血、血尿以及蛋白尿症状的发生差异均无统计学意义(P> 0.05),见表3。
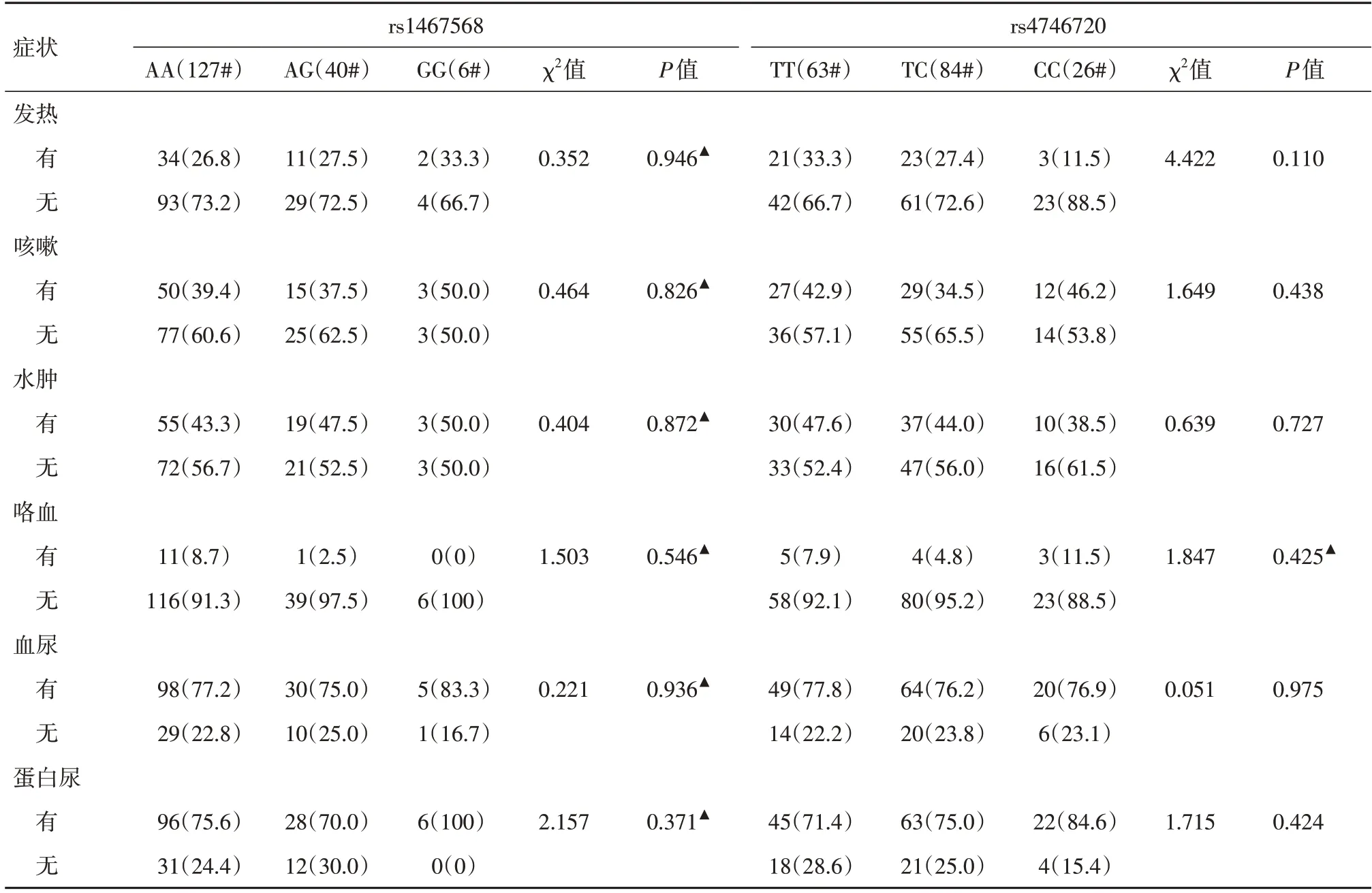
表3 rs1467568、rs4746720 各基因型的临床症状比较(MPA 组)Tab.3 Comparison of clinical symptoms of rs1467568 and rs4746720 genotypes (MPA group) 例(%)
2.4 基因型与实验室指标的分析在MPA 患者中,与AA、AG(rs1467568)基因型相比,GG 基因型的谷丙转氨酶(ALT)水平显著升高,差异有统计学意义(P=0.012);而CC(rs4746720)基因型的谷草转氨酶(AST)水平较TT、TC 基因型低,差异有统计学意义(P=0.036)。除此之外,两位点的基因型与其他各实验室指标差异均无统计学意义(P> 0.05),见表4。
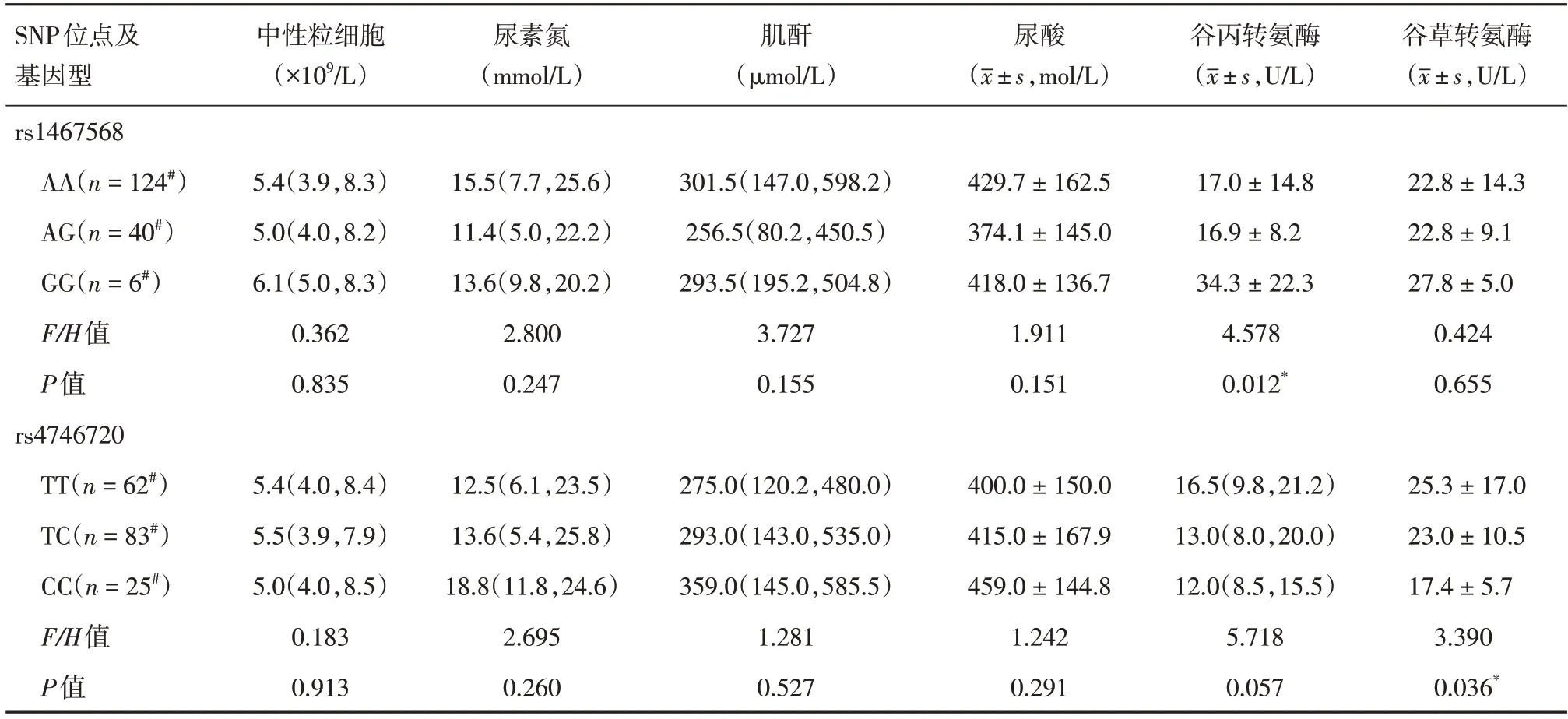
表4 rs1467568、rs4746720 各基因型与实验室生化指标的关联性分析(MPA 组)Tab.4 Analysis of the relationship between rs1467568,rs4746720 genotypes and laboratory biochemical indexes(MPA group)M(P25,P75)
2.5 连锁不平衡与单体型分析研究证明,SIRT1 rs1467568 和rs4746720 处于完全连锁不平衡状态(D1=1.000,r2=0.141);两位点所构建的单体型与MPA 的遗传易感性并不相关(P> 0.05),见表5。

表5 单体型与MPA 遗传易感性的关系Tab.5 Relationship between haplotypes and genetic susceptibility to MPA 例(%)
3 讨论
ANCA 相关性AAV 是一种死亡率高且易复发的自身免疫性疾病。免疫抑制剂的问世使AAV在治疗方面实现了质的飞跃,该血管炎可从产生症状后1~2 年内死亡率极高的异质性疾病转变为需终生治疗的慢性疾病。但非特异性治疗带来的不良免疫和代谢反应,已严重影响患者的生活质量乃至威胁生命健康。故该病的治疗领域中挑战一直存在[3]。
该血管炎的发病机制可受遗传因素、环境因素等影响,其发病过程因复杂而备受争议。既往研究[9]证实了ANCAs 过度激活中性粒细胞可诱导其形成中性粒细胞外陷阱(NETs),且NETs 可通过ANCA的介导导致血管损伤并参与ANCAs的产生。故认为NETs 与ANCA 调控所形成的恶性循环有助于AAV 的发病。体外实验[10]表明ANCA 可诱导自噬,而自噬对ANCA 所诱导的NETs 的形成发挥促进作用。ZHU 等[11]通过功能获得和功能丧失实验证明了SIRT1 介导的FoxO1 易位和去乙酰化在H2S 诱导的内皮细胞自噬过程中扮演重要角色;且H2S 对血管的保护作用由SIRT1-FoxO1 信号通路介导的血管内皮细胞自噬完成。基于以上研究背景,猜测SIRT1 可能参与ANCA 相关性血管炎的发病,SIRT1 启动自噬,调节中性粒细胞外部网(NETs)的紊乱,减轻血管内皮细胞的炎症反应,保护血管。
SIRT1 蛋白是一种NAD+依赖的去乙酰化酶,高度保守[12],是sirtuin 家族中研究最深入的一员。SIRT1 对免疫反应的有效调节[13]源于该基因对多种蛋白的乙酰化修饰,其中包括了组蛋白、代谢酶等[14-15]。SIRT1 的表达与多种血管炎发病机制相关已被报道。XIE 等[16]通过实验发现,在活动性眼部白塞病患者中,SIRT1 表达降低;而后续实验直接证实了活动性眼部白塞病的发生得益于SIRT1 表达的降低影响了Th17 和Th22 细胞的反应。意大利的一项横断面研究[17]显示,巨细胞动脉炎(GCA)患者外周血单核细胞(PBMC)中SIRT1 的表达明显低于健康对照组,不由得猜测GCA 患者SIRT1 表达的降低可能受并行的氧化应激影响,其过程可能涉及该血管炎的发病机制,需更深入研究证明此观点。SHIMOJIMA 等[18]试图探究ANCA 相关性管炎(AAV)中调节性T 细胞(Treg)稳定性与活性氧的关系时意外发现,相比于健康对照组,AAV 患者Treg 中SIRT1 表达降低;经白藜芦醇治疗后的AAV 患者Treg 表现为SIRT1表达升高。近年来,SIRT1 的遗传变异已被广泛讨论。HOU 等[19]研究显示,rs1467568 AG 基因型可能是1 型心肾综合征(CRS1)发病的保护因素(P=0.019)。在529例中国汉族类风湿性关节炎患者和700 例健康对照中[20],学者发现rs1467568 可影响中国汉族人群类风湿性关节炎的遗传易感性(P=0.011)。有趣的是,在糖尿病肾病[21]中,rs4746720 的TC 基因型携带者发生该疾病的风险低于TT、CC 基因型携带者(P< 0.01),但T 等位基因又是糖尿病肾病的风险等位基因(P=0.01)。还有研究[22]表明SIRT1 已成为治疗2 型糖尿病的一个很有前景的治疗靶点。更有学者发现SIRT1 rs12778366 位点可能/间接影响2 型糖尿病的遗传易感性;还可能影响SIRT1 mRNA 的表达并进一步影响利拉鲁肽和二甲双胍对既往血糖控制不佳 2 型糖尿病患者临床疗效[23]。本研究结果表明,在年龄≥ 54 岁亚组中,rs1467568 的显性模型AA+AG 基因型、超显性模型AG 基因型以及加性模型可能与MPA易感性降低相关,可视为疾病发生的保护因素,这与其他研究结果类似。Rs1467568位于内含子区域,其位点可能通过中断翻译和剪接的过程影响SIRT1 基因的转录,改变氨基酸序列。SIRT1 可因其去乙酰化酶活性直接参与自噬过程的调节,还可通过间接改变上游调控因子实现自噬活性的调节[24]。故猜想,SIRT1 的遗传变异(rs1467568)导致SIRT1自身的表达异常,进而启动自噬,影响MPA 易感性。
本次实验室检查结果显示,患者的丙氨酸氨基转移酶(rs1467568)、天门冬氨酸氨基转移酶(rs4746720)水平在不同基因型间差异有统计学意义。早有研究证明SIRT1 在维持代谢过程(包括糖异生和脂质合成)的昼夜节律调节中发挥核心作用,从而影响肝脏再生过程[25-26]。笔者大胆推测,SIRT1 基因的遗传变异影响了自身去乙酰化过程,从而影响了肝脏的代谢,造成丙氨酸氨基转移酶、天门冬氨酸氨基转移酶在不同基因型之间存在差异。
本研究在探讨SIRT1 基因多态性与MPA 易感性相关性过程中,存在多处空白:样本量小,部分临床资料缺失,影响统计分析;研究人群仅来自一个地区,存在选择偏倚等。因此,将继续扩大样本量,完善临床资料,深入研究SIRT1 遗传变异与MPA 发病机制的关联性。
综上所述,SIRT1 rs4746720与广西人群的MPA风险无关。尽管其他结果显示SIRT1 rs1467568 与MPA 无相关性,但年龄分层分析显示,rs1467568(年龄≥ 54 岁)的显性模型、超显性模型以及加性模型降低了MPA 的发病风险。另外,SIRT1多态性rs1467568 可能与丙氨酸氨基转移酶水平相关、rs4746720 与天门冬氨酸氨基转移酶水平相关。

