布洛芬对缺血性脑中风大鼠的神经保护作用及对Nrf2/SLC7A11/GPX4信号通路的影响
何俊荣 刘仔 陈锡培
广州中医药大学东莞医院(广东东莞 523000)
中风是全球死亡率和残疾的重要引发因素,每年有1 030 万人群出现中风病例,具有“四高一多”特点[1-2],目前溶栓治疗是缺血性脑卒中(isch‑emic stroke,IS)最有效的治疗方法,但仅少数患者可在脑卒中发病后4~6 h 内接受有效的溶栓治疗。因此探索IS 的发病机制对于制定有效的治疗策略至关重要[3]。布洛芬是一种非甾体抗炎药,目前已被证明可改善认知功能障碍和神经炎症[4],但其对治疗IS 鲜有报道。铁死亡是一种依赖铁的细胞死亡形式,与多种病理状况有关,包括创伤性脑损伤、神经退行性疾病和中风[35]。核因子E2 相关因子2(nucler factor erythroid related factor 2,Nrf2)是控制细胞氧化还原稳态和炎症的关键转录因子,Nrf2 作为转录因子可增加非糖基化的xCT(SLC7A11)和谷胱甘肽过氧化物酶4(GPX4)的表达,激活Nrf2 信号还可以通过对抗铁死亡保护细胞[6]。研究[7]显示,布洛芬可通过调节Nrf2 信号通路诱导胶质母细胞瘤细胞的铁死亡,是一种潜在的胶质瘤治疗药物,提示布洛芬与Nrf2 介导的铁死亡具有一定的联系,但布洛芬能否通过Nrf2/SLC7A11/GPX4 信号通路对IS 发挥保护作用目前并无报道。因此本研究通过大脑中动脉梗死模型复制IS 大鼠,旨在探讨布洛芬对IS 大鼠神经保护的影响及相关作用机制,为IS 治疗提供潜在治疗方案。
1 材料与方法
1.1 材料
1.1.1 实验动物60 只雄性Sprague-Dawley(SD)大鼠(体质量220~260 g,6~7 周龄)购自完美(广东)日用品有限公司,许可证号:SYXK(粤)2022-0288。所有大鼠置于标准鼠笼(每个笼子少于5 只动物)中,温度设定(22±1)°C,光照/黑暗周期为12 h,湿度为60%~70%。大鼠随意获取食物和水,根据《实验动物护理和使用指南》进行。
1.1.2 实验药品与试剂上海吉至生化科技有限公司提供布洛芬(纯度99.0%,CAS:15687-27-1,1 g);美国Med-ChemExpress 公司提供Nrf2 抑制剂-ML385(纯度99.55%,编号:S8790,25 mg);天津科密欧化学试剂有限公司提供2,3,5-三苯四唑氯化物(TTC);北京索莱宝科技有限公司提供苏木精-伊红染色液(HE)、RIPA 高效蛋白裂解液;浙江奥的特生物技术有限公司铁离子试剂盒;Abcam公司提供Nrf2、SLC7A1、GPX4 一抗。
1.2 方法
1.2.1 IS 大鼠模型的制备及干预将适应性喂养1周的大鼠分为造模组(48只)及假手术组(12只),造模组大鼠参考文献[8]制备IS 大鼠模型。首先将大鼠麻醉,将右侧颈总动脉(CCA)和颈外动脉小心暴露并从周围组织分离,将一根直径为0.26 mm的尼龙丝经右侧颈总动脉插入(约20 mm)到右侧颈内动脉,阻断大脑中动脉血流。缺血60 min 后,小心拉出尼龙丝开始再灌注24 h,假手术操作同上,但仅分离动脉,不进行缺血再灌注操作。IS 大鼠模型的选取标准为[9]:(1)大鼠苏醒后出现左侧旋转;(2)参考Zea-Longa 评分对大鼠进行神经功能评分[10],评分为1-3 分的大鼠进行后续实验。造模过程中48 只大鼠均无死亡且符合IS 造模标准。
造模组大鼠随机分为假手术组IS 组、治疗组、抑制剂组、治疗+抑制剂组。其中假手术组及IS 组给予生理盐水干预;治疗组以腹腔注射30 mg/kg布洛芬(1 mL/kg 的布洛芬药液为30 mg/kg)干预;抑制剂组以腹腔注30 mg/kg ML385 干预(1 mL/kg的ML385 为30 mg/kg);治疗+抑制剂组同时给予腹腔注射30 mg/kg 布洛芬、30 m/kg ML385 干预;每天干预1 次,连续干预1 周。
1.2.2 神经功能评分给药结束后,参考Zea-Longa评分对各组大鼠进行神经功能评分,评分越高,表明大鼠神经功能受损越严重。
1.2.3 TTC 检测大鼠脑梗死率各组随机选取3 只大鼠,麻醉大鼠并快速断头取脑,在-20 ℃下快速冷冻30 min,将大脑从额极到枕极切成2 mm厚的冠状切片,然后加入2% TTC 溶液在37 ℃下避光染色20 min,然后在4%多聚甲醛中固定2 h以上,正常组织为红色,而梗塞组织呈白色。通过Image J 软件分析梗塞区域,计算梗死率[(缺血对侧半球体积-缺血侧非梗死体积)/缺血对侧半球体积×100%]。
1.2.4 脑水肿含量测定各组随机选取3 只大鼠,取出大脑,制备5 mm 厚冠状脑切片,电子天平称取重量,记为脑湿重,然后在真空烘箱中100 ℃下干燥48 h 并重新称重,记为脑干重,计算脑水肿含量[(脑湿重-脑干重)/脑湿重×100%]。
1.2.5 样本采集各组剩余6 只大鼠经麻醉后,开颅取脑,快速取出缺血半暗带区域脑组织,一式2 份,一份经4%多聚甲醛固定,用于HE 染色;另一份保存在-80 ℃冰箱中用于试剂盒检验及qRTPCR、Western blot 检测。
1.2.6 HE检测大鼠脑组织神经元形态学变化取出1.2.5 中经4%多聚甲醛固定的脑组织,经脱水,石蜡包埋后,制备厚度为4 μm 切片,经HE 染色后,在光学显微镜观察脑组织中神经元形态学变化。
1.2.7 试剂盒检测大鼠脑组织中铁离子含量变化取出1.2.5 中部分脑组织0.25 g 制作组织匀浆,离心取上清,按照铁离子试剂盒说明书操作,进行检测脑组织中铁离子含量。
1.2.8 qRT⁃PCR 检测脑组织中SLC7A11、GPX4 mRNA 表达水平使用TRIzol 试剂从组织提取RNA,将RNA 以逆转录盒逆转录为cDNA,以cDNA为模板,以Applied Biosystems 7900 实时PCR 系统上进行RT-qPCR,引物序列为GPX4,上游引物5′-AAGGACCTGCCCCACTATTTC-3′,下游引物5′-ACGCTGGATTTTCGGGGTCT-3′;SLC7A1,上游引物5′-GGTACTGCAATCACAATGCCAGA-3′,下游引物5′-GCACATGCATCAAGAGTTTCCATAA-3′;βactin,上游引物5′-CATGTACGTTGCTATCCAGGC-3′,下游引物5′-CTCCTTAATGTCACGCACGAT-3′,2-ΔΔCt方法计算基因表达。
1.2.9 Western blot 检测脑组织中Nrf2/SLC7A11/GPX4 信号通路相关蛋白表达使用RIPA 裂解缓冲液从剩余脑组织中提取蛋白质,分离并转膜上,封闭之后将膜与Nrf2、SLC7A1、GPX4 一抗在4 ℃下孵育过夜。第2 天,将膜与二抗在室温下孵育1 h。使用ECL 检测试剂显色条带,Image J 软件用于分析蛋白条带,其中β-actin 作为内参。
1.3 统计学方法采用SPSS 27.0统计软件分析实验数据,P< 0.05时,认为差异有统计学意义。计量资料以均数±标准差表示;单因素方差分析用于多组间比较,以SNK⁃q检验进一步两两比较。
2 结果
2.1 布洛芬对各组大鼠神经功能评分、脑梗死率、脑水肿及铁离子含量的影响神经功能评分、脑梗死率、脑水肿、铁离子含量比较:IS 组较假手术组、抑制剂组较IS 组、治疗+抑制剂组较治疗组增加,但治疗组较IS 组、治疗+抑制剂组较抑制剂组降低(P< 0.05)。见表1。
表1 各组大鼠神经功能评分、脑梗死率、脑水肿、铁离子含量的比较Tab.1 Comparison of neurological function score,cerebral infarction rate,brain edema and iron ion content of rats in each group ±s

表1 各组大鼠神经功能评分、脑梗死率、脑水肿、铁离子含量的比较Tab.1 Comparison of neurological function score,cerebral infarction rate,brain edema and iron ion content of rats in each group ±s
注:与假手术组比较,aP<0.05;与IS组比较,bP<0.05;与治疗组比较,cP<0.05;与抑制剂组比较,dP<0.05
组别假手术组IS组治疗组抑制剂组治疗+抑制剂组铁离子含量95.12±9.51 171.29±17.13a 99.38±9.94b 216.45±21.65b 189.72±18.98cd神经功能评分(分)0.00±0.00 2.11±0.22a 0.84±0.10b 3.16±0.32b 1.52±0.16cd脑梗死率(%)0.00±0.00 20.51±2.06a 11.29±1.13b 32.19±3.22b 19.43±1.95cd脑水肿含量(%)62.34±2.14 71.15±2.32a 63.15±2.12b 81.42±3.15b 72.11±2.25cd
2.2 布洛芬对大鼠脑组织神经元形态学的影响假手术组大鼠脑组织中神经元结构清晰、排列紧密;IS 组细胞形态模糊不清,排列无规则,神经元数目减少;治疗组神经元变性有所改善;抑制剂组神经元数目骤减,细胞排列杂乱无章,细胞核严重固缩;治疗+抑制剂组神经元数目及细胞排列稍有所改善。见图1。
2.3 布洛芬对大鼠脑组织SLC7A11、GPX4 mRNA表达水平SLC7A11、GPX4 mRNA 表达:IS 组较假手术组、抑制剂组较IS 组、治疗+抑制剂组较治疗组均降低,但治疗组较IS 组、治疗+抑制剂组较抑制剂组均增加(P< 0.05)。见表2。
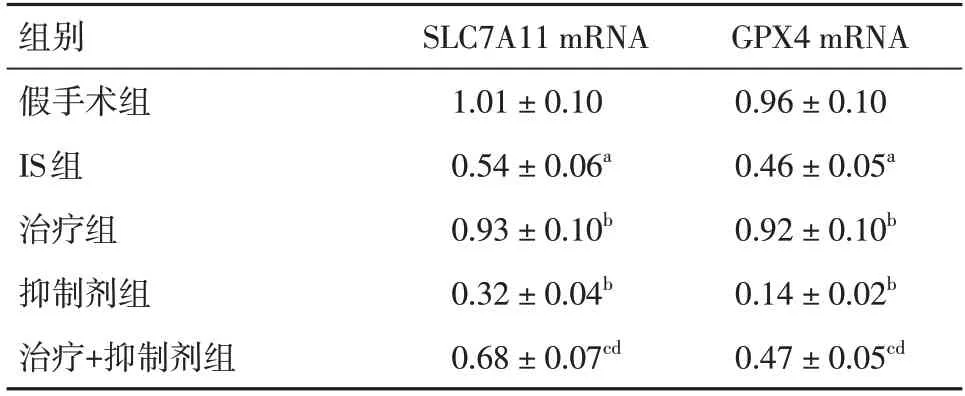
表2 各组大鼠脑组织中SLC7A11、GPX4 mRNA 表达的比较Tab.2 Comparison of the expression of SLC7A11 and GPX4mRNA in brain tissue of rats in each group xˉ±s
2.4 布洛芬对大鼠脑组织Nrf2/SLC7A11/GPX4通路相关蛋白的表达水平Nrf2、SLC7A11、GPX4表达比较:IS 组较假手术组、抑制剂组较IS 组、治疗+抑制剂组较治疗组降低,但治疗组较IS 组、治疗+抑制剂组较抑制剂组增加(P< 0.05)。见图2、表3。
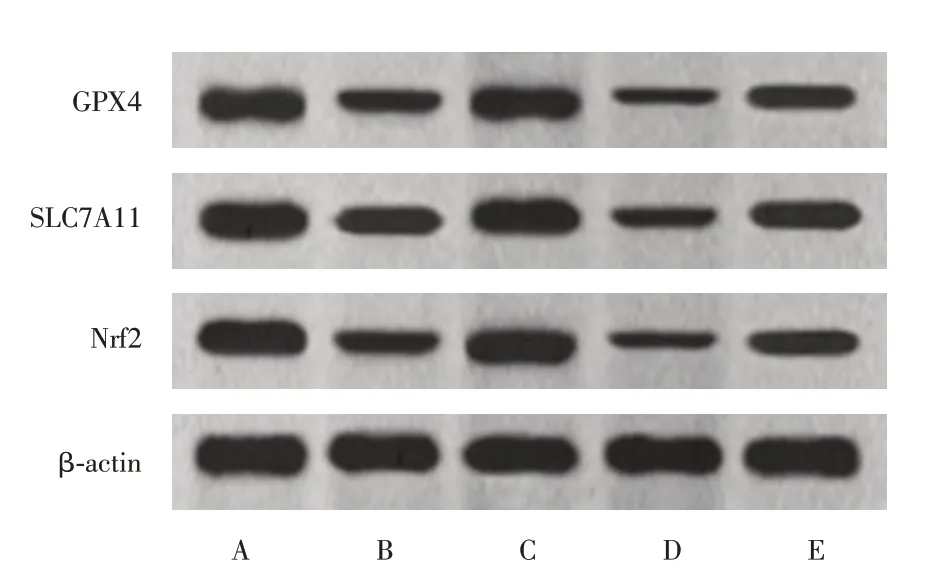
图2 大鼠脑组织中各蛋白表达(Western blot 图)各组大鼠脑组织中Nrf2、SLC7A11、GPX4 表达的比较Fig.2 Expression of proteins in rat brain (Western blot)Comparison of expression of Nrf2,SLC7A11 and GPX4 in brain tissue of rats in each group
表3 各组大鼠脑组织中Nrf2、SLC7A11、GPX4 表达的比较Tab.3 Comparison of expression of Nrf2,SLC7A11 and GPX4 in brain tissue of rats in each group ±s

表3 各组大鼠脑组织中Nrf2、SLC7A11、GPX4 表达的比较Tab.3 Comparison of expression of Nrf2,SLC7A11 and GPX4 in brain tissue of rats in each group ±s
注:与假手术组比较,aP < 0.05;与IS组比较,bP < 0.05;与治疗组比较,cP < 0.05;与抑制剂组比较,dP < 0.05
GPX4/β-actin 0.76±0.08 0.43±0.05a 0.72±0.08b 0.19±0.02b 0.49±0.05cd组别假手术组IS组治疗组抑制剂组治疗+抑制剂组Nrf2/β-actin 0.94±0.10 0.43±0.05a 0.86±0.09b 0.18±0.02b 0.52±0.06cd SLC7A11/β-actin 1.16±0.12 0.64±0.07a 1.02±0.11b 0.35±0.04b 0.67±0.07cd
3 讨论
缺血性中风可占中风病例的约80%,局灶性缺血性中风是由大脑中动脉闭塞引起的,导致血液供应不足使神经细胞中葡萄糖和氧气短缺,致使神经功能受损,给患者和社会都带来了沉重的经济负担[11]。由于静脉溶栓治疗中风的窗口期较短,许多患者没有得到及时治疗,因此有必要开发新的治疗策略[12]。
布洛芬是一种非甾体抗炎药,具有解热、抗炎和镇痛作用[13]。本研究发现IS 组大鼠神经元数目减少,细胞排列无规则,神经功能评分增加,TTC染色显示脑梗死率增加,而经布洛芬干预后,脑梗死率降低,提示布洛芬对IS 大鼠神经功能障碍具有改善作用,与先前结果一致[14]。本研究还发现IS 组大鼠脑水肿含量增加,与前人研究结果一致[15],在此基础上布洛芬干预,脑水肿含量降低,可进一步表明布洛芬可保护IS 大鼠神经功能。此外,布洛芬对短暂前脑缺血的大鼠可减少炎性因子的分泌,具有神经保护作用[16]。布洛芬还可减少神经元损伤,降低宫内生长受限新生儿大脑的炎症反应,可作为保护新生儿大脑的潜在治疗策略[17]。本研究推测布洛芬可能通过抗炎作用降低神经功能评分,抑制脑梗死率、脑水肿含量,进而发挥对IS 大鼠神经功能的保护作用,但相关实验验证还在进行中。
GPX4 是一种抗氧化防御酶,是多种细胞类型中铁死亡的关键调节因子,通过诱导铁死亡并引发前脑神经元的神经变性[18]。Nrf2 是一种重要的抗氧化转录因子,可调节SLC7A11 和GPX4 的表达,如山奈酚通过激活Nrf2/SLC7A11/GPX4 信号通路保护氧-葡萄糖剥夺/再灌注诱导的神经元损伤及铁死亡[19]。本研究发现IS 组大鼠脑组织中Nrf2、SLC7A11、GPX4 表达降低,提示IS 大鼠神经受损可能与Nrf2/SLC7A11/GPX4 信号通路被抑制有关。除此之外,葡萄籽原花青素通过激活Nrf2/SLC7A11/GPX4 信号通路,减轻高糖高脂诱导的铁死亡,提高细胞生存率[20]。鹿红方可减轻心肌缺血再灌注损伤,可能是通过上调SLC7A11/GPX4 信号通路实现[21]。而本研究发现经布洛芬干预后,Nrf2、SLC7A11、GPX4 表达显著增加,大鼠神经受损得到改善,猜测布洛芬可能是通过激活Nrf2/SLC7A11/GPX4 信号通路改善IS 大鼠神经受损。为验证该猜测,实验在布洛芬干预的基础上以Nrf2 抑制剂-ML385 进行验证,结果发现ML385 逆转了布洛芬对IS 大鼠神经功能的保护作用,进一步表明布洛芬可以保护IS 大鼠神经功能受损,可能与激活Nrf2/SLC7A11/GPX4 信号通路介导的铁死亡有关。
综上所述,布洛芬通过激活Nrf2/SLC7A11/GPX4 信号通路实现对IS 大鼠神经功能的保护作用,为IS 治疗提供理论依据。但药物发挥作用机制较为复杂,文章仅从抑制剂方面进行验证,存在一定的不足,后续使用激活剂及炎症相关的实验均将进一步验证该结论。

