急性脑梗死血清SIRT1、ICAM-1、PLR 与颈动脉粥样硬化斑块的相关性分析
陈丽君 赵文杰 陈浩 陈瑞鹏 黄裕盛
急性脑梗死(Acute cerebral infarction,ACI)是指的是患者颅脑内部血流中断后引起的脑组织损伤与坏死,也称为急性缺血性脑卒中疾病,患者因神经元及相关细胞受损,导致残疾与死亡的发生,该种疾病的出现,严重影响患者生存质量与生命安全[1-2]。颈动脉粥样硬化(Carotid atherosclerosis,CAS)斑块的出现是ACI 的发病的病理基础,ACI 患者颅内血栓大多来自CAS 斑块脱落,故CAS 斑块的不稳定是导致ACI 发生的关键[3],基于此,探究与CAS 斑块稳定性相关的血清指标对了解与改善患者病情具有重要意义。血清沉默信息调节蛋白1(silent information regulator protein 1,SIRT1)属于一种组蛋白去乙酰化酶,在人体肾脏、脑部、脂肪等多个组织器官中分布,其与基因组及染色体的稳定有关,且参与了多种细胞反应的过程中[4],但目前探究其与CAS 斑块稳定性的研究较少。细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)属于炎性介质,能够改善血管内皮细胞的黏附功能,与脑梗死等多种疾病的发生有关[5]。血小板/淋巴细胞(Platelets/lymphocytes,PLR)是一种新型炎症标志物,其表达水平的上升或与患者凝血功能及炎性状况有关,已在多类疾病预后情况的评估中发挥作用[6]。因此,本研究将探究以上指标在CAS 斑块稳定性中的作用,为ACI 患者预后良好提供研究依据。
1 资料与方法
1.1 一般资料
将海南医学院第一附属医院神经内科2020 年12 月至2022 年12 月 收治的122 例ACI 患者作为研究对象,分析其临床资料,将该组为观察组。纳入标准:①ACI 符合《中国急性缺血性脑卒中诊治指南2018》[7]标准,且经影像学确诊;②临床资料完整;③发病24 h 内入院;④未并发其他心脑血管疾病;⑤无严重的脏器功能异常;⑥无其他恶性肿瘤疾病;⑦无认知障碍、精神疾病。排除标准:①妊娠期、哺乳期女性;②抗凝药物使用史;③凝血功能异常;④严重感染性疾病;⑤自身免疫性疾病;⑥脑出血;⑦甲状腺疾病、动脉炎。另选取同期在本院行健康体检的50 例健康人群作为对照组。观察组122 例患者中,男性72 例、女性50 例;平均年龄(60.50±7.41)岁;平均体质量指数(body mass index,BMI)(23.23±2.10)kg/m2;吸烟史47 例、饮酒史37 例。对照组50 例患者中,男性30 例、女性20 例;平均年龄(60.23±7.06)岁;平均BMI(23.30±2.25)kg/m2;吸烟史19例、饮酒史15 例。两组患者一般资料比较差异无统计学意义(P>0.05),具可比性。患者均知情且签署同意书,本研究符合医学伦理委员会审批标准。
1.2 方法
颈动脉超声:使用GE730 彩色多普勒超声诊断仪(探头频率5~10 MHz),嘱咐患者采取平卧位,在其肩膀下放置软枕,将患者头偏向一侧,充分暴露颈部,观察患者颈动脉内膜结构、斑块位置、形状及大小、内部回声及血清状况、光滑情况、增厚情况,测量双侧颈动脉及分叉部位和颅外段颈动脉内中膜厚度(Carotid intima-media thickness,CIMT),并计算平均值作为最终结果。依据《中国头颈部动脉粥样硬化诊治共识》[8]标准对CAS 斑块稳定性进行划分,CIMT≥1.5 mm 则为CAS。稳定斑块:表面光滑、向管腔内凸起、内部回声均匀。不稳定斑块:表明不光滑、内部低回声、呈现似火山口壁龛影、板块厚度与对策内中膜厚度比值超过2 mm。由此将122 例ACI 患者分为39 例稳定组与83 例不稳定组。
患者抽血前禁水禁食6 h,抽取清晨空腹静脉血4 mL,进行离心,离心半径为8 cm,速度3 000 r/min,10 min,完成后取上层血清-80℃保存备测。运用酶联免疫吸附法检测SIRT1、ICAM-1 水平,上海恒远生化有限公司生产制造的酶联免疫检测试剂盒,检测方法严格按照试剂盒所示。采用Sysmex XN-2800 血液分析仪测定淋巴细胞、血小板计数情况,PLR=血小板/淋巴细胞,血小板参考范围100~300×109/L,淋巴细胞参考范围0.8~4.0×109/L[9]。
1.3 统计学处理
采用SPSS 22.0 统计软件进行数据分析,计数资料用n(%)表示,进行χ2检验;符合正态分布的计量资料用(±s)表示,两组间比较行t检验,多组间比较采用单因素ANOVA 方差分析;使用Pearson 相关性分析血清SIRT1、ICAM-1、PLR 指标与CAS 斑块稳定性的关系,使用ROC曲线判断血清SIRT1、ICAM-1、PLR 水平对CAS斑块稳定性的诊断效能,以P<0.05 为差异有统计学意义。
2 结果
2.1 ACI 病例影像学检查结果
ACI 患者影像学检查结果(女性)。见图1。

图1 头颅DWI 图Figure 1 Skull DWI in a female
2.2 两组患者血清SIRT1、ICAM-1、PLR 水平比较
观察组血清SIRT1 显著低于对照组,ICAM-1、PLR 水平显著高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者血清SIRT1、ICAM-1、PLR 水平比较(±s)Table 1 Comparison results of serum SIRT1,ICAM-1 and PLR levels between the observation group and the control group(±s)

表1 两组患者血清SIRT1、ICAM-1、PLR 水平比较(±s)Table 1 Comparison results of serum SIRT1,ICAM-1 and PLR levels between the observation group and the control group(±s)
2.3 观察组、稳定组与不稳定组患者血清SIRT1、ICAM-1、PLR 水平比较
稳定组血清SIRT1 显著高于观察组、不稳定组,ICAM-1、PLR 水平显著低于观察组、不稳定组,差异均具统计学意义(P<0.05)。见表2。
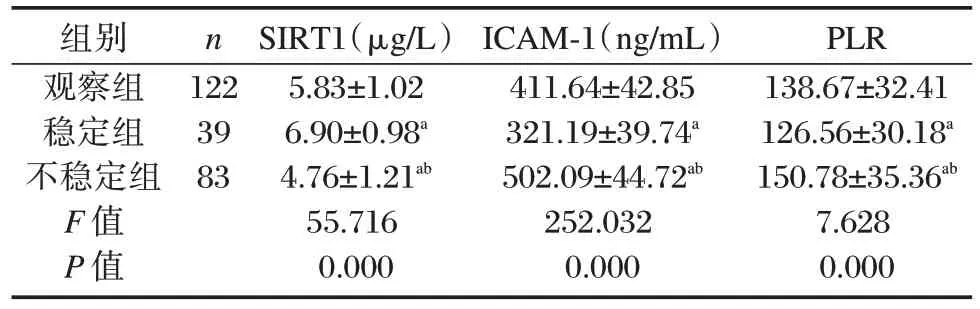
表2 观察组、稳定组与不稳定组患者血清SIRT1、ICAM-1、PLR 水平比较结果Table 2 Comparison of serum SIRT1,ICAM-1,and PLR levels among patients in the observation group,stable group,and unstable group
2.4 血清SIRT1、ICAM-1、PLR 与CAS 斑块稳定性相关性分析
Pearson 相关性分析结果显示,CAS 斑块稳定性与血清SIRT1 呈现显著负相关,与ICAM-1、PLR呈现显著正相关(P<0.05)。见表3。
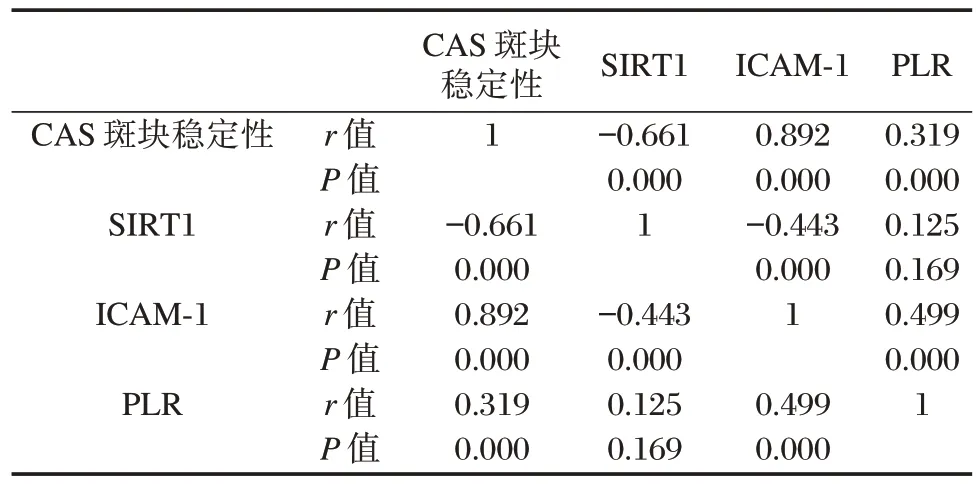
表3 血清SIRT1、ICAM-1、PLR与CAS斑块稳定性相关性分析Table 3 Correlation analysis results of serum SIRT1,ICAM-1,PLR and CAS plaque stability
2.5 血清SIRT1、ICAM-1、PLR 诊断CAS 斑块稳定性价值分析
ROC 曲线分析显示,血清SIRT1、ICAM-1、PLR 诊断CAS 斑块稳定性的AUC 依次为0.929、0.998、0.692,均有较高的诊断价值(P<0.05)。见表4、图2。

表4 血清SIRT1、ICAM-1、PLR 诊断CAS 斑块稳定性价值分析结果Table 4 Analysis results of the value of serum SIRT1,ICAM-1 and PLR in diagnosing CAS plaque stability

图2 血清SIRT1、ICAM-1、PLR 诊断CAS 斑块稳定性的ROC 曲线Figure 2 ROC curve of serum SIRT1,ICAM-1 and PLR in diagnosis of CAS plaque stability
3 讨论
CAS 斑块是广泛动脉粥样硬化的标志物,也是引起患者血栓栓塞的关键因素,在ACI 患者中,CAS 斑块的出现预示着病情的进展[10]。不稳定的CAS 斑块表现为出现新生血管、巨噬细胞浸润等,与患者机体炎性情况有关[11]。因此,对引起ACI患者CAS 斑块不稳定的相关指标进行分析是预防其病情发展及复发风险上升的关键。
本研究结果提示以上三项指标在ACI 患者CAS 后出现水平不稳定的上升或下降情况,或与疾病发生及进展有关,探究其原因在于:SIRT1 是一种第三类组蛋白去乙酰化酶,与脑出血、糖尿病、高血压及冠状动脉粥样硬化等疾病的发生均有关[12]。SIRT1 在细胞核上表达,通过改变其他蛋白乙酰化的状态,维持基因组的稳定,该指标还参与氧化应激、细胞代谢、细胞凋亡等反应过程,促进了多个疾病的发展[13]。本研究中CAS 斑块不稳定患者的SIRT1 水平较低,表示其抗CAS 形成及稳定斑块的作用降低,提示高水平的SIRT1 有力抗CAS 形成,并维持斑块的稳定性。这是因为SIRT1 对于促炎性因子表达具有抑制作用,能够有效改善患者病理损伤,其通过抑制低密度脂蛋白引起的细胞凋亡与动脉血管内皮细胞氧化应激反应,达到保护ACI 患者动脉血管内皮细胞功能的作用。ICAM-1 是一种在细胞表面存在的免疫球蛋白,以往研究多将他作为血管内皮受损的标志物,当患者的脑部血管受损后,ICAM-1 指标通过调节白细胞及血管内皮细胞的作用,从而加强白细胞向脑部损伤区域的浸润,导致患者炎性因子水平上升,炎症反应加剧[14]。本研究发现CAS 斑块不稳定组患者的ICAM-1 水平更高,表示患者神经细胞受损严重,机体炎性反应明显。这是因为ICAM-1 在内膜中跨内膜迁移,导致白细胞在血管壁内堆积,促进CAS 的形成,CAS 形成后患者血管内皮细胞受损程度更严重,缺氧及再灌注损伤等均又导致炎性因子释放,ICAM-1 水平上升,故造成CAS 斑块的不稳定。PLR 是新的免疫生物标志物,其在CAS 斑块不稳定患者中表达量上升预示着血小板浓度上升,淋巴细胞计数下降,这两者的变化导致了动脉粥样硬化的进程加速,导致狭窄及斑块不稳定的发生[15]。PLR 指标不但能够反应ACI 患者炎性情况,且随着该水平的上升,患者的预后状况更差。高水平的PLR 预示着斑块脱落的风险,且与斑块的易损性有关,值得临床关注。而后进一步采取ROC 曲线分析,发现SIRT1、ICAM-1、PLR 诊断ACI 患者CAS 斑块稳定性时,ICAM-1 的诊断敏感度最高,PLR 诊断敏感度最低,这可能是因为:ICAM-1 是介导黏附反应的重要黏附分子,在控制肿瘤恶化、转移及调节机体免疫中发挥关键作用,对于CAS 斑块存在的ACI 患者而言,CAS 斑块的稳定性与其预后密切相关,ICAM-1 水平的敏感度高则能够通过很好的预测斑块稳定性来达到为患者早期诊治、干预提供科学依据的目的。PLR 指标受到血小板与淋巴细胞的影响,在血细胞分析仪检查中,可能存在样本数量并不庞大导致的结果出现影响,故不作出深究。
综上所述,ACI 患者出现CAS 斑块不稳定后血清SIRT1 水平下降、ICAM-1、PLR 水平上升,三项指标均与CAS 斑块稳定性相关性显著,能够将其作为预测CAS 斑块稳定性的有效因子。但本研究还存在一些不足之处,例如并非大样本量的回顾性研究,且因ICAM-1 指标诊断的敏感度较高,故未进行联合因子的诊断分析,在今后的研究中将会改进,使研究内容更丰富、研究结果可信度更高。

