发酵酒糟对西威牛血液及瘤胃菌群的影响
禹光美,郑如雯,吴道义,王 彬,黄 涛
(1.贵州大学动物科学学院,贵州贵阳 550025;2.毕节市畜牧兽医科学研究所,贵州毕节 551700)
近年来,我国牛肉产量保持平稳增长态势。2020 年我国牛肉产量达672.5 万t,同比增长0.77%。从消费量来看,2019 年我国牛肉消费量为832.93 万t,同比增长11.36%[1-2]。饲料是生产肉、蛋和奶的主要投入成本。2019 年我国反刍动物饲料产量为1 108.9 万t,同比增长9.0%,其中肉牛饲料产量增长32.5%[3]。随着养殖业发展,粮食资源消耗也随之增加。据统计[4],截至2019 年底,全国耕地总面积约1.29 亿hm2(约19.18 亿亩),较10 年前减少0.08 亿hm2(约1.13 亿亩)。由此可见,耕地逐年减少。因此可以说,21 世纪我国的粮食问题,实际上是解决养殖业所需的粮食饲料问题[5]。
合理利用饲料资源是解决饲料危机的可行方法。酒糟(distiller's grains,DGS)是生产乙醇产生的谷物副产品,具有较高的营养价值[6]。鲜DGS 水分含量高,酸度较大,成分复杂,易发霉变质难以储存,同时会渗出污水[7-8]。因此,发酵酒糟(fermented distiller's grains,FDGS)是较好的利用方式。Melini 等[9]研究发现,发酵工艺可以提高牛奶、谷物、果蔬、肉类和鱼类的抗氧化活性。微生物在生产发酵饲料(fermented feeds,FF)中得到了广泛应用,如乳酸菌、酵母菌、放线菌、霉菌、枯草芽孢杆菌和曲霉[10-11]。DGS 通过微生物发酵成为FDGS,提高了DGS 的饲用价值、营养养分的生物利用率并降低了抗营养因子[12-13]。FF 在提高犊牛蛋白质体外消化率和氨表观消化率方面有重要作用[14]。除此之外,FF 在提高增重效率、增强育肥牛抵抗热应激能力及改善育肥牛瘤胃菌群丰度上也发挥了作用[15]。因此,本文探讨FDGS 对西威牛血液及瘤胃菌群的影响,以期为FDGS 的科学应用提供数据。
1 材料
1.1 发酵白酒糟制备
基质配制:80%的酒糟,配以5%的玉米粉、5%的菜籽饼,最后用10%的水混匀,以手捏指缝见水不滴为宜。其中酒糟为茅台酒糟,玉米由当地农户生产,菜籽饼从贵州省纳雍县购入。复合菌种配制:将酵母菌粉、根霉曲、乳酸菌粉分别按60%、30%、10%的比例混合均匀,用无菌塑料袋包装,室温保存备用。在基质上接种复合菌发酵制备FDGS。
1.2 试验动物及日粮
选用年龄为(1.5 ± 0.5)岁,体况良好、体质量相近的贵州毕节本地健康杂交西威牛(西门塔尔牛♂×威宁黄牛♀)公牛18 头。采用单因子试验设计,随机将西威牛均分成3 组,每组6 头,对照组饲喂基础饲粮,试验I 组替换15% FDGS,试验II 组替换30% FDGS,日粮参照《肉牛饲养标准》(NY/T815—2004)。每头牛栓饲,自由饮水,分别于每日07:00 和16:00 喂食。试验日粮组成和营养水平如表1。预试期15 d,正式试验期90 d。玉米青贮由养殖场提供。

表1 试验日粮组成及营养水平
1.3 样本采集与测定
1.3.1 样本采集 正式试验第90 天,晨饲前对所有试验牛进行尾静脉采血,静置30 min 后,离心15 min(4 ℃,3 000 r/min),制备血清,分装后于-20 ℃保存待测。同时,使用口腔瘤胃导管采集试验牛瘤胃液,丢弃初次吸取的瘤胃液,再次吸取瘤胃液经4 层纱布过滤后分装于 冻存管中,立即投入液氮中保存待用。
1.3.2 血清生化指标测定 血清生化指标包括丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、白蛋白(ALB)、碱性磷酸酶(ALP)、尿素(UREA)、尿素氮(UN)、尿酸(UA)、甘油三酯(TG)、胆固醇(CHO)、葡萄糖(GLU)、直接胆红素(DBIL)、总胆红素(TBIL)。以上指标均采用全自动动物生化分析仪(BS-240VET)进行测定。
1.3.3 抗氧化指标测定 抗氧化指标包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSHPx)、丙二醛(MDA)、总抗氧化能力(T-AOC)。以上指标采用牛超氧化物歧化酶(SOD)试剂盒、牛谷胱甘肽过氧化物酶(GSH-Px)试剂盒、牛丙二醛(MDA)试剂盒、牛总抗氧化能力(T-AOC)试剂盒(上述试剂盒均购于南京建成生物工程研究所)进行检测。
1.3.4 瘤胃菌群结构测定 将采集的瘤胃液委托上海中科新生命生物科技有限公司进行样品DNA提取、建库和16S rDNA 扩增子高通量测序。对样品经16S rDNA测序得到的序列进行质控和过滤后,按相似度>97%的标准计算操作分类单位数目,然后对群落结构进行统计分析。
1.4 统计分析
试验数据用SPSS(26.0)软件进行分析,采用单因素方差分析(ANOVA)并以最小显著差法(LSD)确定差异显著性(P<0.05)和极显著差异水平(P<0.01)。数据用平均值± 标准误(mean±SEM)来表示。
2 结果与分析
2.1 FDGS 对西威牛血清生化指标的影响
结果(表2)显示,试验I 组、II 组西威牛血清AST 含量分别为(79.39±2.92)、(79.67±3.22)U/L,与对照组相比均显著升高(P<0.05);试验II 组西威牛血清ALP 和TG 含量分别为(150.01±4.63)U/L、(1.14±0.02)mmol/L,与对照组相比显著升高(P<0.05);两试验组血清ALB、TP 及GLU 等含量与对照组相比无显著差异(P>0.05)。
2.2 FDGS 对西威牛血清抗氧化指标的影响
结果(表3)显示,试验I 组、II 组血清T-AOC含量分别为(1.85±0.10)、(2.24± 0.13)U/mL,与对照组相比均显著升高(P<0.05);试验II 组血清SOD 和GSH-Px 含量分别为(18.82±1.82)和(241.76±14.42)U/mL,与对照组相比均极显著升高(P<0.01),血清MDA 含量为(18.17±0.75)nmol/mL,与对照组相比极显著降低(P<0.01)。
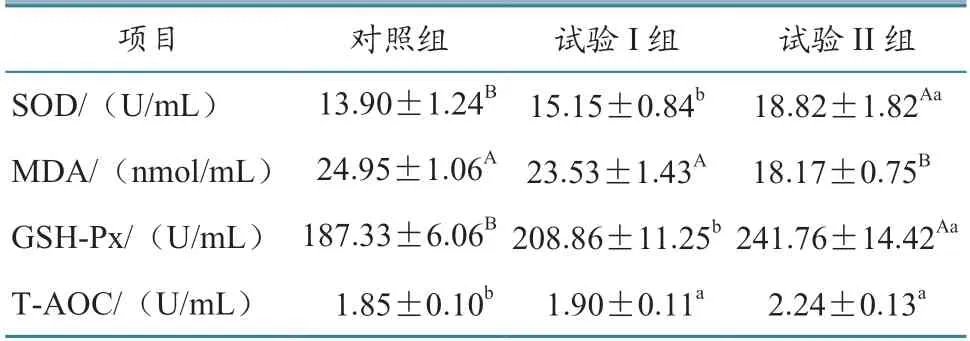
表3 FDGS 对西威牛血清抗氧化指标的影响结果
2.3 FDGS 对西威牛肠道菌群的影响
α 多样性指数的并列分析结果(表4)表明,Chao1、Shannon、Simpson 和ACE 指数在各组之间没有显著差异(P>0.05),各组间种群数量和组成结构类似,且菌群丰度较大,菌群多样性也处于较高水平。
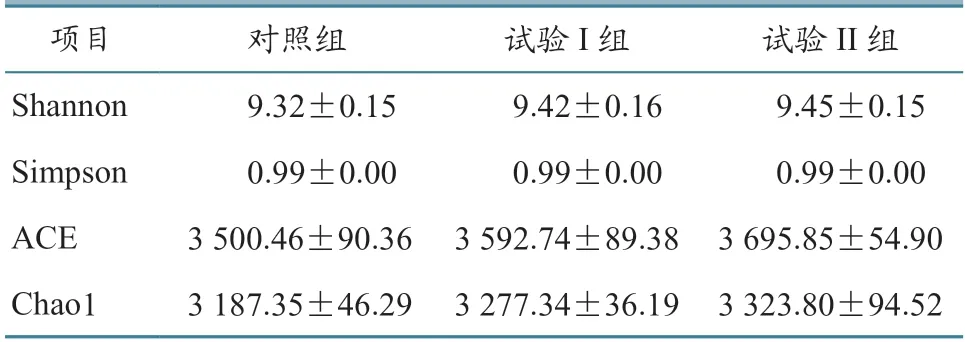
表4 α 多样性指数
2.3.1 FDGS 对西威牛肠道菌群门水平的影响本试验条件下的瘤胃优势菌群门水平如图1 所示。瘤胃微生物门水平优势门为厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),占瘤胃微生物门类的80%以上。其中,Firmicutes 和Bacteroidetes 在FDGS 组和对照组中无显著差异(P>0.05)。Firmicutes 随着FDGS 饲喂量的增多呈下降趋势,Bacteroidetes 随着FDGS 饲喂量的增多呈升高趋势(0.05 <P<0.10)。试验I 组、II 组广古菌门相对丰度(Euryarchaeota)显著低于对照组(P<0.05)。试验I 组绿弯菌门(Chloroflexi)相对丰度显著高于对照组(P<0.05),试验II 组极显著高于对照组(P<0.01)。
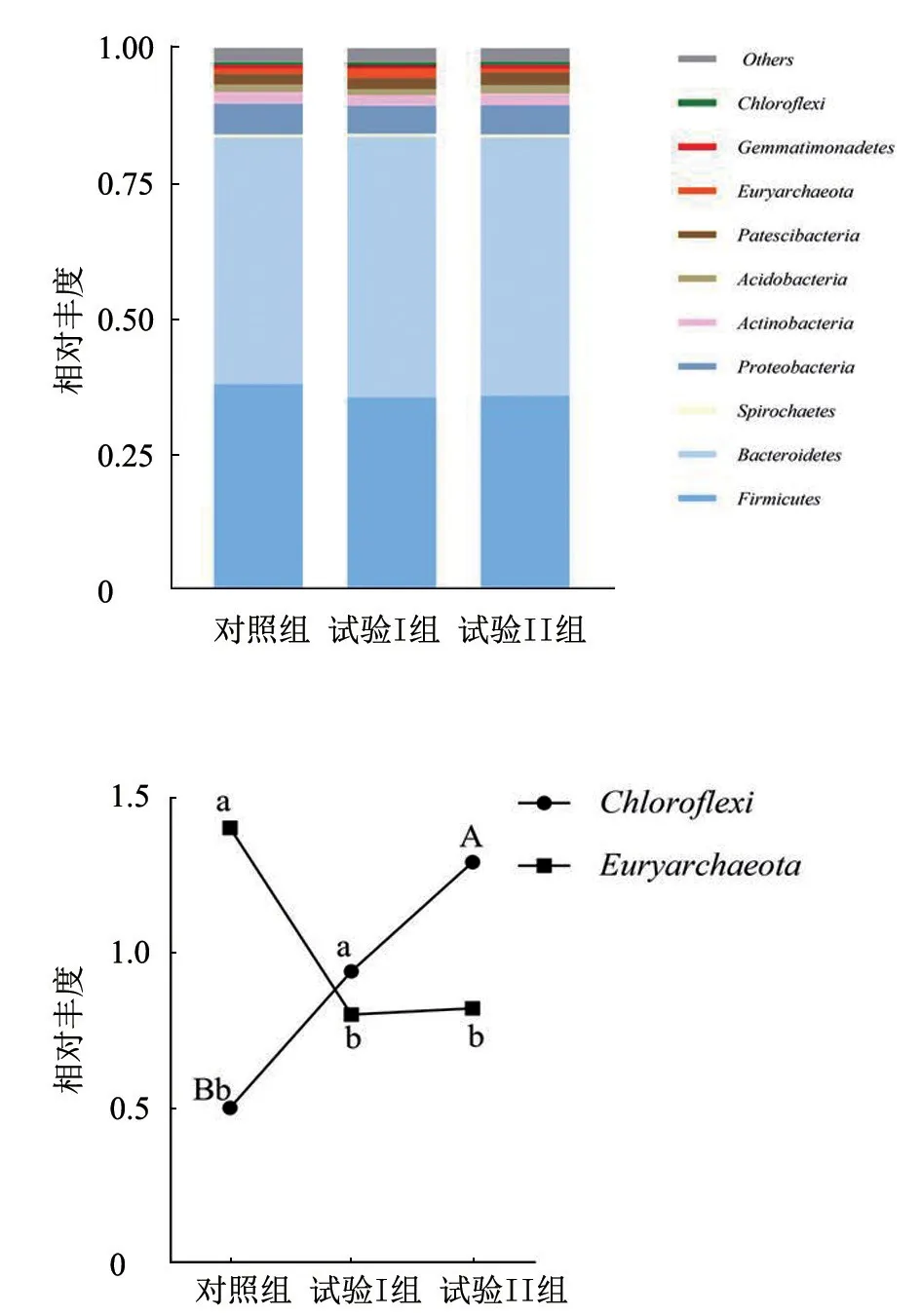
图1 FDGS 对西威牛瘤胃菌群门水平的影响
2.3.2 FDGS 对西威牛肠道菌群属水平的影响本试验条件下的瘤胃优势菌群属水平见图2。瘤胃微生物在属水平上的优势菌为理研菌属RC9(RikenellaceaeRC9 gut group)、疣微菌科UCG-005 群(Ruminococcaceae UCG-005)、密螺旋体属2(Treponema2)、未培养的细菌(uncultured bacterium)、普雷沃氏菌科UCG-003群(Prevotellaceae UCG-003)、疣微菌科UCG-010 群(Ruminococcaceae UCG-010)、未培养的瘤胃细菌(uncultured rumen bacterium)、经黏液真杆菌属(Blautia)、普雷沃氏菌属1(Prevotella1)、真杆菌属(Eubacteriumcoprostanoligenesgroup)和其他属。各属间均无显著差异(P>0.05)。
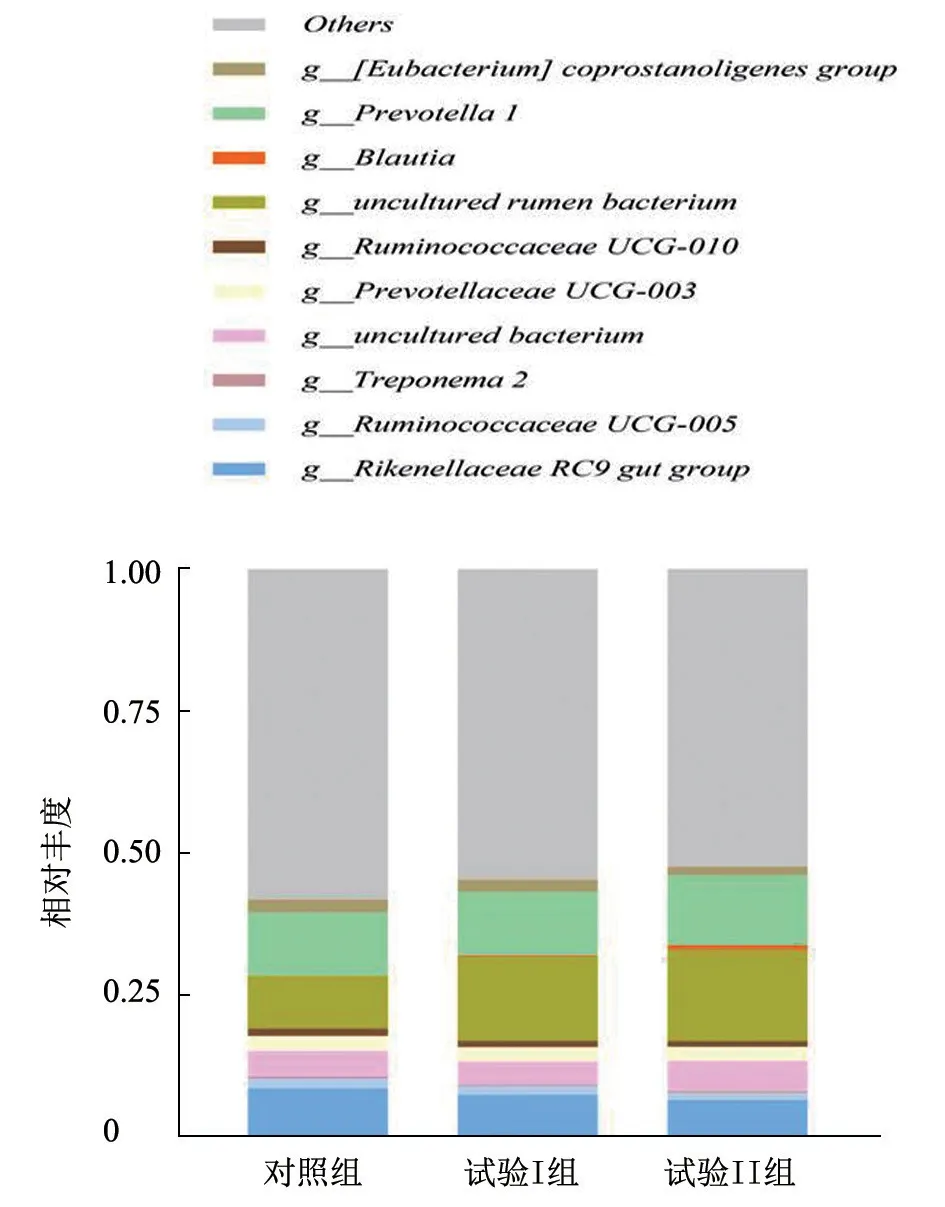
图2 FDGS 对西威牛瘤胃菌群属水平的影响
3 讨论
3.1 FDGS 对西威牛血清生化指标的影响
血液检验是了解动物健康状态不可缺少的项目[16]。血清生化指标在动物健康状况的评估和管理中具有重要作用,可提供有关内脏、营养状况、代谢状况等信息。本试验血清生化指标分析结果显示,血液ALB、TP 及GLU 含量无显著差异(P>0.05),表明添加FDGS 对西威牛蛋白质和能量代谢无显著影响。ALB 被认为是一种阴性急性期蛋白[17],浓度低于正常值时表明肝功能受损。本试验中,组间ALB 无显著差异,表明添加FDGS 并未对西威牛肝功能造成损伤。TP 是评价动物营养代谢状态的指标,可间接反映动物的健康和免疫水平。具体地说,TP 反映了饮食蛋白质含量、肝脏代谢能力及因病变引起蛋白质损失的情况,较高的血清TP 水平可以促进组织发育[18]。AST、ALP 是常见的肝脏疾病指标。试验II 组AST 和ALP 含量显著高于对照组,试验I 组AST 显著升高(P<0.05),而AST 和ALP 正常范围分别为(95.38 ± 30.14)U/L 和0~488 U/L[19],本试验各试验组AST 和ALP 含量并未超过上述范围,说明添加30% FDGS 对西威牛肝功能无消极影响。TG是脂肪代谢以及脂肪和碳水化合物消化的重要指标。结果表明,试验II 组TG 含量显著提高(P<0.05)。这可能是由于脂肪吸收和代谢变慢导致。正常情况下,含有高饱和脂肪酸的脂肪会提高TG水平[20]。生化结果提示,添加FDGS 对西威牛的肝脏无消极影响,且提高了脂肪形成能力。
3.2 FDGS 对西威牛血清抗氧化指标的影响
动物机体的抗氧化能力与机体健康状况联系密切。动物机体有一套高效抗氧化的天然屏障系统,包括GSH-Px 和SOD 等抗氧化酶[21]。本试验中,试验II 组GSH-Px 含量极显著高于对照组(P<0.01)。GSH-Px 是动物机体内广泛存在的一种重要抗氧化物酶,能保护机体组织大分子免受氧自由基侵袭,从而提高机体免疫力和抗病能力[22]。本试验中,试验II 组SOD 含量极显著高于对照组(P<0.01)。SOD 在调节体内氧化还原方面具有重要作用,包括清除体内有害自由基、保护细胞免受损伤、减轻自由基导致的氧化损伤。检测SOD 含量可以间接了解自由基在体内的状况和机体清除氧自由基的能力及机体组织氧化、抗氧化系统的功能状态[23]。本试验中,试验I 组和II 组T-AOC 含量显著高于对照组(P<0.05)。T-AOC可以作为衡量动物机体抗氧化酶和非酶系统状况的综合型指标,可反映动物机体抗氧化酶系统和非酶系统对外源刺激的代偿能力和动物机体自由基代谢状况[24]。本试验中,试验II 组MDA 极显著低于对照组(P<0.01)。氧自由基可诱发机体一系列损伤,其中最重要的是触发细胞膜上的多不饱和脂肪酸发生脂质过氧化链式反应,产生MDA 等脂质过氧化物,其可作为直接证据和间接反映细胞膜损伤程度的指标。本试验中FDGS 组均提高了西威牛的抗氧化指标,提示添加FDGS 对西威牛的健康有促进作用。
3.3 FDGS 对肉牛瘤胃菌群的影响
肠道微生物群是栖息在胃肠道中的复杂微生物群落,与动物宿主建立了密切的共生关系。肠道微生物群具有广泛的保护、结构和代谢功能,如防止病原体定殖、加工食物合成维生素(如维生素B12 和维生素K)、分解宿主不能消化的复合碳水化合物来获取能量[25]。α 多样性关注的是局部同质环境中的物种数量。本试验条件下各组间的α多样性指数均无显著性差异(P>0.05),表明添加FDGS 对西威牛瘤胃微生物多样性未造成明显影响。这与李鹏程[26]研究啤酒糟对育肥羊瘤胃微生物的影响结果一致。本试验西威牛瘤胃微生物门水平的优势菌为Firmicutes 和Bacteroidetes,与先前的研究结果[27-29]一致。Bacteroidetes 主要功能是从碳水化合物和蛋白质中获取能量,本试验瘤胃菌群中,Bacteroidetes 随着FDGS 饲喂的增多呈上升趋势,提示饲喂FDGS 可使瘤胃摄取能量的能力得到适应性增强。而Firmicutes 随着FDGS 饲喂量的增多呈下降趋势。过去的研究数据[30]表明,细菌组成或多样性变化通常与微生物区系代谢谱变化有关,会影响动物健康,因此也将Firmicutes/Bacteroidetes 认为可能是肥胖的标志。有研究[31]发现,体脂高与低的人相比,Firmicutes 减少,Bacteroidetes 增多,肥胖的人肠道中Firmicutes/Bacteroidetes 比例下降[32],与本试验结果相似。因此,肠道微生物群与脂肪沉积有着密不可分的联系。然而,也有研究[33]指出,Firmicutes 能更有效地从食物中吸收热量,从而增肥,这与本试验中Firmicutes 减少的结果不一致。推测原因为,试验结果不是由某一种细菌改变引起的,与多方面因素有关,因为机体内微生物多样性随时间改变的变化很小。古菌的丰度较低,均在1%左右。Euryarchaeota 是一种产甲烷菌[34],而Chloroflexi与甲烷氧化有关[35]。FDGS 组Euryarchaeota 相对丰度显著低于对照组(P<0.05),表明饲喂FDGS 会降低瘤胃产甲烷量,即FDGS 组在甲烷排放量方面优于对照组。试验I 组Chloroflexi 相对丰度显著高于对照组(P<0.05),试验II 组Chloroflexi 极显著高于对照组(P<0.01),表明饲喂FDGS 会增强瘤胃内甲烷氧化,降低甲烷排放量。由此可见,饲粮添加FDGS 能减少甲烷排放量。甲烷是一种强效温室气体,其温室效应是二氧化碳的21 倍以上。此外,也有研究[36]认为,反刍动物释放的甲烷是饲料能量的损失。因此,饲粮添加FDGS 能改善瘤胃微生物结构,提高饲料利用率,降低瘤胃甲烷产量。减少排放温室效应气体,也促进了农业可持续性发展。本试验属水平优势菌为理研菌属RC9、疣微菌科UCG-005 群、密螺旋体属2、普雷沃氏菌科UCG-003 群、疣微菌科UCG-010 群、经黏液真杆菌属、普雷沃氏菌属1 和真杆菌属。试验组各属间均无显著差异(P>0.05)。饲粮添加FDGS 对西威牛瘤胃菌群优势菌属的相对丰度没有影响,与之前报道[37]一致,菌群具体差异需进一步研究。
4 结论
本试验中,15%和30% FDGS 均可在一定程度上提高试验动物AST、ALP 含量以及抗氧化指标,但AST 和ALP 含量均处于正常范围内,表明添加FDGS 并未引起西威牛肝脏损伤,且能提高动物机体健康和对外界环境的适应性。同时,物种组成分析显示,瘤胃优势菌群组成未受FDGS 添加的影响,而FDGS 组Euryarchaeota 和Chloroflexi均有显著改变,表明添加FDGS 不会影响西威牛瘤胃菌群的主要组成,但能使瘤胃菌群组成朝着甲烷产量减少的方向改善。
