正呼肠孤病毒反向遗传系统及病毒载体研究进展
黄 冬,邵 钰,王睿智,包世俊
(1.甘肃农业大学,甘肃兰州 730070;2.青岛蔚蓝生物股份有限公司,山东青岛 266100)
正呼肠孤病毒属(Orthoreovirus)为呼肠孤病毒科(Reoviridae)刺突呼肠孤病毒亚科(Spinareovirinae)的一员,包括哺乳动物正呼肠孤病毒(mammalian orthoreovirus,MRV)、狒狒正呼肠孤病毒(baboon orthoreovirus,BRV)、禽正呼肠孤病毒(avian orthoreovirus,ARV)、尼尔森湾正呼肠孤病毒(Nelson Bay orthoreovirus,NBV)以及爬行动物正呼肠孤病毒(reptilian orthoreovirus,RRV)[1]。其中MRV 和ARV 是正呼肠孤病毒属的代表毒株。MRV 共4 个血清型,有红细胞凝集活性[2],其自然宿主为人和各种哺乳动物,在健康和患病动物体内广泛存在,可引起人轻度上呼吸道疾病和胃肠道疾病,以及受感染动物的急性肠胃炎、肺炎、脑炎等,严重时可导致动物死亡。ARV 有11 个血清型,无血凝性,可感染各种禽类,如鸡、鸭、鹅、野鸟等。禽感染ARV 后表现关节炎、免疫抑制或神经、呼吸系统疾病等症状[3]。近年来,养殖禽群ARV 阳性率越来越高[4-5],经济损失巨大。
正呼肠孤病毒属病毒(简称正呼肠孤病毒)具有双层衣壳结构,病毒粒子直径为70~80 nm,呈20 面体对称。以MRV 为例,其病毒外衣壳表面均匀分布着12 个突起的顶点,内衣壳包裹病毒基因组(图1)。病毒基因组包含10 条双链RNA(dsRNA),其中长片段3 条(L1、L2、L3),中片段3 条(M1、M2、M3),短片段4条(S1、S2、S3、S4)[6-7];共编码8 种结构蛋白(σ1、σ3 和μ1 构成外层衣壳,σ2、λ1、λ2、λ3和μ2 构成内层衣壳)和4 种非结构蛋白。每个编码区两端都有一段较短的非编码区(UTR),其5'端GCUA、3'端UCAUC 序列高度保守。不同于MRV,ARV 属于膜融合病毒,其S1基因表达的p17 蛋白为膜融合相关的小跨膜蛋白(fusionassociated small transmembrane,FAST),具有在细胞核和细胞质之间进行切割的功能[8]。MRV 和ARV 在病毒蛋白的命名上也存在差异,两种病毒蛋白的位置和命名对照见图1 及表1。正呼肠孤病毒首先通过表面的σ1 蛋白结合宿主细胞受体,经内吞作用进入胞内,在内吞小体内脱去外层衣壳,形成核心粒子并释放至细胞质;然后在细胞质内进行基因转录和蛋白翻译,并形成“病毒工厂”,最后在“病毒工厂”内进行病毒的组装和释放[9]。
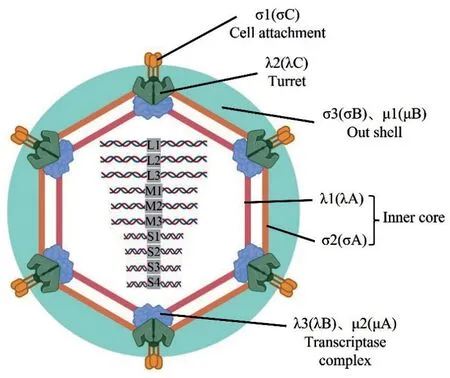
图1 正呼肠孤病毒结构模式(括号内为ARV 命名)

表1 ARV 和MRV 蛋白名称和编码基因对照
反向遗传是在获得病毒基因序列和复制机制的基础上,通过基因工程技术人工逆向合成病毒从而研究基因和蛋白的结构及功能的技术,也是进行病毒载体开发所必需的基础技术。呼肠孤病毒科病毒的反向遗传系统研究滞后于其他RNA 病毒。2007 年基于全质粒的MRV 反向遗传系统的建立是呼肠孤病毒科病毒反向遗传技术走向成熟的标志[10]。近年来,呼肠孤病毒科的其他病毒如轮状病毒、蓝舌病病毒、非洲马瘟病毒、ARV 等均相继建立起反向遗传系统[11-17]。本文以MRV 和ARV为例,对正呼肠孤病毒反向遗传系统和病毒载体的研究进展进行综述,以期为正呼肠孤病毒载体疫苗研发提供参考。
1 反向遗传系统研究进展
1.1 MRV 反向遗传系统
早 在1990 年,Roner 等[18]将MRV 的ss+RNA 和(或)dsRNA 与病毒ssRNA 翻译产物共同转染小鼠皮下结缔组织和脂肪成纤维细胞(L929),并在血清2 型MRV 辅助感染下,成功获得具有感染性的3 型MRV,为呼肠孤病毒的反向遗传学开辟了道路。Roner 等[19]还应用该系统,组装出表达外源CAT基因的重组MRV。由于该系统操作复杂,技术难度高,不具备普适性,至今为止未见其他实验室有过相关报道。2007 年,Kobayashi 等[10]建立了一种全质粒的反向遗传系统,以PCR 分别扩增病毒10 条基因片段并构建10 条表达质粒(每条质粒携带一条基因片段),为保证正确翻译,将每条基因片段的5'端与T7 启动子的翻译起始位点无缝连接,并在3'端增加丁肝核酶序列,将10 条质粒按一定比例转染经痘苗病毒处理的L929 细胞,分别成功拯救出血清1 型(T1L)和3 型(T3D)MRV。之后Kobayashi 等[20]改进了MRV 反向遗传系统,通过使用多表达盒质粒将反向遗传系统的质粒个数从10 减少至4,减少后分别为pT7-L1-M2T1L、pT7-L2-M3T1L、pT7-L3-S3T1L、pT7-S1-S2-S4-M1T1L,并使用表达T7 RNA 聚合酶(T7pol)的乳仓鼠肾细胞(baby hamster syrian kidney,BHK-21)提高病毒拯救效率,减少获得感染性克隆所需的时间,消除与使用重组痘苗病毒相关的生物安全问题。但此种策略构建多表达盒质粒难度较大,基因片段的不同组合也会影响拯救效率。为减少MRV 反向遗传系统对痘苗病毒和BHK-21/T7 细胞的依赖,Komoto等[21]利用表达T7pol 的质粒与上述10 质粒反向遗传系统共转染不同细胞,成功在L929、BHK21 和人类肺泡基底上皮细胞(A549)中拯救了病毒,提高了MRV 反向遗传系统的灵活性。2017 年,Eaton 等[15]构建了串联表达T7 RNA 聚合酶和非洲猪瘟病毒NP868R 加帽酶(C3P3)的质粒,与上述Kobayashi 等改进的4 质粒拯救系统共转染BHK-T7 细胞拯救病毒,与仅使用T7 RNA 聚合酶相比,添加非洲猪瘟病毒NP868R 加帽酶可使拯救病毒的产量提高100 倍。
1.2 ARV 反向遗传系统
ARV 反向遗传学研究起步比MRV 晚,因此参考了MRV 反向遗传系统。2017 年,吴巧梅[16]利用改造的pBluescript Ⅱ SK(+)载体,构建了表达鸭呼肠孤病毒基因组10 个节段的10 质粒拯救系统,然后将质粒与痘病毒裂解液共转染BHK-21细胞,刮取转染的细胞接种SPF 鸡胚并盲传3 代,成功从尿囊液中分离到病毒,首次建立起ARV 反向遗传系统。随后Wu 等[17]将转染细胞替换为稳定表达T7 聚合酶的金黄仓鼠肾细胞(BSR-T7/5),同样也拯救出感染性ARV。2021 年姚中慧[22]采用相同的策略,利用10 质粒系统拯救出ARV。这些进展均为ARV 反向遗传学的深入研究奠定了基础。总体而言,目前国内外关于ARV 反向遗传系统的相关研究较少,仍处于起步阶段,亟待研究人员对其进行优化和改进。
2 病毒载体研究进展
MRV 具有作为病毒载体的优点,如安全性高、容易培养、可以诱导黏膜免疫等。因此,研究人员积极尝试MRV 作为病毒载体的相关研究。最早已有MRV 作为病毒载体表达CAT和GFP基因的报道[10,19]。上述研究中,表达MRV σ3 结构蛋白的基因被替换,病毒失去复制功能。2012 年,Brochu 等[23]在MRV σ1 蛋白的羧基端添加了40个氨基酸长度的组氨酸标签和环氨酸标签短肽序列,首次拯救出具有感染性的重组MRV,研究发现S1基因内插入外源基因的长度有一定限制,插入750 bp 即无法拯救重组病毒。2015 年Van Den Wollenberg 等[24]用荧光蛋白iLOV 替换MRV σ1 蛋白羧基端非必需区的150 个氨基酸(253~402 aa),并使用P2A 自裂解多肽与σ1 蛋白连接,成功拯救出重组MRV,并将插入的外源序列长度提高至522bp。Eaton 等[15]以UnaG 荧光蛋白(140 aa)替换MRVσ1 蛋白羧基端,使用融合表达和单独表达2 种策略,均能拯救出具有感染性的重组MRV,但仍未突破插入外源基因长度的限制。2013 年Demidenko 等[25]利用另一种策略成功拯救出具有复制能力的MRV,首先分别将L1、M1、S3基因片段5'或3'端的关键末端区域复制(40~200 bp),然后在重复序列之间插入表达猴免疫缺陷病毒(SIV)gag基因的外源序列,并利用具有自切割活性的T2A 肽将外源多肽与病毒结构蛋白分割,不影响其折叠,拯救的MRV 重组病毒中最长插入了1 500 bp 的外源基因,此外重组病毒可以使小鼠产生针对gag 蛋白的特异性T 细胞免疫应答,证明了正呼肠孤病毒活载体疫苗的可行性。2019 年Kanai 等[26]采用与Demidenko 等相同的策略,将表达荧光素酶和P2A 自裂解肽的基因克隆到L1基因片段的5'端,拯救出含重组荧光素酶报告基因的MRV,感染小鼠后可检测到荧光素酶的表达时间长达2 个月。2022 年,Ogawa 等[27]采用同样策略将近红外荧光蛋白和T2A 肽基因分别连入L1、M1、S2基因的5'和3'端,对比后发现M1基因的3'端最适合此蛋白插入,并成功获得可复制的重组MRV。以上研究均证实正呼肠孤病毒具有一定表达外源基因的能力,未来可利用这一能力开发新型活载体疫苗、新型基因治疗方法或进行相关基础研究等。
正呼肠孤病毒作为病毒载体的研究历史较短,目前尚无载体疫苗研究成功。然而已有动物试验[28]证实MRV 可以有效感染小鼠肠道细胞,诱导产生强烈的黏膜免疫。此外,有研究[29]将MRV作为溶瘤病毒进行了大量临床试验,证实了其对动物的安全性。国内多种ARV 弱毒活疫苗已经获得新兽药注册[30],表明其作为兽用活疫苗的安全性和有效性也已被广泛认可。虽然目前没有MRV 和ARV 病毒载体商品化疫苗的报道,但其今后在活载体疫苗方面的广阔前景令人振奋。
3 结语
分子生物学、生物化学和遗传学的发展促进了研究人员对病毒的深入了解。特别是反向遗传学技术,利用人工基因组获得不同表型的重组病毒,使病毒蛋白功能和病毒复制分子机制研究以及病毒载体和新型疫苗开发成为可能。目前针对各种主要的RNA 病毒建立了反向遗传系统,包括脊髓灰质炎病毒[31]、狂犬病病毒[32]、丙型肝炎病毒[33]、流感病毒[34]和埃博拉病毒[35]。由于呼肠孤病毒基因组和病毒粒子结构非常复杂,直到2007 年第1 个完全基于质粒的MRV 反向遗传系统才被报道[10]。随后,呼肠孤病毒科其他病毒的反向遗传系统也相继建立[11~14,16]。T7pol 是一种噬菌体来源的单亚基酶,具有高效、高保真、转录不需要额外蛋白的特点,其对T7 启动子序列的识别具有高度特异性,转录起始位点固定[36];丁肝核酶是迄今为止发现的唯一一种在哺乳动物细胞中天然具有活性的核酸酶,具有5'末端自剪切功能[37],在病毒拯救过程中,T7pol 和丁肝核酶的参与能使RNA 正确转录和剪切,因此呼肠孤病毒反向遗传系统通常使用包含T7 启动子和丁肝核酶表达盒的质粒。病毒拯救通常使用成纤维细胞,高效表达T7pol 的BSR-T7/5细胞有助于简化工作流程和避免痘病毒带来的生物安全风险;在辅助质粒方面,表达T7pol 或C3P3融合蛋白的质粒可以简化病毒拯救流程并提高拯救效率[15]。此外表达FAST 蛋白的质粒也作为辅助质粒被使用,极少量的FAST 蛋白也可以提高病毒拯救效率和病毒产量[38-39]。正呼肠孤病毒反向遗传系统经过近20 年的研究,取得了重大进展,但其拯救效率仍有较大提升空间。因此开发更加高效、简便的反向遗传系统是今后的研究重点。
反向遗传系统是构建病毒载体疫苗的基础,利用反向遗传系统将编码抗原的基因片段插入病毒基因组,使其随病毒的复制而表达,重组病毒可作为基因工程二联活疫苗使用。目前常用的病毒载体有痘病毒[40]、疱疹病毒[41]、腺病毒[42]、副黏病毒[43]等等。最近,关于将正呼肠孤病毒作为病毒载体的研究越来越多,其中利用自身串联重复序列和2A自剪切多肽表达外源蛋白的策略备受关注[25-27],串联重复序列的目的是保留基因片段中的封装信号,使病毒基因片段能够正确组装成基因组[44-46],插入2A 序列的目的是将外源肽段剪切去除,且不影响病毒自身蛋白的结构和功能。利用这种策略表达的蛋白游离于细胞浆内,可以长时间表达[26]并诱导机体产生强烈的免疫应答[25]。虽然目前尚无正呼肠孤病毒载体疫苗报道,但其研究价值和商业化潜力较高,是今后的主要研究方向。
自40 年前首次报道乙肝表面抗原重组痘苗病毒[47]以来,研究人员已经开发出多种病毒载体疫苗来对抗多种传染病[48]。SARS-CoV-2 大流行时期,腺病毒载体疫苗、流感病毒载体疫苗在人群中被广泛接种。据统计[49],全世界有数十亿人接种了病毒活载体疫苗,这使人们对活载体疫苗的接受度大大提高。由于活载体疫苗良好的安全性和免疫原性,其在未来必将成为预防传染病的重要部分。正呼肠孤病毒作为病毒载体的潜力已经显现,期待将来它在预防和治疗人类和动物疾病方面的广泛研究和充分应用。

