积雪草酸联合亚胺培南对产KPC-2 耐药肠杆菌的体外抗菌作用
张 卫,伍国强,廖远军,许竞文,邹宜诺,周永林
(1.浏阳市农业农村局动物疫病预防控制中心,湖南浏阳 410300;2.零陵区畜牧水产事务中心,湖南永州 425199;3.吉林大学动物医学学院,人畜共患传染病重症诊治全国重点实验室,吉林长春 130062)
肠杆菌科细菌是严重威胁人类健康和畜禽养殖业的人兽共患条件致病菌,是各地医院重点监控的革兰氏阴性菌[1]。常见的肠杆菌科细菌包括大肠杆菌、肺炎克雷伯菌、沙门氏菌和产气肠杆菌等。肠杆菌科细菌感染后可引起不同细菌性疾病,严重时可导致菌血症甚至死亡。β-内酰胺类抗生素一直以来都是临床和养殖业中治疗和预防细菌感染的最主要抗生素之一,包括青霉素类、头孢菌素类和碳青霉烯类。其中碳青霉烯类是临床上治疗复杂耐药肠杆菌感染的最主要药物[2]。近年来,金属β-内酰胺酶(如New Delhi metallo-β-lactamases,NDMs)和碳青霉烯酶(如Klebsiellapneumoniaecarbapenemases,KPCs)的出现和广泛传播,导致临床上出现了耐碳青霉烯肠杆菌(carbapenem resistantEnterobacteriaceae,CRE)感染人和动物的情况。携带NDMs 或KPCs 的细菌耐药呈广谱性,NDMs 和KPCs 通常可与多种不同类型耐药酶共存于同一细菌造成多药耐药[3-5]。因此,解决由碳青霉烯酶介导的肠杆菌耐药性问题迫在眉睫。
碳青霉烯酶主要包括Ambler 分子分类的A类(如KPCs)、B 类(如NDMs)和D 类(如OXAs)[6]。目前发现KPCs 有超过31 个突变体,其中KPC-2 是世界范围内分布最广的丝氨酸碳青霉烯酶之一[7]。KPC-2 可导致肠杆菌对绝大多数β-内酰胺类抗生素耐药,呈现广谱性,因此产KPC-2 细菌对目前所有可用的β-内酰胺类抗生素及酶抑制剂复方抗生素都具有不同程度的耐药性。KPC-2 编码基因通常位于质粒上,可在不同肠杆菌科细菌之间快速水平转移和垂直传播,也可整合至携带其他耐药基因或毒力基因的质粒上,从而形成高致病性多重耐药菌[8]。携带KPC-2 的肠杆菌主要包括大肠杆菌和肺炎克雷伯菌。有研究[9]报道,从人类血液样本中分离出的多重耐药大肠杆菌,同时携带了3 种碳青霉烯酶,包括KPC-2、NDM-5和CTX-M-3/65。2017 年我国首次从病猪肺脏样品中分离出同时携带KPC-2 和FosA3 的肺炎克雷伯菌分离株ST11[10]。KPC-2 由两个亚结构域组成,包括两个疏水性网络结构(α-网络和β-网络)和β-内酰胺酶[11]。KPC-2 的晶体结构以及KPC-2 水解碳青霉烯类抗生素的活性中心等都已明确,这为筛选具有靶向性的KPC-2 抑制剂及其作用机制分析奠定了基础[12]。
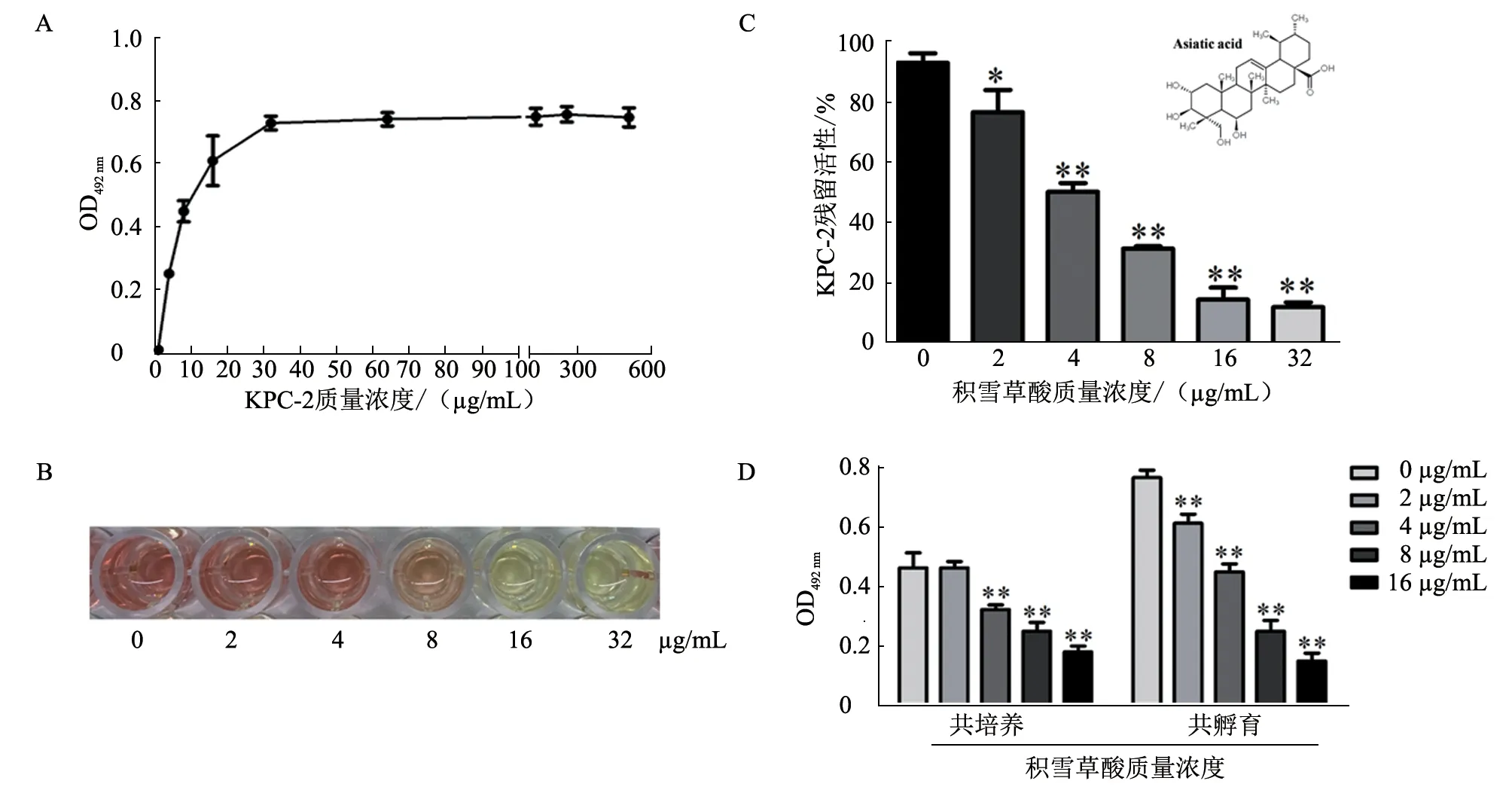
图1 积雪草酸抑制KPC-2 活性作用检测结果

图2 积雪草酸协同碳青霉烯类抗生素的抑菌作用检测结果
近年来,抗生素耐药性问题已经成为全世界所面临的严重威胁。基于绿色养殖和“One Health”理念,我国大力支持开发中药作为治疗和预防畜禽疾病的药物[13-14]。中药活性成分具有结构新颖、种类繁多和药理学活性多样等优势,是新药研发的重要宝库。目前国内已经有多个研究团队和机构开展中药活性成分抗耐药细菌感染研究,如吉林大学研究团队报道了和厚朴酚作为MCR-1 酶抑制剂,可增强多黏菌素对MCR-1 阳性菌的体内外抗菌活性[15]。因此从天然化合物中筛选KPC-2 的抑制剂,以恢复碳青霉烯类抗生素对肠杆菌的抗菌活性是当前最有效的策略之一。
目前临床上使用的碳青霉烯类抗生素主要有亚胺培南(imipenem)、美罗培南、帕尼培南、厄他培南、比阿培南和多尼培南。本试验以最早开发和用于临床的碳青霉烯类抗生素亚胺培南作为目标抗生素进行深入研究。中药活性成分积雪草酸(asiatica acid)是中草药积雪草中含量较高的五环三萜类化合物,具有抗抑郁、抗肿瘤、治疗阿尔茨海默症和保护心血管的药理学作用[16]。积雪草酸作为耐药酶抑制剂的研究报道较少,因此本团队开展了积雪草酸抑制KPC-2 活性作用研究,以期为解决耐碳青霉烯肠杆菌感染提供新的策略和有效抑制剂。
1 材料与方法
1.1 菌株、细胞与药品
KPC-2 工程菌E.coliBL21(DE3)(pET28a-KPC-2),由本实验室构建并验证;本研究涉及的KPC-2 阳性肺炎克雷伯菌临床分离株(包括K.peneumoniaeC1 和K.peneumoniaeC30),由吉林大学动物医学学院动物药学实验室提供。使用菌株时,取甘油菌在琼脂培养基上划线培养后挑取单菌落。所有甘油菌均保存于-80 ℃。
人肺癌上皮细胞A549、小鼠单核巨噬细胞J774 和宫颈癌细胞HeLa,保存于吉林大学动物药学实验室;小鼠腹腔巨噬细胞(mouse peritoneal macrophages),通过3%巯基乙酸盐肉汤诱导法提取自C57 小鼠腹腔。积雪草酸、硫酸多黏菌素E和头孢硝噻吩(CAS#41906-86-9),购自上海源叶生物技术有限公司;亚胺培南、美罗培南、庆大霉素、四环素和环丙沙星等抗生素,购自中国兽医药品监察所。积雪草酸溶解于DMSO 中配置成母液备用;各种抗生素根据其特性溶解于蒸馏水和甲醇中制备母液,现用现配。
1.2 头孢硝噻吩水解试验
构建KPC-2 原核表达工程菌株pET28a-KPC-2并纯化KPC-2 蛋白,随后进行活性检测[17]。将纯化的KPC-2 按照1:300 稀释后加至96 孔板中,加入不同质量浓度的积雪草酸(0、2、4、8、16、32 μg/mL)37 ℃共孵育30 min;各孔中加入底物头孢硝噻吩反应10~15 min,通过测定不同样品OD486nm值,确定积雪草酸抑制KPC-2 活性的情况,随后计算积雪草酸对KPC-2 的半数抑制浓度(IC50)。此外,将不同质量浓度的积雪草酸与pET28a-KPC-2 菌株共培养6 h,或将不同质量浓度的积雪草酸与pET28a-KPC-2 菌株培养物上清共孵育后,进行头孢硝噻吩水解试验。抑制率计算公式:抑制率=(1-测试组OD/对照组OD)×100%。使用Graphpad Prism 5 软件计算IC50。
1.3 最小抑菌浓度(MIC)检测及分级抑菌浓度(FIC)指数测定
将过夜培养的菌液(包括KPC-2 工程菌、肺炎克雷伯菌临床分离株K.pneumoniaeC30 和K.pneumoniaeC1)转接至无菌LB 培养基中继续扩大培养至对数生长期,然后将菌液分别调至吸光值OD600nm= 0.1,备用;在96 孔板中用米勒-海顿肉汤(MHB)培养基将积雪草酸和亚胺培南连续进行2 倍倍比稀释,使积雪草酸和亚胺培南的终质量浓度分别为0、21~27μg/mL 和0、2-3~27μg/mL;将受试菌按稀释比例1:200 加入各孔,使其终浓度为5×105CFUs/mL,然后置于37 ℃恒温培养箱中培养16~24 h。通过肉眼观察各孔培养基的浑浊程度进行结果判定,以肉眼观察未浑浊孔的最低浓度为MIC 值。本研究同时检测了不同抗生素与积雪草酸的协同作用,具体操作方法同上。
联合抑菌效果通过FIC 指数判定:FIC ≤0.5定义为协同作用,0.5 <FIC ≤1.0 定义为相加作用,1.0 <FIC ≤2.0 定义为无关作用,FIC >2.0 定义为拮抗作用。
1.4 生长曲线
挑取琼脂培养基上的单个菌落(包括KPC-2工程菌和肺炎克雷伯菌临床分离株K.pneumoniaeC30)于LB 液体培养基中过夜培养,然后将菌液分别调至吸光值OD600nm= 0.3;将菌液分装至5 个无菌锥形瓶中,加入不同质量浓度的积雪草酸(0、2、4、8、16 和32 μg/mL)后在37 ℃恒温摇床中振荡培养;每隔30 min 吸取各瓶中菌液1 mL 检测OD600nm值,对KPC-2 工程菌和肺炎克雷伯菌临床分离株K.pneumoniaeC30 分别连续检测7 h 和9 h,记录各时间点吸光值并绘制生长曲线。
1.5 时间-杀菌曲线
挑取琼脂培养基上的单个菌落(包括KPC-2工程菌和肺炎克雷伯菌临床分离株K.pneumoniaeC30)于LB 液体培养基中过夜培养,将菌液调至吸光值OD600nm= 0.1,备用;在96 孔板中使用MHB 培养基配置不同质量浓度药物,分别设置对照组、亚胺培南组(工程菌1 μg/mL、临床分离株2 μg/mL)、积雪草酸组(32 μg/mL)以及积雪草酸联合亚胺培南组(工程菌32 μg/mL +1 μg/mL、临床分离株32 μg/mL +2 μg/mL),每组1 列;每孔加入1 μL 备用菌液,使每孔细菌为5×105CFUs/mL;将96 孔板置于37 ℃恒温培养箱中连续培养,分别于培养后0、3、6、9、12 和24 h 吸取各组孔中菌液进行10 倍倍比稀释,再分别取20 μL 涂布于琼脂培养基过夜培养;统计各组不同时间点的菌落数并绘制时间-杀菌曲线。
1.6 活死细菌染色
挑取琼脂培养基上的单个菌落(KPC-2工程菌)于LB 液体培养基中过夜培养,将菌液调至吸光值OD600nm= 0.1;分别加入积雪草酸(32 μg/mL)、亚胺培南(1 μg/mL)以及积雪草酸联合亚胺培南(32 μg/mL +1 μg/mL),阴性对照不做任何处理;置于37 ℃恒温摇床培养6 h,离心收集细菌并调整为OD600nm= 0.5;使用LIVE/DEAD BacLight bacteria Viability 试剂盒对活/死细菌进行染色,避光反应30 min,使用荧光显微镜观察不同处理后细菌的存活情况[18]。
1.7 扫描电镜观察
挑取琼脂培养基上的单个菌落(KPC-2 工程菌)于LB 液体培养基中过夜培养,将菌液调至吸光值OD600nm= 0.1;分别设置积雪草酸组(32 μg/mL)、亚胺培南组(1 μg/mL)以及积雪草酸联合亚胺培南组(32 μg/mL +1 μg/mL),阴性对照组不做任何处理;37 ℃静置培养3 h,4 ℃离心收集菌体,经戊二醛固定、PBS 缓冲液洗涤、1%锇酸再次固定、PBS 缓冲液再次洗涤后,用乙醇进行梯度脱水;最后将制备的样品在扫描电镜下观察细菌的形态结构。
1.8 细菌细胞膜通透性测定
挑取琼脂培养基上的单个菌落(KPC-2 工程菌)于LB 液体培养基中过夜培养,将菌液调至吸光值OD600nm= 0.1;分别加入积雪草酸(32 μg/mL)和不同浓度的亚胺培南(0、1、2、4 μg/mL),阴性对照组不做任何处理;37 ℃静置培养3 h,离心收集菌体后加入PBS 重悬菌液,然后加入碘化丙啶(PI,终浓度为10 nmol/L)染料,避光孵育30 min;最后通过全波长酶标测定仪(激发波长535 nm、发射波长615 nm)检测不同处理样品的荧光强度,分析积雪草酸和亚胺培南对细菌细胞膜通透性的改变[19]。
1.9 细胞毒性检测
将人肺癌上皮细胞A549、小鼠单核巨噬细胞J774、宫颈癌细胞HeLa 和小鼠腹腔巨噬细胞分别铺于96 孔细胞培养板中,于5% CO2恒温培养箱中过夜培养;弃去细胞培养物上清,加入含不同质量浓度积雪草酸(0、1、2、4、8、16、32 μg/mL)的DMEM 培养基,继续培养6 h;离心取上清,应用乳酸脱氢酶(LDH)检测试剂盒检测不同处理后细胞培养物上清中LDH 含量,分析不同质量浓度积雪草酸处理后不同细胞的存活率。
2.0 统计学分析
本研究所有试验均重复≥3 次,所产生的试验数据使用非配对样本T检验进行分析。P<0.05,表示两组之间差异显著;P<0.01,表示两组之间差异极显著;P≥0.05,表示两组之间无显著性差异。所有图表使用Graphpad Prism 5软件制作。
2 结果与分析
2.1 积雪草酸显著抑制KPC-2 的水解酶活性
本研究成功表达了具有生物学活性的KPC-2。为确定筛选抑制剂的最佳反应质量浓度,首先进行KPC-2 质量浓度与其活性之间的关系分析,质量浓度-酶活性检测曲线见图1-A,确定KPC-2的最佳反应质量浓度为30 μg/mL。头孢硝噻吩水解试验发现,中药活性成分积雪草酸可显著抑制KPC-2 活性(图1-B、C,P<0.05)。积雪草酸对KPC-2 的IC50为4.38 μg/mL。本研究进一步检测了积雪草酸与pET28a-KPC-2 菌株共培养,或与培养物上清共孵育的抑制作用。结果(图1-D)显示,积雪草酸(≥4.0 μg/mL)无论在共孵育还是共培养条件下均可极显著抑制KPC-2 的活性(P<0.01)。
2.2 积雪草酸显著提高亚胺培南对KPC-2 阳性菌的抑制作用
为验证积雪草酸与亚胺培南的协同抑菌作用,采用棋盘法MIC 试验进行确证。通过与未携带blaKPC-2基因的大肠杆菌E.coliBL21(DE3)(pET28a)相比较,发现积雪草酸可增强亚胺培南对KPC-2 阳性大肠杆菌pET28a-KPC-2 的抑菌作用(图2-A)。这一协同作用进一步在KPC-2 阳性肺炎克雷伯菌临床分离株K.pneumoniaeC30(图2-B)和K.pneumoniaeC1(图2-C)上得到验证。此外,本研究发现积雪草酸与其他非β-内酰胺类抗生素的协同效果不及碳青霉烯类(图2-D),积雪草酸仅与庆大霉素的FIC 指数小于0.5,即具有协同作用,而与其他4 种非β-内酰胺类抗生素的FIC 指数均大于0.5,即没有协同作用。
2.3 积雪草酸显著提高亚胺培南对KPC-2 阳性菌的杀菌作用
本研究首先通过生长曲线试验确定了积雪草酸(≤32 μg/mL)对大肠杆菌pET28a-KPC-2 和肺炎克雷伯菌临床分离株K.pneumoniaeC30 的生长无显著影响(图3-A、B)。与空白对照组相比,积雪草酸或亚胺培南均不能在检测时间内杀灭培养基中的细菌,但当积雪草酸联合亚胺培南处理6 h 后可将培养基中的大肠杆菌pET28a-KPC-2 或肺炎克雷伯菌临床分离株K.pneumoniaeC30 完全杀灭(图3-C、D)。进一步通过活死细菌染色和扫描电镜观察对上述协同杀菌作用进行验证。结果(图4)显示:与空白对照、单独添加积雪草酸(32 μg/mL)或亚胺培南(1 μg/mL)相比,添加积雪草酸联合亚胺培南(32 μg/mL +1 μg/mL)后着色红色的细菌数量增多(图4-A),即死亡的细菌数量增多;积雪草酸联合亚胺培南可导致细菌发生形态变化,出现皱缩、聚集、破损甚至死亡(图4-B)。
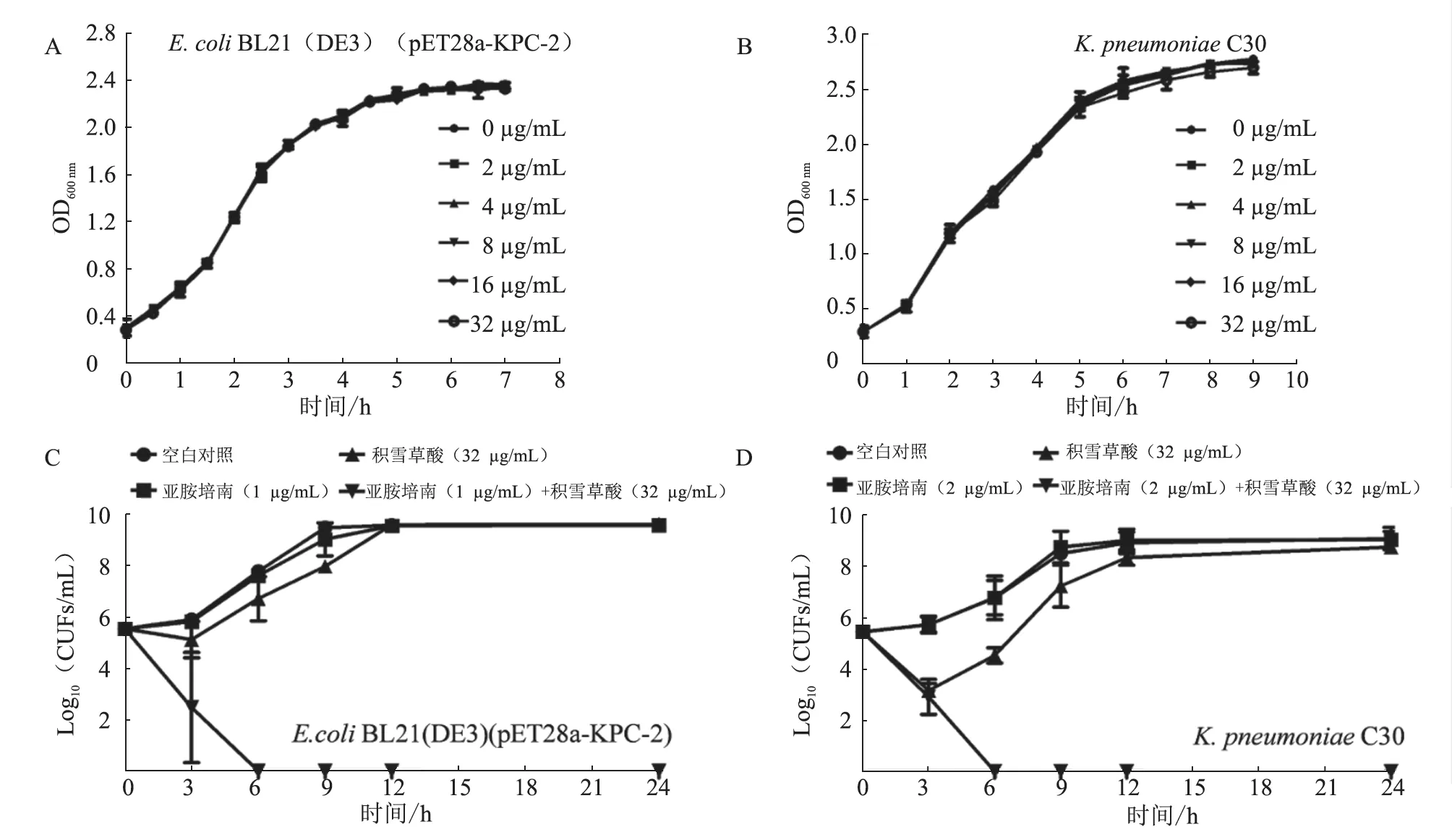
图3 生长曲线和时间-杀菌曲线检测结果

图4 阳性工程菌pET28a-KPC-2 的活死细菌染色及扫描镜检结果
2.4 积雪草酸增强亚胺培南对细菌细胞膜的损伤作用
细菌细胞膜的通透性可以反映细菌的受损程度。如图5 所示,随着亚胺培南质量浓度的增加(≥2 μg/mL),大肠杆菌pET28a-KPC-2 细胞膜的通透性极显著增加(P<0.01)。与上述体系相比,加入32 μg/mL 积雪草酸后,细菌细胞膜的通透性在亚胺培南质量浓度≥2 μg/mL 后极显著增加(P<0.01)。结果提示,积雪草酸可增强亚胺培南对细菌细胞膜的损伤作用,从而导致细菌死亡。
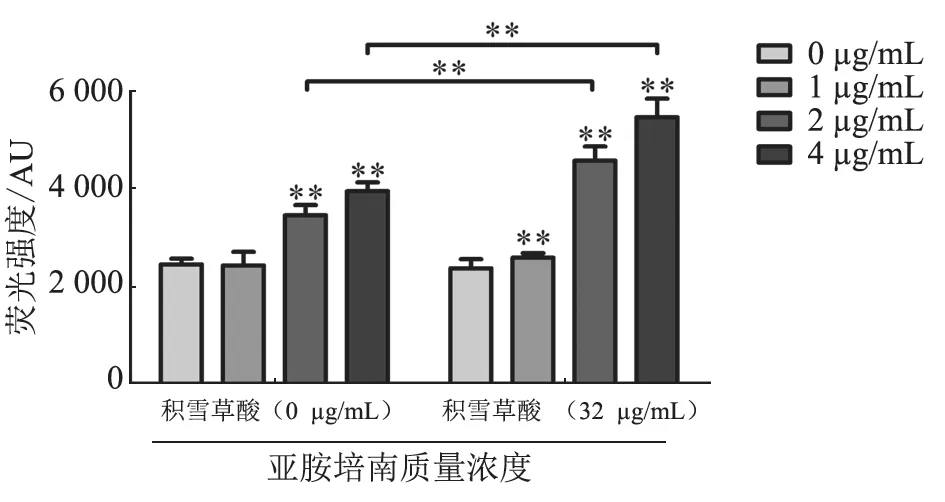
图5 积雪草酸协同亚胺培南对大肠杆菌pET28a-KPC-2细胞膜通透性的影响结果
2.5 积雪草酸对不同来源细胞的毒性检测
本研究初步分析了积雪草酸是否对4 种来源的细胞存在潜在的细胞毒性。结果(图6)显示,积雪草酸质量浓度≤32 μg/mL 时对A549 细胞、J774 细胞、HeLa 细胞和小鼠腹腔巨噬细胞的毒性作用较小,LDH 释放百分比均未超过20%。积雪草酸是否具有其他潜在的毒性作用需要进一步试验验证,包括急性毒性和亚慢性毒性等。
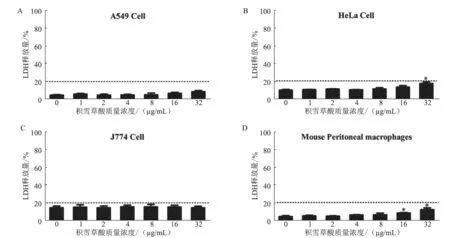
图6 积雪草酸对4 种来源细胞的LDH 检测结果
3 讨论
革兰氏阴性菌(尤其肠杆菌)主要通过产生各种耐药酶从而对不同抗生素产生耐药性,因此针对耐药酶开展抑制剂筛选及其机制研究是当前解决肠杆菌耐药性问题的重要策略之一[20]。国内外许多科研团队针对新型碳青霉烯酶开展了抑制剂筛选和机制研究,如发现曲霉明A(aspergillomarasmine A,AMA)可显著抑制碳青霉烯酶NDM-1 的活性,从而恢复美罗培南等碳青霉烯类抗生素的体内外抗菌作用,其有望在未来被开发为碳青霉烯类抗生素的佐剂以应对肠杆菌的临床感染问题[21]。我国临床分离的CRE 中碳青霉烯酶总体以KPCs 为主,其中KPC-2是分布最广的丝氨酸碳青霉烯酶之一。但KPC-2 抑制剂的报道相对较少,目前还没有可以投入临床使用的KPC-2 抑制剂[22]。因此,本研究从中药活性成分中筛选有效的KPC-2 抑制剂是一种可行的思路。
积雪草具有清热解毒、利湿通淋和散瘀消肿的功效,用药历史悠久,存在于多种中药处方中[23],其有效成分积雪草酸对革兰氏阳性菌具有不同程度的抑菌作用,而对革兰氏阴性菌抑菌作用差。因此将积雪草酸与亚胺培南联合使用,可有效防治临床上出现的复杂混合耐药菌感染[24-25]。革兰氏阴性菌携带的KCPs 家族成员同源性较高,主要由KPC-2 和KPC-3 突变而成,如KPC-14 是由KPC-2 缺失2 个氨基酸获得。因此,推测积雪草酸可能抑制大部分KCPs 的水解酶活性,但积雪草酸与碳青霉烯类抗生素在携带KCPs 家族其他成员的菌株上是否具有协同作用有待进一步验证。综上,本研究为开发中药活性成分抗耐药革兰氏阴性菌感染研究奠定了前期研究基础并提供了先导化合物。

