大气CO2浓度与温度升高对小麦表层土壤碳氮含量及酶活性的影响
杨 琦 邱 娜 李露洁 史鑫蕊,2 张东升,2宗毓铮,2,* 李 萍,2 郝兴宇,2
(1山西农业大学农学院,山西 太谷 030801;2黄土高原特色作物优质高效生产省部共建协同创新中心,山西 太谷 030801)
土壤碳库是陆地生态系统中最大的碳库,是植物根系、凋落物、微生物残体等输入土壤中的碳除去土壤呼吸后,剩下的稳定存储的碳[1]。全球表层土壤中碳储量在700×1015~2 946×1015g之间,占陆地生态系统碳储量的2/3,对陆地生态系统的组成、分布、结构和功能等产生深刻影响[2],对全球碳循环和气候变化起着关键作用[3]。
近年来,大气CO2浓度增加与气温升高已成为不争的事实,预测到21 世纪末CO2浓度将达到490~1 260 µmol·mol-1[4],平均地表气温将升高2~4 ℃[5]。CO2浓度升高会提高植物地上部和地下部生物量积累[6],增加凋落物和土壤底物的碳氮比(C/N),改变微生物活性和有机质的分解速度[7]。大气CO2浓度升高显著提高了催化碳水化合物分解的部分土壤酶活性,如纤维素酶、半纤维素酶、木质素酶等[8-9],但会降低土壤β-葡萄糖苷酶活性[10]。同时,有研究表明,在CO2浓度升高的条件下,土壤硝酸还原酶活性下降了14%~20%[11],NO-3-N 等电子受体的减少是主要原因之一[12]。升温导致土壤中真菌数量增加,而真菌是土壤木质素的主要分解者,这提高了土壤中木质素的氧化程度,降低了碳库的稳定性[13],且土壤细菌与真菌比值降低会导致β-葡萄糖苷酶和β-N-乙酰葡糖苷酶活性减弱[14]。在一定温度范围内,增温对参与土壤有机碳分解的胞外酶具有促进作用[15],如纤维素酶[16]和β-木糖苷酶[10]。作为氮循环关键酶之一的脲酶,其活性在春小麦根际土壤增温5 ℃条件下有所提高[17]。
在不同的土地利用方式和管理措施下,土壤碳库会成为大气碳库的源或库。因此,研发和利用高固碳、低排放的农业技术和模式是未来农业发展的重要目标之一[18]。免耕和少耕减少了土壤扰动,其结合秸秆还田可提高土壤有机碳库[19],有效控制土壤碳损失,减少农田CO2释放量,降低温室效应[20],提高土壤全氮含量[21]。
目前,大气CO2浓度和温度升高共同作用下的土壤碳库组成及其稳定性的变化特征仍存在争议。本研究立足于黄土高原持续29 年的旱地小麦保护性耕作定位试验,将免耕覆盖与旋耕秸秆还田下0~20 cm 土层土壤取回人工控制气候室进行小麦盆栽培养,分析土壤碳氮库组分含量及相关土壤酶活性,旨在阐明大气CO2浓度与温度升高对土壤碳氮组分的影响,以期为未来气候变化条件下土壤碳库稳定性的预测提供理论依据。
1 材料与方法
1.1 试验地概况
供试土壤为山西省临汾市尧都区保护性耕作长期定位试验区(111°30′N、36°04′E)0~20 cm 深度土壤。长期定位试验始于1992 年,由中国农业大学、澳大利亚昆士兰大学(University of Queensland)和山西省临汾市尧都区农机局开展。海拔450 m,年平均气温10.7 ℃,无霜期180 d。该地区主要以半干旱气候为主,年平均降雨量为555 mm,集中在7—9 月份,12—次年2月降水较少。土壤类型为碳酸盐褐土,有机质含量低(9.35 g·kg-1)、土壤pH值为7.24左右。
试验区种植制度为一年一熟,种植作物为冬小麦,每年9月20日左右种植,6月10日左右收获,收获后直到下一季播种之间处于休闲期。试验设置旋耕和免耕2个处理。旋耕处理在收获后留茬10~15 cm,将秸秆(粉碎长度为15~20 cm)撒于地表,10 d内进行翻地,深度大约为15~20 cm。播前整地后,使用常规播种机进行播种。免耕处理留茬10~15 cm,将小麦秸秆粉碎覆盖于地表(平均3.75 t·hm-2)。在休耕期不进行翻耕处理,使用除草剂和杀虫剂控制杂草和害虫的生长。在9月20日左右使用贴茬播种机(山西河东雄风农机有限公司,运城)进行小麦播种,到次年6月10日左右收获。各处理均采用硝酸磷肥复合肥(含N 25%、P2O512%)做底肥一次施入,施用量450 kg·hm-2,即施氮(N)量112.5 kg·hm-2,施磷(P2O5)量54 kg·hm-2。
于2020年9月30日将0~20 cm深度土壤挖深坑取回人工模拟气候室,尽可能保持原状,用于种植冬小麦。播种前0~20 cm 土层土壤碳氮含量及相关酶活性如表1所示。

表1 播种前0~20 cm土层土壤碳氮含量及相关酶活性Table 1 Soil carbon and nitrogen concent and relative enzyme activities in 0-20 cm layer before sowing
1.2 试验材料
供试小麦品种为郑麦9023(河南省农业科学院),于2020年10月11日播种。将小麦种子消毒催芽后,选取长势一致的种子,在直径12 cm,深20 cm 的塑料桶内进行穴播。
1.3 试验设计
本试验基地位于山西省晋中市太谷县山西农业大学农作站。该基地具有4 个独立的人工模拟气候室,气室结构为钢化结构,透光率为80%,单个气室面积为4 m×8 m,高为3.2 m。采用电脑自动控制系统(邯郸冀南新区盛炎电子科技有限公司)控制温度和CO2浓度。CO2浓度控制由控制系统感知气室内传感器中CO2的浓度,并将采集到的数据发送到主控计算机,由计算机控制各气室电磁阀的开闭,使每个气室的CO2浓度达到预定浓度来实现。气温控制由主控计算机根据室内外气温差控制空调使每个气室的气温达到预定气温来实现[22]。试验设置2个CO2浓度水平和2个温度处理,共4 个处理组合:CK(CO2浓度400 µmol∙mol-1,正常大气温度);eC(CO2浓度600 µmol∙mol-1,正常大气温度);eT(CO2浓度400 µmol∙mol-1,大气温度+2 ℃);eCeT(CO2浓度600 µmol∙mol-1,大气温度+2 ℃)。每个处理3次重复。由于越冬期本底气温较低,未进行增温处理。该时间段为:日最低温持续10 d 低于0 ℃开始至日最低温持续1 d 高于0 ℃为止,具体为2020 年12 月30 日—2021年2月26日(图1)。
种植小麦的塑料桶底部留有透水小孔,桶底铺有滤纸,防止根系从盆底钻出,播前浇透水。播种时施底肥,施肥量按112.5 kg N·hm-2,54 kg P2O5·hm-2折算,每桶种4穴,每穴1粒,每个处理设5盆重复,拔节期追施氮肥105.32 kg N·hm-2。在小麦全生育期内定期浇水,使土壤含水量维持在75%~85%,清除杂草。
1.4 测定项目与方法
1.4.1 土壤样品采集及小麦生物量测定 分别在小麦拔节期(3 月28 日)、开花期(增温处理为4 月28 日,无增温处理为5 月6 日)和成熟期(增温处理为6 月4 日,无增温处理为6 月13 日)进行土壤样品采集。每个处理分别随机选取3个重复,用土钻采集0~20 cm土层土壤,去除杂草和动植物残渣后迅速过10 目筛,随后分为两部分放入自封袋中带回实验室,一部分自然风干并过60 目筛用于测定土壤理化指标,另一部分于4 ℃以下保存用于测定土壤酶活性。
于成熟期将每个花盆中的小麦连土取出,采用流水冲根法获取整根植株后将小麦地上部与地下部分开,用信封封装标记后在烘箱中105 ℃杀青45 min 后70 ℃烘干至恒重,测定生物量。
1.4.2 土壤碳氮含量及组分的测定 土壤有机碳和全氮含量在山西农业大学资源环境学院土壤环境与养分资源山西省重点实验室采用重铬酸钾外加热法[23]和凯氏定氮法[24]测定。土壤易氧化有机碳、铵态氮和硝态氮含量在山西农业大学农学院作物生态与旱作栽培生理山西省重点实验室测定,其中,土壤易氧化有机碳含量采用高锰酸钾氧化-比色法[25]进行测定,土壤铵态氮和硝态氮含量分别采用KCl 浸提-靛酚蓝比色法和双波长紫外分光光度法[26]进行测定。
1.4.3 土壤酶活性的测定 土壤β-葡萄糖苷酶(βglucosidase,β-GC)和N-乙酰-β-D 葡萄糖苷酶(NAcetyl-β-D-glucosidase,NAG)活性采用硝基酚比色法测定,其活性以24 h内1 g干土生成对硝基苯酚的量表示;土壤脲酶(urease activity,UE)活性采用靛酚蓝比色法测定,其活性以24 h内1 g干土生成NH3-N的量表示[27];纤维二糖水解酶(cellobiohydrolase,CBH)和β-木糖苷酶(β-xylosidase,β-XYS)活性采用ELISA试剂盒(上海瑞番生物科技有限公司)双抗体夹心法测定。土壤酶活性均在山西农业大学农学院作物生态与旱作栽培生理山西省重点实验室测定。
1.4.4 土壤碳库特征计算方法 采用土壤碳库活度、碳库活度指数和碳库管理指数来反映不同处理下土壤碳库稳定性变化,以正常大气CO2浓度与温度条件(CK)下免耕与旋耕土壤为参考来计算相关指标。计算公式如下[28]:
式中,土壤碳库活度处理和土壤碳库活度对照分别为不同处理与对照条件下的土壤碳库活度。
式中,有机碳含量处理和有机碳含量对照分别为不同处理与对照条件下的土壤有机碳含量(g·kg-1)。
1.5 数据处理
采用Excel 2019 软件进行数据处理,采用SPSS 23.0软件进行统计分析。采用最小显著性差异法进行多个组间差异显著性比较(P<0.05),图表中所用数据均为平均值±标准误。
2 结果与分析
2.1 CO2浓度和温度升高对土壤有机碳和易氧化有机碳含量的影响
由图2可知,土壤有机碳(soil organic carbon,SOC)含量在三个生育时期均表现为免耕处理显著高于旋耕处理(P<0.05),两种耕作方式下,CO2浓度升高、增温及其叠加作用下的SOC含量均无显著差异(P>0.05)。与对照相比,温度和CO2浓度同时升高条件下两种土壤的易氧化有机碳(readily oxidized organic carbon,AOC)含量均显著降低(P<0.05;开花期免耕土壤除外);CO2浓度升高或温度升高单独处理均显著降低了免耕土壤拔节期和成熟期AOC 含量(P<0.05),降幅分别为33.1%、43.4%和10.9%、35.9%,对旋耕土壤则无明显影响。
2.2 CO2浓度和温度升高对土壤全氮、铵态氮和硝态氮含量的影响
由图3可知,与对照相比,CO2浓度升高或增温单因素处理整体提高了免耕土壤的全氮含量。其中,CO2浓度升高显著或极显著提高了免耕土壤开花期(P<0.05)和成熟期(P<0.01)的全氮含量;增温极显著增加了免耕土壤拔节期和开花期全氮含量(P<0.01);而二者叠加作用显著增加了开花期两种土壤的全氮含量(P<0.05)。
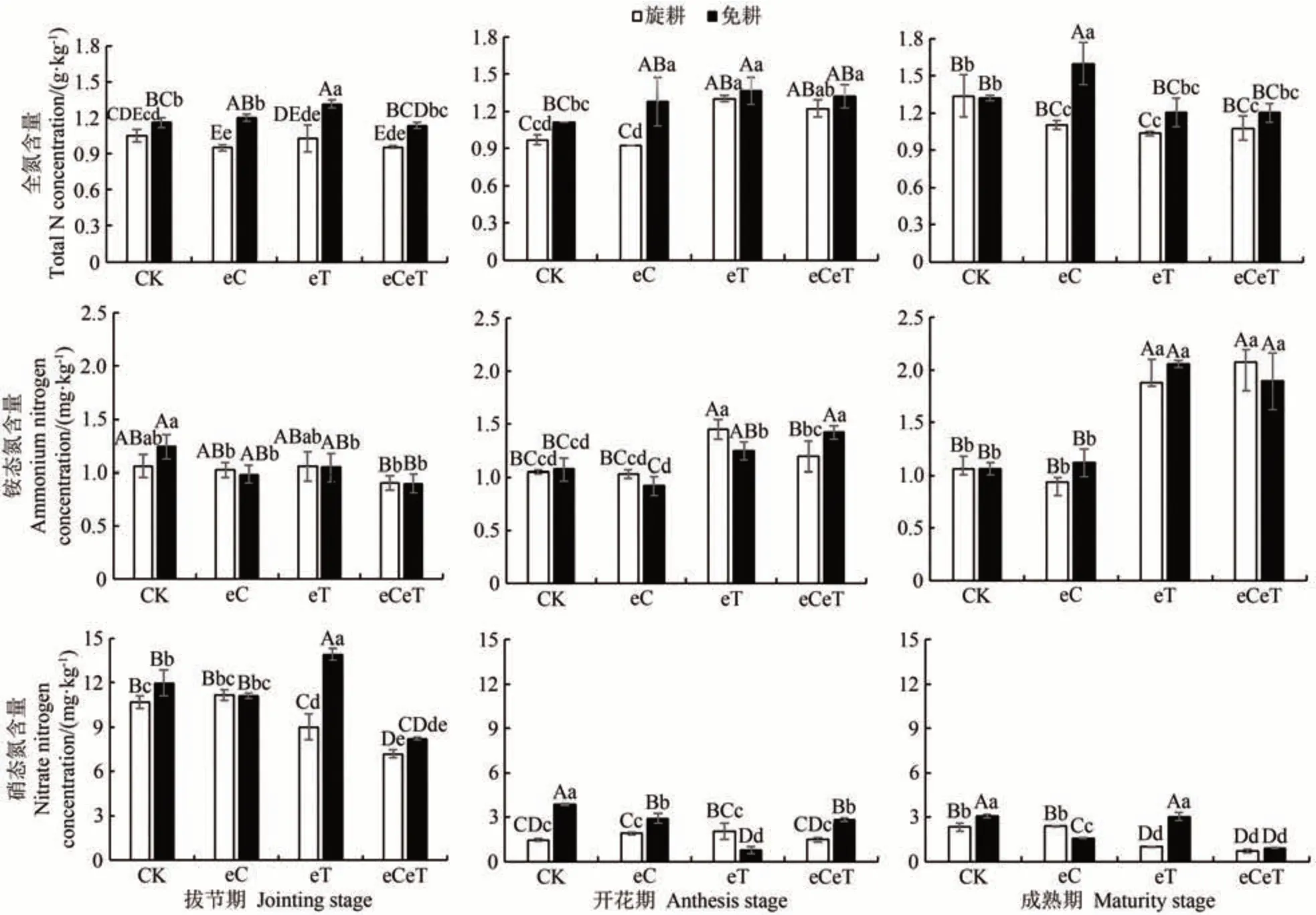
图3 CO2浓度和温度升高对不同耕作方式下土壤全氮及其组分含量的影响Fig.3 Effects of elevated CO2 concentration and temperature on soil total nitrogen concent and its component under different tillage practices
CO2浓度与温度对土壤铵态氮含量的影响不同。与对照相比,CO2浓度升高条件下,免耕土壤铵态氮含量在拔节期降低了20.6%;温度升高条件下,两种土壤的铵态氮含量平均值在开花期和成熟期显著增加(P<0.05),增幅分别为27.1%和85.2%;二者叠加作用下,两种土壤的铵态氮含量在成熟期极显著增加(P<0.01)。
与对照相比,CO2浓度升高显著降低了开花期和成熟期免耕土壤的硝态氮含量,降幅分别为24.9%和48.8%;温度升高极显著降低了拔节期和成熟期旋耕土壤硝态氮含量(P<0.01),降幅分别为16.0%和56.3%;二者叠加作用下土壤硝态氮含量明显降低(开花期旋耕土壤除外)。增温条件下,免耕土壤硝态氮含量在拔节期和成熟期极显著高于旋耕土壤(P<0.01)。
2.3 CO2浓度和温度升高对碳氮循环相关酶活性的影响
由图4可知,与对照相比,CO2浓度升高和增温均在不同程度降低了土壤β-葡萄糖苷酶(β-glucosidase,β-GC)活性。其中,CO2浓度升高极显著降低了开花期免耕和成熟期旋耕土壤的β-GC 活性(P<0.01),温度升高及二因素叠加作用极显著降低了两种土壤成熟期的β-GC活性(P<0.01)。温度升高及其与CO2浓度升高的叠加作用较对照极显著降低了免耕土壤开花期的纤维二糖水解酶活性(P<0.01)。CO2浓度升高极显著增加了拔节期两种土壤的β-木糖苷酶(β-xylosidase,β-XYS)活性(P<0.01),CO2浓度和温度升高的叠加作用显著增加了拔节期和成熟期免耕土壤β-XYS活性(P<0.05)增幅分别为18.2%和24.0%。
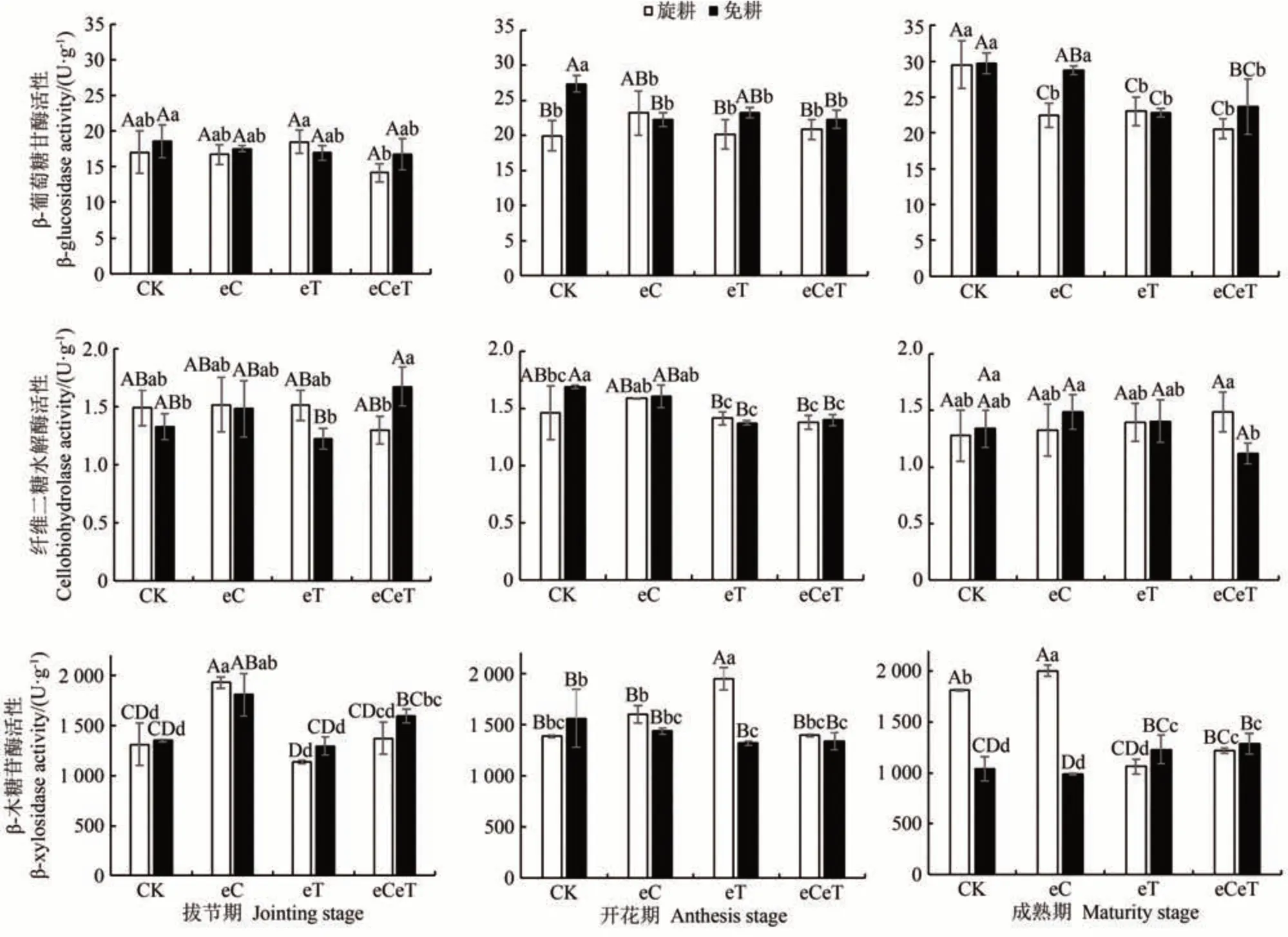
图4 CO2浓度和温度升高对不同耕作方式下土壤β-葡萄糖苷酶、纤维二糖水解酶和β-木糖苷酶活性活性的影响Fig.4 Effects of elevated CO2 concentration and temperature on β-glucosidase,Cellobiohydrolase and β-xylosidase activities under different tillage practices
由图5可知,CO2浓度升高较对照极显著降低了开花期和成熟期免耕土壤N-乙酰-β-D-葡萄糖苷酶(NAcetyl-β-D-glucosidase,NAG)活性(P<0.01),CO2浓度与温度升高二因素叠加作用极显著降低了成熟期两种耕作方式下土壤的NAG活性(P<0.01),温度升高对NAG 活性整体无明显影响。与对照相比,CO2浓度升高下,两种土壤的脲酶活性在开花期极显著降低(P<0.01),在成熟期显著增加(P<0.05);温度与CO2浓度升高叠加作用下,两种土壤的脲酶活性在开花期显著降低(P<0.05)。不同处理、不同时期下免耕土壤的脲酶活性均高于旋耕。

图5 CO2浓度和温度升高对不同耕作方式下土壤N-乙酰-β-D-葡萄糖苷酶和脲酶活性的影响Fig.5 Effects of elevated CO2 concentration and temperature on N-Acetyl-β-D-glucosidase and urease activities under different tillage practices
2.4 CO2浓度和温度升高对土壤碳库稳定性的影响
由表2可知,与对照相比,CO2浓度升高显著降低了免耕土壤在拔节期和成熟期的碳库活度和碳库管理指数;温度升高整体显著降低了两种土壤在小麦成熟期的碳库活度和碳库管理指数;CO2浓度和温度升高的叠加作用整体显著降低了旋耕土壤3 个关键生育时期的碳库活度和碳库管理指数,对开花期免耕土壤则无显著影响(P>0.05)。
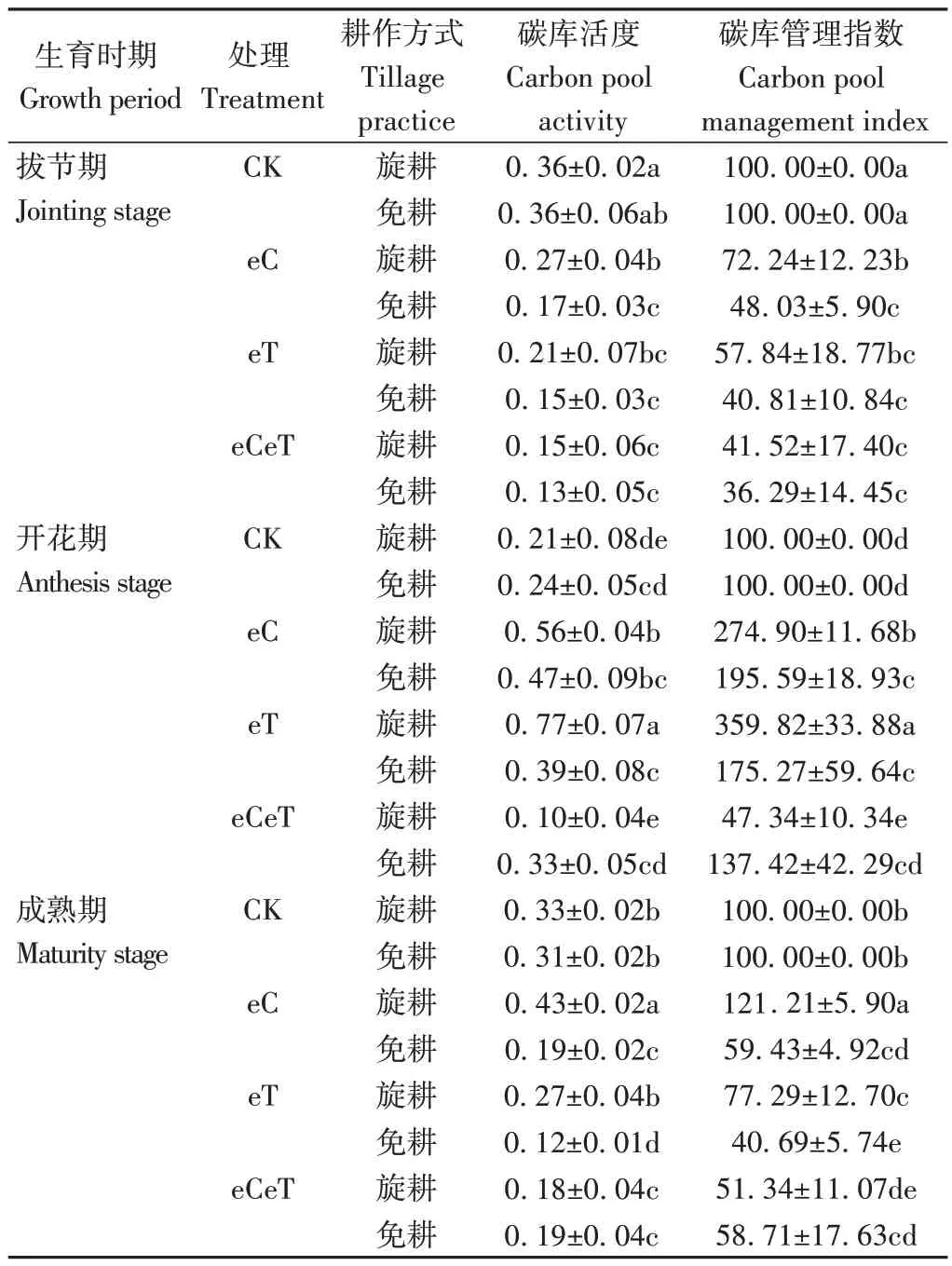
表2 CO2浓度和温度升高对不同耕作方式下土壤碳库活度与碳库管理指数的影响Table 2 Effects of elevated CO2 concentration and temperature on soil carbon pool activity and soil carbon pool management index under different tillage practices
2.5 CO2浓度和温度升高对小麦生物量积累的影响
由图6可知,在对照处理下,免耕土壤小麦地上部生物量和根系生物量显著高于旋耕处理(P<0.05)。CO2或温度单独升高条件下,两种耕作方式下小麦地上部生物量和根系生物量均较对照有所提升,但两种耕作方式之间均无显著差异(P>0.05)。在CO2浓度与温度升高的叠加作用下,两种耕作措施下小麦地上部生物量较对照明显降低,且旋耕降低幅度(24.7%)大于免耕(13.9%);根系生物量则较对照显著增加(P<0.05),旋耕增加幅度(52.5%)大于免耕(27.6%)。

图6 CO2浓度和温度升高对不同耕作方式下单株小麦生物量的影响Fig.6 Effects of elevated CO2 concentration and temperature on single wheat plants biomass under different tillage methods
2.6 CO2浓度和温度升高对小麦碳氮库组成和相关酶活性的相对作用
由图7可知,CO2浓度与温度升高叠加作用对不同时期土壤碳氮库相关酶活性均值的相对作用基本一致,即降低了两种土壤β-葡萄糖苷酶、β-木糖苷酶(免耕除外)、N-乙酰-β-D-葡萄糖苷酶和脲酶活性。CO2浓度升高单独处理增加了两种土壤纤维二糖水解酶活性。但不同环境条件对土壤碳氮库组成的影响不一。CO2浓度升高降低了免耕土壤的易氧化有机碳和硝态氮含量,对旋耕土壤则无显著影响(P>0.05)。温度升高对土壤易氧化有机碳含量的影响与CO2浓度升高下的趋势相同,并显著降低了两种土壤的硝态氮含量。CO2浓度和温度升高叠加作用均显著降低了两种土壤的易氧化有机碳和硝态氮含量。三种环境条件均增加了土壤全氮含量(增温下的旋耕土壤除外)。
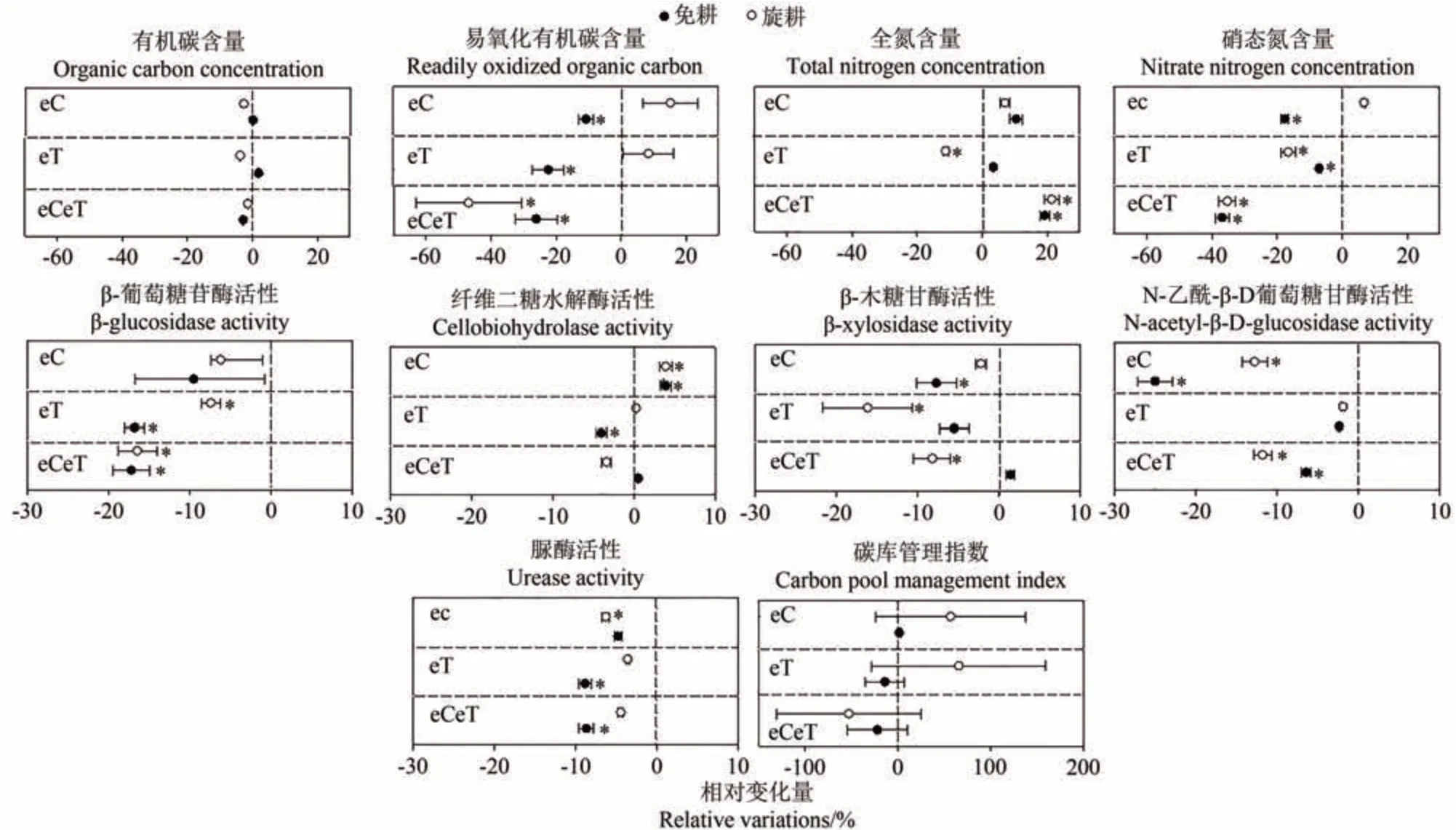
图7 CO2浓度和温度升高对不同耕作方式下土壤碳氮库组成及相关酶活性的相对作用Fig.7 The relative effects of elevated CO2 and temperature on soil carbon and nitrogen concentration and corresponding key enzyme activities
3 讨论
3.1 温度或CO2浓度升高对免耕易氧化有机碳和硝态氮含量的影响
土壤有机碳含量始终处在外源碳的输入和本底有机碳分解的动态变化中[29]。前人对森林[30]、草地[31]等生态系统的研究表明,温度升高影响土壤微生物的活性和土壤酶的活化能,造成有机碳[32-33]与固持氮[34-35]的分解。本研究中,在小麦生长季持续增温2 ℃后,免耕土壤的易氧化有机碳含量显著低于正常温度(P<0.01)(图2),且除成熟期β-木糖苷酶活性外,3 个关键生育时期免耕土壤β-葡萄糖苷酶、β-木糖苷酶和纤维二糖水解酶活性均受到抑制(图4)。这些水解酶活性的降低可能抑制土壤中纤维素、半纤维素、木质素等碳物质的降解[36],导致增温下免耕土壤易氧化有机碳含量低于正常温度。石丽红等[37]在水稻秸秆还田系统研究中也证明了土壤水解酶(β-葡萄糖苷酶、β-木糖苷酶、纤维二糖水解酶)活性与土壤有机碳含量及其活性有机碳组分含量间的正相关关系。
前人研究表明,CO2浓度升高可能增加根系分泌物和微生物活性,增加本底有机碳矿化,对农田土壤固碳能力产生限制[38-39]。本研究中,在CO2浓度升高条件下,免耕土壤易氧化有机碳与硝态氮含量有所降低,同时,纤维二糖水解酶活性升高,N-乙酰-β-D-葡萄糖苷酶与脲酶活性降低(图7)。同时,CO2浓度升高下小麦地上部与地下部的生物量未升高,前人研究也表明CO2升高抑制了小麦对土壤中硝态氮的吸收与同化[40],因此,基本可排除由植株吸收量增加导致土壤硝态氮含量减少的可能。
另外,旋耕土壤的易氧化有机碳含量和水解酶(β-葡萄糖苷酶、β-木糖苷酶、纤维二糖水解酶)活性在温度或CO2浓度升高单因素作用下较对照整体无明显变化(图7)。这可能与旋耕下表层土壤结构松散、通透性高、微生物群落组成不同,以及土壤有机质活性组分的矿化、氧化及养分转化在正常CO2浓度与温度条件下已相对充分[41]等因素有关。
3.2 温度与CO2浓度的叠加作用对土壤易氧化有机碳含量的降低作用
在大气CO2浓度和温度升高共同作用下,微生物群落的代谢活动对本底有机质的矿化能力可能增强[42]。本研究中,两种土壤的易氧化有机碳含量在CO2浓度和温度的叠加作用下较对照平均下降了34.2%,下降幅度大于单因素作用。这说明,在未来气候变化环境中,CO2浓度和温度的叠加作用可能将较单因子对土壤有机碳造成更大的损失。同时,叠加作用下易氧化有机碳含量在小麦拔节期已明显降低,至成熟期降低幅度未进一步加剧,而N-乙酰-β-D-葡萄糖苷酶、β-葡萄糖苷酶以及β-木糖苷酶(免耕除外)活性在拔节期较高但在成熟期被明显抑制,推测小麦生长后期易氧化有机碳分解受到微生物对温度和CO2浓度持续升高的适应[43-44]等因素影响。另外,叠加作用降低了土壤硝态氮含量,虽然增加了铵态氮含量(图3),但植物可吸收利用的无机氮含量仍然较低,小麦地上部生物量明显减少(图6),削弱了单独增温对免耕下土壤硝态氮和小麦生物量积累的提升作用。
在对照处理下,免耕较旋耕更有利于小麦地上部与地下部生物量积累,进而增加了植物残体对土壤有机碳的潜在输入量(图6)。大气CO2浓度或温度升高环境中,旋耕下小麦地上部与地下部生物量均增加至与免耕无显著差异(P>0.05),弥补了植物残体输入量的差距。但在CO2浓度与温度升高叠加处理中,两种耕作措施下小麦地下部生物量虽较对照显著增加,但地上部生物量明显降低,且旋耕降低幅度大于免耕。说明在CO2浓度与温度升高共同作用下,旋耕模式较免耕有减少地上部秸秆碳输入量的可能。Zhu 等[45-46]对水稻土的研究表明,CO2浓度和温度升高叠加作用下来源于植被根系的土壤有机质含有大量的木质素组分,碳矿化率较低,而来源于秸秆的碳矿化率较高。综上,在未来长期气候变化条件下,CO2浓度与温度升高的叠加作用可能通过改变秸秆碳的输入量等影响土壤有机碳的组成与矿化过程。
4 结论
小麦生长季持续增温2 ℃或CO2浓度升高条件下,免耕土壤的易氧化有机碳与硝态氮含量较对照明显降低,旋耕土壤的易氧化有机碳含量无明显变化,硝态氮含量在增温下降低。在CO2浓度与温度升高的叠加作用下,两种土壤N-乙酰-β-D-葡萄糖苷酶、β-葡萄糖苷酶和脲酶活性被抑制,易氧化有机碳与硝态氮含量降低且降低幅度大于单因素处理,土壤碳库活度降低;同时,小麦地下部生物量增加,地上部生物量降低。综上,在未来气候变化环境中,CO2浓度和温度升高的叠加作用可能将较单因子对土壤有机碳产生更大的影响。

