接种TYLCV弱毒株对番茄植株对灰霉病和白粉病耐受性的影响
韦建明 黄 鑫 肖 遥 方思丽 任志国 张大龙 李云洲,*
(1贵州大学农学院植物病理教研室,贵州 贵阳 550025;2河北农业大学植物保护学院,河北 保定 071001;3山东农业大学园艺科学与工程学院,山东 泰安 271018)
番茄(Solanum lycopersicumL.)是经济价值高且受欢迎的果菜之一,2021 年全球番茄鲜重产量超过1.89亿吨。然而,真菌病害和病毒病害一直是制约番茄安全生产的重要因素,尤其是真菌病害最为严重。根据营养类型,植物病原菌分为腐生真菌、共生真菌、寄生真菌[1],在这些类型中,寄生真菌被认为是一种重要的病原体,其生存依赖于从宿主细胞中吸收营养物质。真菌侵染早期逃避植物的防御系统[2],生物营养真菌分泌水解酶和植物以对抗植物防御,增加寄主存活率[3]。因此,寄生真菌在适应环境的过程中经历半寄生和腐生真菌的趋同和趋异演化,导致寄主抗病性减弱[4]。番茄灰霉病(Botrytis cinerea)和白粉病(Oidiumneolycopersici)是一类危害严重的真菌性病害[5]。病原菌利用芽管和附着胞穿透宿主细胞壁,通过释放角质蛋白酶和脂肪酶等溶解酶,以穿透角质层,破坏表皮层,并在寄主表面上形成侵染爆发点。此外,两种病原菌还分泌内生聚半乳糖醛酸酶、果胶甲基酯酶、纤维素酶和半纤维素酶等细胞壁降解酶,用于分解植物细胞壁,以帮助菌丝汲取其中的营养,并抑制宿主的抵抗,同时不破坏质膜[6]。
番茄黄曲叶病毒(Tomato yellow leaf curl virus,TYLCV)和番茄斑萎病毒(Tomato spotted wilt virus,TSWV)是两种对番茄植株造成重大危害的毁灭性病害[7]。TYLCV 是一种由烟粉虱(Bemisia tabaci)传播的病毒,受感染的番茄植株表现出叶片发黄和卷曲、发育迟缓、产量下降和果实质量降低等症状,在严重的情况下,植物可能死亡[8];TSWV 是一种由西花蓟马(Frankliniella occidentalis)传播的病毒,受感染的番茄植株表现出叶片变黄和古铜色、坏死,果实减小和变形等症状;在严重的情况下,植株死亡,甚至绝收[9]。
植物一旦被真菌感染,防控将非常困难。目前,选用抗病品种或利用化学药剂抑制真菌生长是两种有效的方法,但前者耗时长,后者会污染环境[10-11]。利用交叉保护抗病是一种环保、有效的方法,将健康植株预先接种弱毒株系,当接种植株遇见相同病毒侵染时,发病减轻甚至表现为无症状现象[12]。自1929年首次发现交叉保护现象以来,该方法已在多种农作物中广泛应用[13]。Taki 等[14]将3 种番茄斑萎病毒属病毒:
TSWV、Impatiens necrotic spot virus (INSV),Iris yellow spot virus (IYSV)中的沉默抑制子或外壳蛋白编码基因N片段插入苹果潜伏球形病毒(Apple latent spherical virus,ALSV)载体预接种植株中,3 种番茄斑萎病毒属病毒再次侵染寄主植株时相应病毒的增殖受到抑制。Sade 等[15]发现烟草花叶病毒弱毒株TMV-43A 可以交叉保护本氏烟草植株免受TMV 的侵害。Dai 等[16]在侵染本氏烟(Nicotiana benthamiana)接种藿香黄脉病毒(Ageratum yellow vein virus,AYVV)弱毒株时发现,植株叶片卷曲症状降低,抗病性提高。目前,尽管交叉保护在田间管理植物病害方面得到了广泛应用,但对于弱毒株是否能够通过交叉保护诱导植株对真菌病害的耐受性的研究仍鲜见报道。
为了明确弱毒交叉保护作用是否可以应用于真菌性病害,本研究以TYLCV 弱毒株系、TSWV 正常致病力病毒为毒源,番茄灰霉病菌(B. cinerea)和番茄白粉病菌(O. neolycopersici)为真菌性病原,番茄亚心82 和半野生番茄GZ-R 为植物材料,验证弱TYLCV 毒株系对真菌性病害的防御效果,探究接种病毒能否诱导植株增强对真菌病害的耐受性,以期为利用病毒交叉保护增强真菌的耐受性提供参考与借鉴。
1 材料与方法
1.1 植物材料与生长环境
亚心82为番茄多代自交系和GZ-R 为贵州本土半野生番茄,均由贵州大学农学院植物病理教研室番茄抗病抗逆研究课题组提供[17-18]。番茄种子经过温汤浸种后在QHS-Z4Z 人工气候箱(福建九圃生物科技有限公司)(24 h 黑暗,温度28±2 ℃)进行催芽,3 d 后露白,播种于育苗托盘(大小:5.0 cm×5.0 cm×10 cm),放置在人工气候室进行培养,生长温度为25±2 ℃,光/暗条件为16 h/8 h,待幼苗生长至2月龄时进行试验。
1.2 组织培养和病毒接种
从2 月龄番茄幼苗收集幼嫩茎尖组织,用次氯酸钠(1.5%有效氯)表面消毒5 min,并用无菌蒸馏水(ddH2O)冲洗数次。微茎尖脱毒处理3 代后,进行检测,获得脱毒株系各18株,放置室温培养2个月。将植株从1/2 Murashige and Skoog medium(MS)培养基中移至1.0 L花盆(3.5 cm×5 cm×6 cm)中。花盆中营养土经过高压灭菌冷却后使用。将移栽后的苗子置于温室进行培养3周后,进行病毒接种;TSWV 和TYLCV 分别以嫁接方式进行接种,含有TSWV、TYLCV 的亚心82 和GZ-R作为接穗(TSWV 毒源采集自贵州息烽农投辣椒生产基地,TYLCV 侵染性克隆来自中国农业科学院植物保护研究所周雪平教授实验室,由李常保老师馈赠,本课题组前期发现TYLCV 接种后致病性与野生型TYLCV 相比相对较弱[19]),无TSWV、TYLCV 的亚心82和GZ-R 作为砧木,将接种病毒植株放置黑暗条件下培养24 h,而后转移至室温(28±2 ℃)条件下培养2周,将成功接种病毒植株转移至贵州大学农学院温室进行培养。每次试验进行6株,3次重复。
1.3 灰霉病和白粉病的试验布局和接种
两次独立试验分别于2021年9月和2022年3月在贵州大学农学院温室进行。病原真菌灰霉病灰葡萄孢(B. cinerea)和白粉病新番茄粉孢(O. neolycopersici)来自贵州大学农学院植物病理教研室,无处理和不同基因型番茄植株以及无病毒植株作为空白对照,采取随机区组设计的4 个重复。成功接种病毒的番茄植株在温室条件下生长1 个月后,转移至贵州大学农学院西瓜苗圃实验基地温室大棚进行定植,生长1 周后,用人工喷雾法接种病原真菌。分别将灰霉葡萄菌孢子悬浮液调整至4.5× 105CFU·mL-1[20],白粉病孢子悬浮液调至3.5×104CFU·mL-1,采用人工喷雾法进行接种病原菌,即在目标处理的幼苗上方进行喷雾湿润处理。将所有被人工接种灰霉病或白粉病的植株放置在两个独立的人工气候室,温度25 ℃,相对湿度为85%~90%。接种1 周后,统计发病率(disease incidence)和病情指数(disease severity),具体参考陈哲等[21]的方法。此外,在接种前(T0)和第二次接种结束时(Tf),采集番茄叶片调查测定病毒含量。发病率和病情指数计算公式如下:
发病率=(发病叶片总数/调查总叶片数)×100%;
病情指数=[∑(各级病叶数×各级代表值)/(调查总叶数×最高级代表值)]×100。
1.4 病毒检测
对TYLCV 和TSWV 的外壳蛋白基因进行鉴定:其序列通过国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库(https://www.ncbi.nlm.nih.gov)下载,包括TYLCV-CP、TSWV-N基因序列。使用Primer Premier 6 软件进行PCR 引物设计(表1)。TYLCV 接种株使用Ezup 柱式超级植物基因组DNA 提取试剂盒(B518262,上海生工生物工程有限公司)提取DNA,TSWV 接种株使用RNA 提取试剂盒(R401-01,南京诺维赞生物科技有限公司)提取RNA,用Trizol 法从接种病毒和健康植株(未接种病毒的亚心82 和GZ-R)的番茄叶中提取总RNA。总DNA经过RNA 酶去除RNA 后作为检测TYLCV 的模板,而总RNA 经过DNA 酶去除DNA 后,再经HiScript ΙΙ 1st Strand cDNA Synthesis Kit 反转录试剂盒(R211-01,南京诺维赞生物科技有限公司)合成cDNA,以DNA 或cDNA 作为模板,并将健康植株作为对照,分别进行定量PCR 扩增。反应体系共20 µL:cDNA 模板2 µL,2×SYBR Green qPCR Mix 10 µL,正反引物各0.4 µL,dd H2O 7.2 µL。PCR 反应程序:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30 个循环;72 ℃延伸 5 min。产物经1.0%琼脂糖凝胶电泳检测后,将含有目的条带的PCR 产物,经凝胶回分别收,送往擎科生物有限公司(西安)进行测序。

表1 RT-PCR和qRT-PCR引物序列Table 1 Table of RT-PCR and qRT-PCR primer sequence
1.5 RNA 提取和实时荧光定量(quantitative realtime PCR, qRT-PCR)检测
对番茄中与抗病防御反应最重要的5 个分子途径基因进行分析(表1)。在2022 年的第2 次真菌接种试验结束时,为了评估病毒感染和真菌接种番茄植株病毒和真菌介导的系统反应,收集接种前和第二次接种后的番茄叶片,共72 个样品(2 番茄品种×3 病毒条件×2 真菌病原体×2 集合×3 生物学重复)。随机选取每个处理3 个番茄植株幼嫩叶片组织,约0.5 g 叶片放入1.5 mL 离心管中,迅速放入液氮速冻,储存在-80 ℃条件下备用。在CFX96TMReal-time System 荧光定量PCR 仪(美国Bio-Rad 公司)进行qRT-PCR 反应。使用SlActin作为内参基因,对不同基因型番茄植株的基因表达水平进行归一化处理。检测到的所有基因特异性引物如表1 所示。qRT-PCR 体系同1.4,程序的设计条件如下:95 ℃预变性2 min;94 ℃变性30 s,60 ℃退火15 s,72 ℃延伸15 s,40个循环。每个样品中每个基因的循环阈值(cycle threshold valve,CT)通过Slactin标准化并根据公式2-ΔΔCT计算[22]。
1.6 统计分析
利用Excel 2019 进行数据整理、SPSS 24.0 软件进行数据分析,GraphPad Prism 8进行作图。数据表示平均值±标准误差。差异显著性采用Duncan’s 新复极差法进行比较(P<0.05)。
2 结果与分析
2.1 植物材料和病毒鉴定
从外植体再生的每个番茄组织在体外繁殖,获得无毒苗亚心82-CTR 和GZ-R-CTR,经PCR 验证,并无TSWV和TYLCV病毒特异性条带(图1-A、B)。将部分无毒苗进行嫁接接种TYLCV 或TSWV,通过RT-PCR诊断证实成功接种病毒,获得带毒苗82-TYLCV、82-TSWV、GZ-R-TYLCV和GZ-R-TSWV(图1-C、D)。
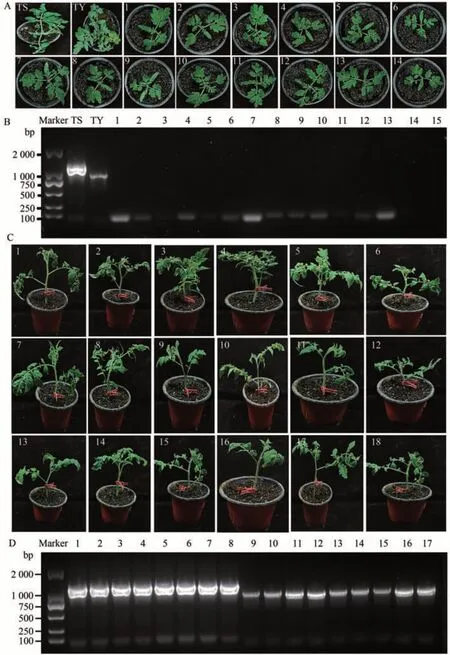
图1 病毒鉴定Fig.1 Virus identification
2.2 灰霉病和白粉病的侵染
在接种灰霉病和白粉病前,接种TYLCV 和TSWV叶片变小、皱缩和卷曲(图2-A)。在接种灰霉病后,-TYLCV/TSWV 植株和CK 植株均出现褐色病斑,而GZ-R 植株相比82 植株表现出较强的耐受性;在接种感染TYLCV和TSWV植株上,82和GZ-R均出现病斑,但感染TYLCV 的GZ-R 植株病斑面积较小或无病斑(图2-B)。接种白粉病后,发病状况类似灰霉病;在CK 和-TYLCV/TSWV 植株感染白粉病时,并未观察到明显差异,然而,在感染TYLCV 和TSWV 植株时,82 植株相比于GZ-R 植株表现出较强的敏感性,对白粉病的耐受性较差(图2-C)。由上述结果可知,接种弱毒株TYLCV 能够诱导半野生番茄GZ-R,使其具备对抗灰霉病和白粉病的抗性潜力。
评估不同病毒接种番茄植株对灰霉病和白粉病病原菌的发病指数和发病率的影响,结果如图3 所示。在第一次接种病原真菌后,发现TYLCV 弱毒株系接种GZ-R 植株后,其对灰霉病的发病率(14.29%)和发病指数(0.36)显著低于CK 植株(46.82%、6.27)和-TYLCV/TSWV(60.57%、8.87);在亚心82番茄植株上,TYLCV 弱毒株系接种引起的灰霉病发病率(36.31%)和发病指数(3.38)与-TYLCV/TSWV(67.01%、13.11)存在显著差异,而与CK 植株(59.94%、9.17)差异不显著;然而,CK 植株与-TYLCV/TSWV 植株相比,在发病率与病情指数并无显著性差异(图3-A、B);在系接82和GZ-R 植株含有TYLCV 弱毒株中接种白粉病,发现接种白粉病的发病率和病情指数与接种灰霉病的病害程度一致,并且在第二次接种时也呈现相同结果(图3-C、D)。
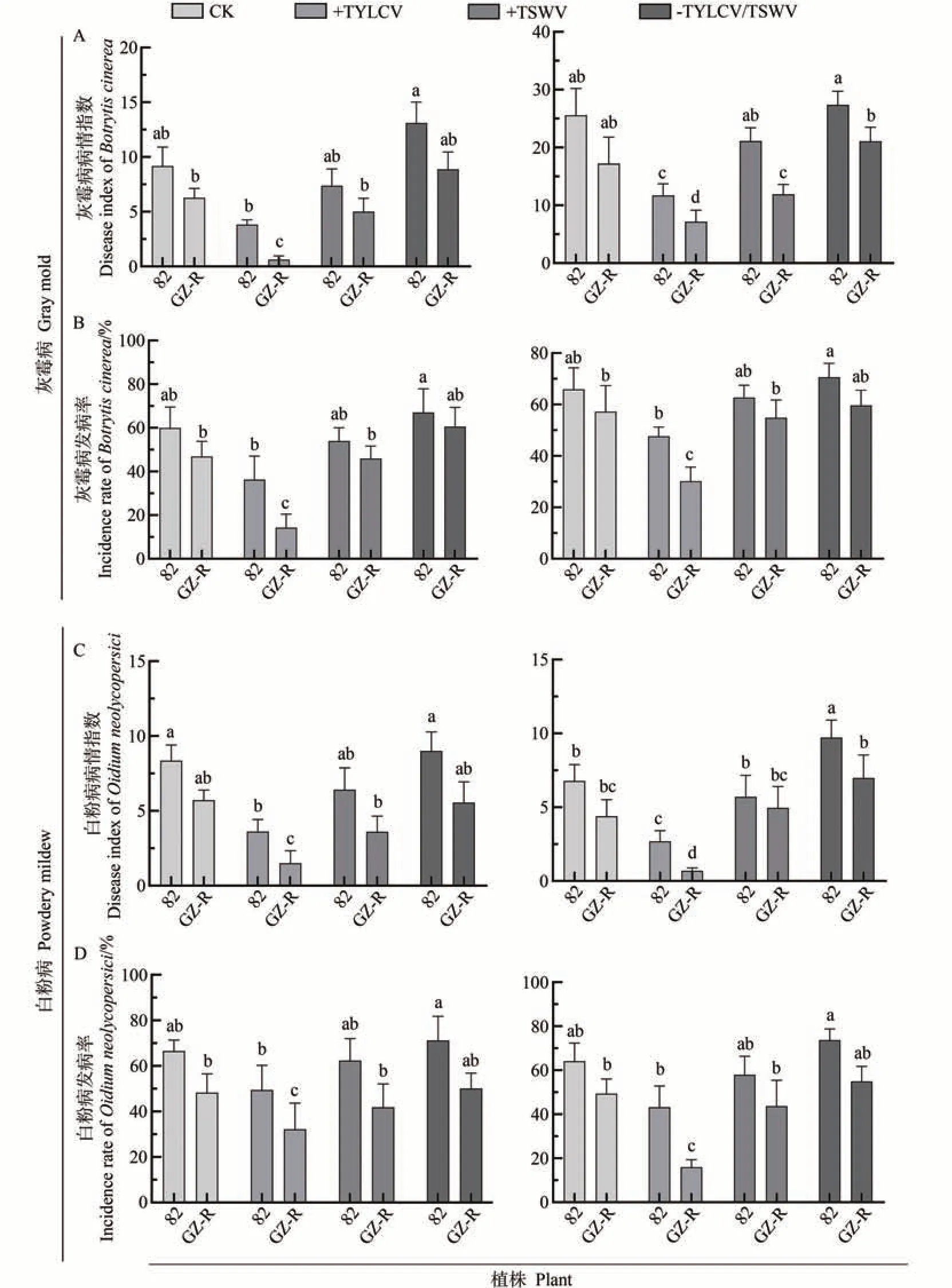
图3 接种TYLCV、TSWV诱导植株增强对灰霉病和白粉病耐受性Fig 3 The plant was inoculated with TYLCV and TSWV to enhance tolerance to ash gray mold and powdery mildew
在第一次接种病原真菌试验中,对82 和GZ-R 番茄植株接种正常致病力的TSWV 后,植株对灰霉病的发病率和发病指数[82(53.39%、7.38)、GZ-R(45.94%、5.01)]以及对白粉病的发病率和发病指数[82(62.38%、8.34)、GZ-R(41.86%、3.43)]之间无显著差异。在接种灰霉病和白粉病植株中,接种TSWV的植株相比于CK和-TYLCV/TSWV 植株无显著性差异,除了-TYLCV/TSWV 处理的82 番茄植株[灰霉病(67.01%、13.11)、白粉病(71.23%、9.02)];第二次接种试验中,与第一次接种试验相似,接种82 和GZ-R 番茄植株对灰霉病和白粉病的发病率、发病指数之间无显著差异(图3-A~D)。在CK 和-TYLCV/TSWV 植株中,灰霉病和白粉病的发病率、发病指数在两次接种试验中均无显著差异。综合上述结果表明,正常致病力的TSWV无法诱导寄主抗性。
2.3 病毒含量
在第二次试验中,通过qRT-PCR 测定真菌接种前后叶片组织的病毒相对含量。结果表明,无论是灰霉病还是白粉病的接种,82植株中TYLCV 相对含量无显著差异,而GZ-R 植株中TYLCV 相对含量在接种后显著降低(图4-A、B)。然而,无论是82 植株还是GZ-R植株,TSWV的相对含量在接种前后均显著上升(图4-C、D)。表明不同的番茄植株材料,TYLCV、TSWV对两种真菌的作用结果存在差异。

图4 qRT-PCR分析TSWV、TYLCV在灰霉病、白粉病接种前后的相对表达量Fig. 4 Relative expression analysis of TSWV and TYLCV before and after inoculation with B. cinerea and O. neolycopersici by qRT-PCR
2.4 病毒与病原真菌响应防御基因表达
SlSTS是与植物防御反应密切相关的一类苯丙烷代谢基因,本研究检测了在灰霉病和白粉病在接种前(T0)和接种后(Tf)的不同处理植株中SlSTS基因的相对表达。结果显示,在大多数处理植株中,无论是在灰霉病还是白粉病接种后期(Tf),SlSTS基因的表达量均显著增加。然而,在82-TYLCV 植株系中,灰霉病接种后期和GZ-R-CTR 植株系中的白粉病接种后期的SlSTS基因表达量均无显著差异(图5-A、B)。SlCHS在植物防御反应扮演重要角色,通过检测SlCHS基因的相对表达,结果显示,在灰霉病接种后期,各处理植株中SlCHS基因显著增加(图5-C)。在白粉病接种后,82-CTR、82-TSWV、82-TYLCV 和GZR-TYLCV 植株中SlCHS基因表达显著减少,而在GZR-CTR 植株中表达显著增加。在82-TYLCV 和GZR-TSWV 植株中,接种前后的SlCHS基因表达无显著差异(图5-D)。
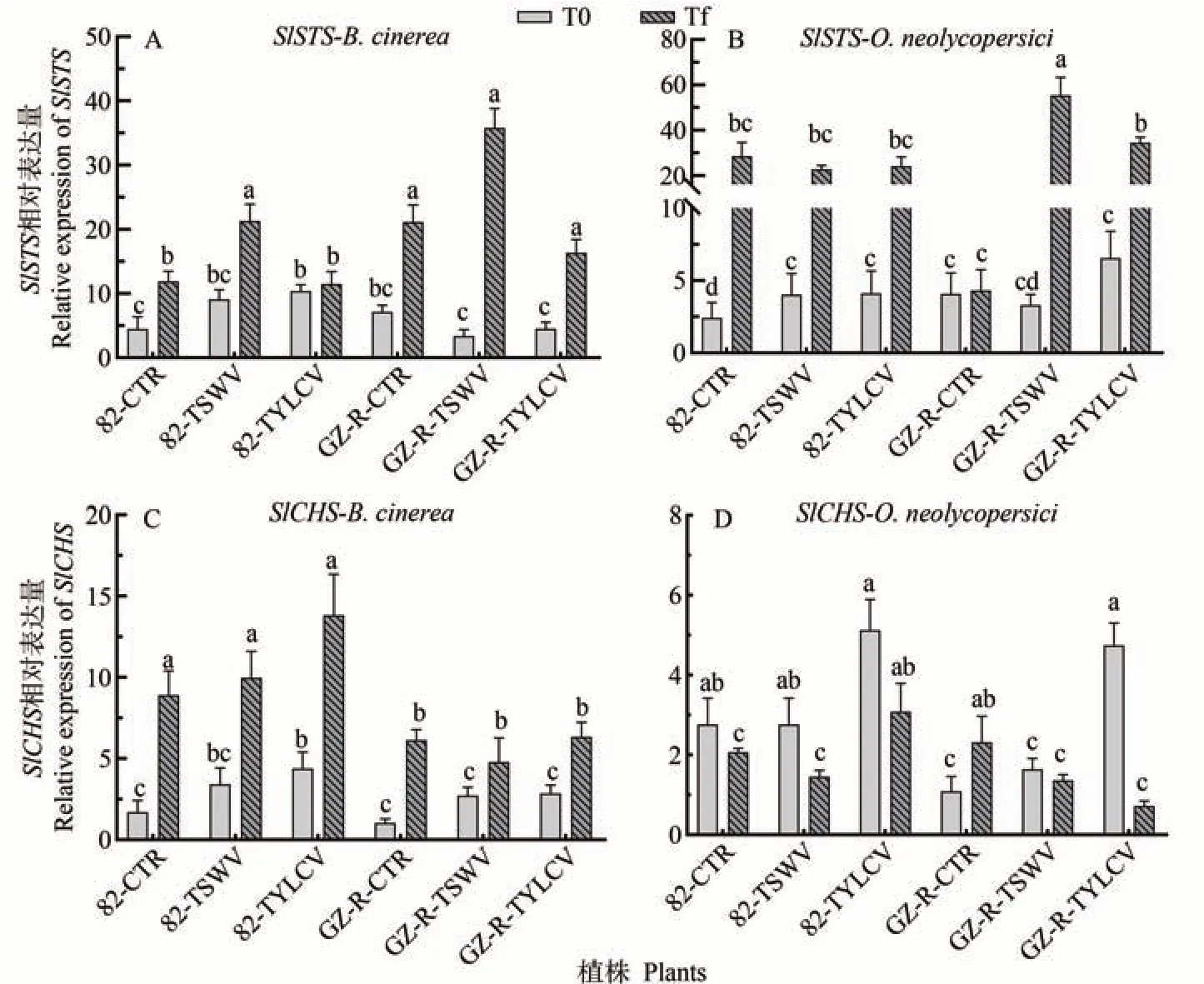
图5 病毒交叉保护诱导SlSTS和SlCHS基因相对表达量Fig.5 Relative expression levels of SlSTS and SlCHS genes induced by virus cross protection
SlPR1和SlβGluc是参与多种生物因素响应的防御相关基因。在接种灰霉病和白粉病后,SlPR1和SlβGluc的表达趋势在不同植株中相似。具体而言,82-TYLCV 植株在接种灰霉病和白粉病前表达显著高于未接种病毒的对照植株82-CTR,而82-TSWV 植株在接种灰霉病和白粉病后表达显著低于对照植株(图6-A、B、E、F)。在GZ-R 材料中,接种灰霉病和白粉病后,SlPR1的表达无显著变化,而SlβGluc基因在接种白粉病后表达显著增加(图6-A、B、E、F)。对于白粉病抗性基因SlMOL,在82 植株(82-TYLCV、82-TSWV、82-CTR)和GZ-R 植株中无显著差异,但在植株GZR-CTR、GZ-R-TSWV 和GZ-R-TYLCV 中均显著增加(图6-E、F)。
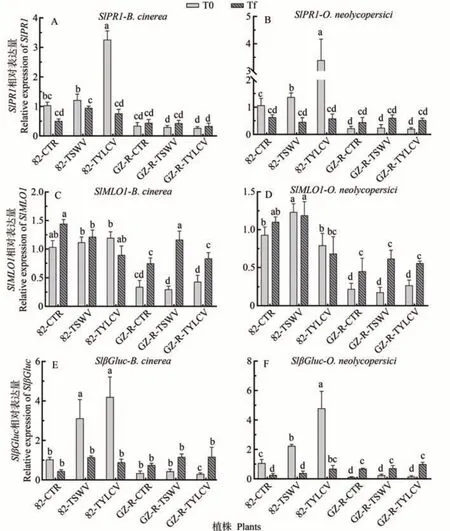
图6 病毒交叉保护诱导SlPR1,SlβGluc和 SlMLO1基因相对表达量Fig.6 Relative expression of SlPR1,SlGluc and SlMLO1 genes induced by virus cross protection
3 讨论
交叉保护策略是一种提高寄主抗病性有效的方法。本研究通过接种TYLCV 弱毒株和致病力较强的TSWV,发现TYLCV 弱毒株能够诱导82 和GZ-R 番茄植株对真菌性病害(灰霉病和白粉病)的耐性(图2),与Repetto 等[23]观察到的接种GLRaV-3 后葡萄对霜霉病(Plasmopara viticola)具有耐受性的结果相似。Gilardi等[24]在自然田间条件下,以Chardonnay 和Nebbiolo两种葡萄品种为对象,采用嫁接方法引入葡萄扇叶病毒(Grapevine fanleaf virus,GFLV)以及葡萄茎痘伴随病毒(Grapevine rupestris stem pitting-associated virus,GRSPaV),并进一步探究其与霜霉病和白粉病的相互关系,结果显示,预先接种GFLV 的葡萄植株不易被其他病原菌的侵染,表明病毒接种可以诱导植株对其他真菌性病害的抗病性。然而本研究中接种TSWV并没有增强寄主的抗病能力,反而加快了病害的扩展蔓延。
一种病毒株系的接种可以引起该植株对另外一种病毒的抗性,这种现象称作交叉保护作用[25]。为了明确TYLCV 弱毒株系预接种诱导寄主抗性分子机制,本研究结合转录组数据进行分析,结果显示,在TYLCV弱毒株预接种后,检测到GZ-R 植株中SlPR1和SlβGluc相对表达量显著高于对照植株(图4)。SlPR1属于水杨酸(salicylic acid,SA)信号通路标记基因,其高表达暗示SA信号参与该病毒引发的交叉保护作用,从而提高植株对灰霉病和白粉病的抗性。而本研究发现,TYLCV 弱毒株系接种番茄植株可以引起植株对灰霉病和白粉病的抗性,由此推测病毒抗性与真菌性抗可能具有联系。另外,β-1,3 葡聚糖酶(β-1,3 glucanase,β-Gluc)在植物寄主抗病中发挥重要作用[26]。田兆丰等[27]研究发现,SlβGluc在番茄抗TYLCV中发挥重要作用,这与本研究中接种TYLCV后诱导SlβGluc基因高表达的结果一致;张丽丽等[28]发现在苹果上过表达β-Gluc基因可以提高苹果对斑点落叶病真菌性病害的抗性。因此,TYLCV 弱毒株系接种能够激活寄主对真菌性病害的抗性,推测是通过诱导SlPR1和SlβGluc的高表达实现的。
病毒接种可以激活植株的RNAi抗病毒机制[29-30]。本研究观察到TYLCV 预接种的番茄植株在灰霉病和白粉病的发病率和病情指数与接种TSWV 相比显著降低,推测其抗性可能源于TYLCV 接种引发的RNAi 沉默机制增强,从而对真菌产生了交叉保护效应。然而,在这两个基因型番茄植株中,TSWV 预接种并没有引起灰霉病和白粉病的显著变化。两个基因型番茄植株的发病率和发病指数大多数介于无病毒对照组和感染TYLCV 的植株之间。进一步研究发现,TSWV 预接种反而加速了灰霉病的侵染。综上,推测具有强致病力的病毒株系可能无法诱导寄主产生交叉保护现象。
植物能够通过多种抗病机制调节免疫系统以限制病原菌的扩散[31-32]。弱毒株系接种可以诱导植株形成“致敏细胞”,使其在病原再次入侵时产生更早、更快和更强的防御反应,即诱导抗性[33]。植物的诱导抗病性可以分为两类:系统获得性抗性(systemic acquired resistance,SAR)和诱导系统性抗性(induced systemic resistance,ISR)。SAR主要依赖SA,而ISR主要涉及茉莉酸(jasmonic acid,JA)和乙烯(ethylene,ET)[34-35]。本研究发现,在番茄接种弱毒株系后,可以诱导植株SlPR1和SlBgluc基因的高表达。SlPR1和SlβGluc基因在番茄植株的抗病过程中发挥重要作用[36],因此,推测弱毒株系交叉保护可能是通过SAR-SlPR1/SlBgluc机制实现的。此外,本试验所用番茄材料82 和GZ-R的抗病性存在差异,可能受到材料自身遗传背景差异的影响,因此在未来的研究中可以进一步探究材料遗传背景差异对交叉保护作用的影响。
4 结论
预接种TYLCV 弱毒株能够提高番茄植株对B. cinerea和O. neolycopersici的抗性,而正常致病力的TSWV预接种未能提高番茄植株对两种真菌性病害的抗性,反而降低了番茄植株对两种真菌性病害的抗性。此外,TYLCV 弱毒株系诱导的交叉保护作用可能通过调控SlPR1和SlβGluc基因的表达实现。弱毒株系诱导的交叉保护现象既与病毒的致病力有关,也与植物材料的基因型有关。

