莲类胡萝卜素裂解双加氧酶4(NnCCD4)基因家族鉴定与功能分析
王志文 杨宁宁 张 晨 秦莉莉 曹泷云 李海锋 董 臣
(河南工业大学生物工程学院,河南 郑州 450001)
莲(Nelumbo nucifera)是我国重要的水生经济作物,也是多年生草本莲属植物,具有广泛的用途和价值[1]。莲花以其独特香气深受人们喜爱,其花色有白色、黄色和红色等,且与莲类胡萝卜素的积累有关[2]。类胡萝卜素(carotenoid)是自然界中分布最广的一类色素,迄今已发现近750 种类胡萝卜素[3]。类胡萝卜素是必要的光合色素和光保护剂,也是植物激素和植物香气的前体物质[4]。
类胡萝卜素裂解双加氧酶(carotenoid cleavage dioxygenase,CCDs)是一类高度异构的多烯链氧化酶家族,在非血红铁Fe2+协助下,结合4个组氨酸发生催化反应[5]。在植物中,CCDs家族根据催化底物是否环氧化分为两个亚家族:类胡萝卜素裂解双加氧酶和9-顺式-环氧类胡萝卜素双加氧酶(nine-cis-epoxycarotenoid dioxygenase,NCED)。植物CCD 亚基因家族成员有5个,分别为CCD1、CCD2、CCD4、CCD7和CCD8;NCED亚家族成员有5 个,分别为NCED1、NCED3、NCED5、NCED6和NCED9。两个基因家族之间的同源性和酶活性较低,底物专一性也存在差异[6-7]。
CCDs作为一种关键酶参与植物激素的生成,并在植物(叶、花、果实)颜色和香味形成中发挥重要作用[8]。CCD1 和CCD4 通过裂解作用,形成易于挥发的脱辅基类胡萝卜素,产生香气物质;CCD7 和CCD8 裂解产物是独角金内酯形成的关键前体物质;NCEDs 是脱落酸(abscisic acid,ABA)形成的关键酶[9-10]。在植物体内同时存在多个CCD 家族基因,在不同的植物组织中发挥着各自的功能,共同调节植物类胡萝卜素代谢[11]。
CCDs通过裂解不同底物和位点产生不同产物,从而发挥着独特的生物学功能。目前研究发现,植物体内CCD1 和CCD4 能够裂解多种类胡萝卜素,产生不同的香气物质,包括β-紫罗酮和香叶基丙酮等[12-13]。CCD1 定位于植物细胞质,CCD4 位于植物质体内[14]。考虑到质体是植物类胡萝卜素合成的主要场所,本研究对莲NnCCD4基因进行生物信息学分析,对NnCCD4基因表达模式进行研究,明确其酶促催化产生的香气物质,以期为莲属植物的花香改良提供有效基因,为莲种质资源开发提供依据。
1 材料与方法
1.1 材料与试剂
选取子莲金色年华、金陵火都和太空莲36 作为研究对象,种植于河南工业大学。收集太空莲36 的莲子、幼叶和成熟叶,以及金色年华(黄色)、金陵火都(红色)和太空莲36(白色)的花瓣。取样完成后,立即在液氮中冷却,后放置在-80 ℃冰箱中备用。每个材料均取3个生物学重复[15]。
细菌颜色试验所用载体pAC-β 和pMAL-c5x均由河南工业大学生物工程学院董臣课题组保存。大肠杆菌菌株DH5α和BL21(DE3)感受态细胞购自生工生物工程(上海)股份有限公司。质粒提取试剂盒、异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)购自生工生物工程上海股份有限公司;植物总RNA 提取试剂盒购自北京天根生化科技有限公司;反转录试剂盒购自北京全式金生物科技有限公司;实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)试剂盒2×ChamQ Universal SYBR qPCR Master Mix 购自南京诺唯赞生物科技股份有限公司;核酸测序及引物合成委托北京擎科生物科技有限公司进行。
1.2 仪器与设备
Mastercycler nexus X2 PCR扩增仪、Centrifuge 5418 R微量离心机、CryoCube F740超低温冰箱,德国Eppendorf公司;7250 GC/Q-TOF 气相色谱-质谱联用仪,上海安捷伦科技有限公司。
1.3 试验方法
1.3.1 莲NnCCDs基因家族鉴定 使用NCBI(https://www. ncbi. nlm. nih. gov/)数据库对莲NnCCDs 编码蛋白序列(E 值<10-6)进行在线搜索,获得NnCCDs 蛋白序列。使用Expasy(https://www.expasy.org/)在线网站分析NnCCD4分子量和等电点等理化性质[16]。
1.3.2 莲NnCCD4编码蛋白序列比对及系统进化分析 在NCBI数据库中检索并下载莲NnCCDs及其他高等植物CCD蛋白序列,分析莲NnCCD4蛋白序列的相似性及其结构特征。利用DNAMAN 6.0 软件对NnCCD4与其他物种的CCD4 进行多序列比对[17]。使用软件MEGA 7.0 通过最大简约法(maximum parsimony,MP)绘制高等植物CCDs家族的系统进化树[18]。
1.3.3 莲NnCCD4原核表达载体构建 原核表达载体构建采用一步克隆法[19]。设计特异性引物,引物两端含有15 bp 载体序列,对目的基因进行克隆(表1)。采用pMAL-c5x 作为原核表达载体,使用限制性内切酶BamHⅠ对pMAL-c5x 载体进行酶切,将插入片段与酶切载体进行电泳检测。胶回收进行重组反应后,转化大肠杆菌DH5α感受态细胞,挑取阳性克隆[20]。通过质粒提取试剂盒抽提原核表达载体pMALNnCCD4a、pMAL-NnCCD4b、pMAL-NnCCD4c。

表1 引物序列Table 1 Primer sequences
1.3.4 莲NnCCD4基因表达模式分析 通过植物总RNA 提取试剂盒提取莲的总RNA[21]。使用反转录试剂盒合成cDNA,合成后的cDNA 于-20 ℃冰箱中保存[22]。设计特异性实时荧光定量引物(表1),使用DNA结合染料SYBR GreenⅠ,分析莲NnCCD4基因在不同部位的差异性表达。反应程序:95 ℃预变性30 s;95 ℃变性10 s、55 ℃延伸30 s,40 个循环;溶解曲线95 ℃变性15 s,60 ℃延伸60 s,95 ℃变性15 s。以26 s作为内参基因,每个样品设置3 次生物学重复,基因相对表达量用2-∆∆Ct法计算(fold change),用Origin2017进行柱状图绘制及误差分析[23]。
1.3.5 细菌颜色试验 以pMAL-c5x 空载体作为对照,将重组质粒pMAL-NnCCD4b 与质粒pAC-β 共转大肠杆菌BL21(DE3),37 ℃培养过夜。将共转化的菌液使用100 mL TB 液体培养基进行培养,加入浓度为1 mmol·L-1IPTG 诱导液,诱导时间为15~20 h,产生颜色变化[24]。再使用癸酸乙酯作为内标物,将其加入到待分析的样品混合物中,利用气相色谱-质谱联用技术(gas chromatography-mass spectrometry,GC-MS),并结合固相微萃取技术(solid-phase microextraction,SPME)顶空吸附上机,对莲NnCCD4b基因共转化菌的挥发性物质进行检测[13,25],分析挥发性类胡萝卜素衍生香气物质的组分和相对含量。
用气相色谱-质谱联用(SPME-GC-MS)顶空固相微萃取检测技术共转化菌的挥发性物质,具体方法如下:
(1)设置程序:进样口温度为250 ℃,初始柱温箱温度为50 ℃保持5 min,以25 ℃·min-1升到250 ℃保持5 min 后按1∶20 的比例分流进样;将氦气流速保持在1 mL·min-1,不分流时间为3 min;电离方式为EI,电离能量70 eV,离子源温度为200 ℃,DB-1701 色谱柱(30 m×0.25 mm×0.25 µm);
(2)向装有诱导好菌液的锥形瓶中插入固相微萃取萃取头(SPME,50/30 µm),放入60 ℃恒温水浴锅中30 min进行顶空吸附萃取;
(3)结束后将SPME 萃取头插入仪器中进行解析,5 min后拔出,点击开始键run;
(4)对其检测产物进行数据分析,通过在标准品色谱图中检测到内标物和香气物质的时间来确定标准品的出峰时间、出峰位置和样品含量,从而确定样品中内标物和香气物质的出峰时间。
1.4 数据分析
试验处理重复3 次,数据统计进行3 次生物学重复。采用Origin2017 软件进行数据处理及作图,并应用独立样本的t检验对变量进行显著性差异分析。
2 结果与分析
2.1 莲NnCCD4编码蛋白的理化性质分析
从莲基因组中成功获得3 个CCD基因,分别命名为NnCCD4a、NnCCD4b和NnCCD4c。NnCCD4a、NnCCD4b和NnCCD4c分别含有1 914、1 812 和1 647 bp 的开放阅读框,编码蛋白各含有637、603和548个氨基酸。利用Expasy 在线网站分析NnCCD4 蛋白的分子量、等电点、编码长度以及氨基酸组成等特征(表2)。

表2 莲NnCCD4编码蛋白的理化性质分析Table 2 Analysis of physicochemical properties of lotus NnCCD4-encoding protein
2.2 莲NnCCD4编码蛋白的序列比对分析
使用DNAMAN6.0 软件对不同高等植物,如香瓜(Cucumis melo)、牵牛(Ipomoea nil)、苹果(Malus domestica)、烟草(Nicotiana tabacum)、番茄(Solanum lycopersicum)、马铃薯(Solanum tuberosum)、葡萄(Vitis vinifera)、莲的CCD4 蛋白序列进行比对(图1)。结果表明,氨基酸序列多重比对一致性为82.98%;NnCCD4与MdCCD4 的同源性为76.48%;与VvCCD4 的同源性为74.64%;与NtaCCD4的同源性为73.08%;与SlCCD4的同源性为71.85%;与InCCD4 的同源性为72.31%;与StCCD4 的同源性为72.24%;与CmCCD4 的同源性为72.09%。说明不同物种的CCD4 蛋白序列具有较高的同源性,NnCCD4 与苹果和葡萄之间具有较近的同源关系。
2.3 CCDs家族的系统进化分析
利用MEGA 7.0 软件通过最大简约法构建CCDs家族的系统进化树(图2)。结果表明,NnCCD4a、NnCCD4b和NnCCD4c属于CCD 基因家族中CCD4 亚家族,不同亚基因家族之间进化关系存在差异。NnCCD4a、NnCCD4b与NnCCD4c与其他物种的CCD4亚家族同源性较低。说明NnCCD4在进化过程中保守性不强,不同种属之间存在差异。
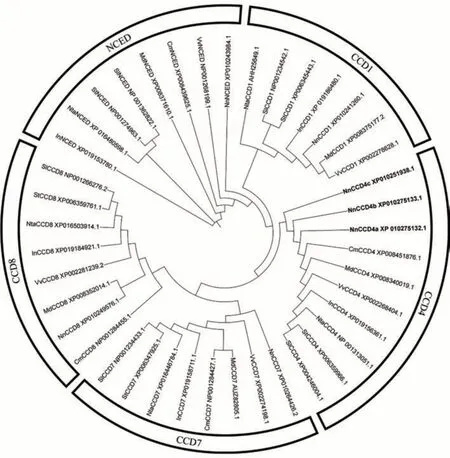
图2 莲NnCCD4与其他亚家族的系统进化树Fig.2 Phylogenetic trees of NnCCD4 and other subfamilys
2.4 qRT-PCR分析莲NnCCD4基因家族的表达模式
qRT-PCR结果表明,NnCCD4a、NnCCD4b、NnCCD4c在成熟叶片和花中的表达量普遍高于莲子和幼叶(图3)。其中NnCCD4a在成熟叶片中表达量较高;NnCCD4b在不同颜色的花瓣中的表达量较高,且白花表达量最高,红花次之,黄花则相对偏低;而NnCCD4c相较于NnCCD4a、NnCCD4b在不同部位的表达量均偏低。上述结果表明,NnCCD4 家族成员在莲不同组织器官发育中可能起到不同的作用,其中NnCCD4b在莲花的发育过程中发挥着重要作用。
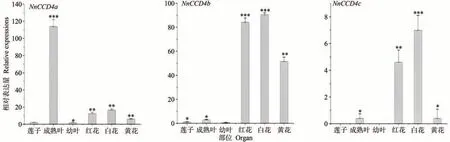
图3 NnCCD4基因在莲的不同部位中的表达量Fig.3 The amount of expression of the NnCCD4 gene in different organs of the lotus
2.5 NnCCD4蛋白的功能及酶切产物分析
考虑到NnCCD4b主要表达于不同颜色莲的花瓣中,以NnCCD4b作为研究对象,分析其酶切产物。质粒pAC-β能够在大肠杆菌中合成β-胡萝卜素,使菌体产生黄色。如图4-A 所示,由于pMAL-c5x 空载体不携带NnCCD4基因,所以共转化菌用IPTG 诱导后,由于β-胡萝卜素积累而呈现出深黄色。与对照相比,重组质粒pMAL-c5x-NnCCD4b 和pAC-β 共转化菌中的颜色明显变浅,说明NnCCD4b 有催化活性,能够切割β-胡萝卜素,使颜色变浅。
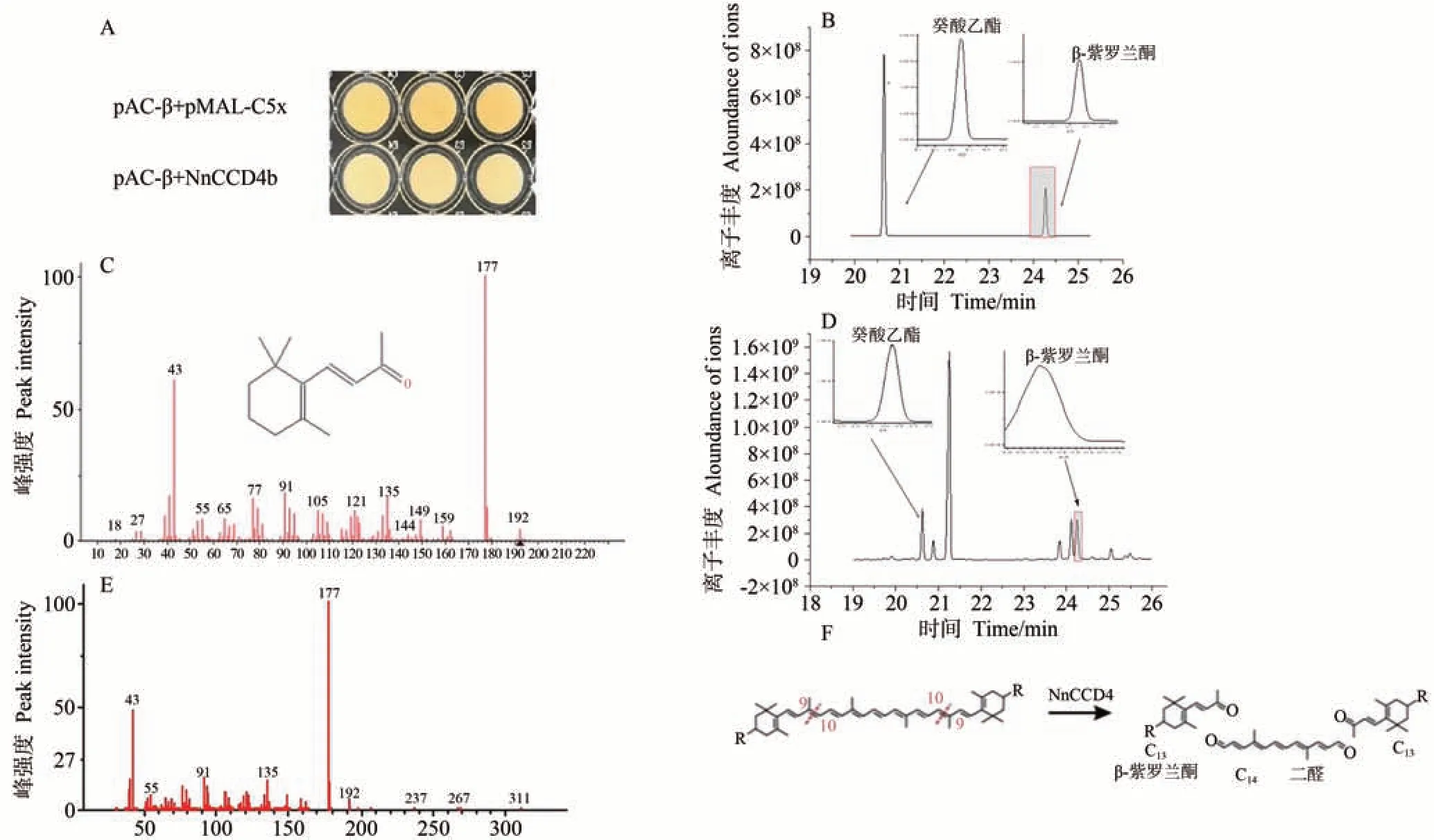
图4 标准品与莲NnCCD4b的类胡萝卜素含量检测色谱图Fig.4 Chromatogram of carotenoid content detection of standard with NnCCD4b
为了进一步确定其裂解类胡萝卜素产物,以pMALc5x作为对照,使用癸酸乙酯作为内标物,利用GC-MS技术,并结合SPME顶空吸附上机,对莲NnCCD4b共转化菌的挥发性物质进行检测,分析挥发性类胡萝卜素衍生香气物质的组分和相对含量。在标准品色谱图20.69 min 处检测到了内标物癸酸乙酯,24.27 min 处检测到了香气物质β-紫罗兰酮,从而确定了标准品的出峰时间、出峰位置和样品含量(图4-B)。根据总离子流色谱图,通过检索NIST98谱图库,并结合标准质谱谱图,在重组质粒pMAL-c5x-NnCCD4b和pAC-β共转化菌中进行检测,分析色谱图发现了挥发性物质β-紫罗兰酮(图4-D),且质谱图(图4-E)与标准品的质谱图(图4-C)一致。说明NnCCD4b 蛋白可以分解β-胡萝卜素的9,10/9′,10′双键,通过降解不同类胡萝卜素底物的不同双键,生成13 个碳原子的β-紫罗兰酮(图4-F)。
3 讨论
本研究对NnCCD4基因家族保守基序、系统发育和表达模式进行了分析,通过同源克隆从莲基因组中获得了3 个NnCCD4 基因家族成员:NnCCD4a、NnCCD4b和NnCCD4c,结果表明,NnCCD4 基因家族的蛋白相对分子质量大小在61.49~70.14 kDa,pI值在5.55~6.52,表明NnCCD4 家族成员间在蛋白质大小、pI 值等特征参数上差异不大。克隆得到的3 个NnCCD4 基因家族成员与其他植物中已报道的CCD4基因相似[26]。NCBI比对结果表明,NnCCD4基因具有CCDs 家族基因相似结构特征的保守结构域。对蛋白序列进行研究发现,NnCCD4 与其他物种CCD4 家族成员的蛋白序列有较高的同源性。此外,NnCCD4c与NnCCD4a、NnCCD4b的亲缘关系较远,说明不同亚基因家族之间亲缘关系存在差异。通过分析CCDs 的家族进化树,发现NnCCD4在进化过程中保守性不强,不同种属之间存在差异,这与岳远征等[27]和王赞等[28]的研究结果一致。
植物的生长发育离不开CCD亚家族各成员的表达。Rubio等[29]证明番红花(Crocus sativus)CsCCD4b仅在柱头组织中表达;王昊等[30]证明芹菜(Apium graveolens)AgCCD4在叶片中高表达,叶柄和根中的表达量低,说明CCD 亚家族基因在植物不同组织和器官中具有表达特异性。本研究结果显示,3 个NnCCD4基因在莲子、叶片和花中的表达量都存在明显差异:NnCCD4c表达量最低;对比叶片的2 个生长时期发现,在成熟叶片中NnCCD4a表达量明显高于幼叶中的表达量。在3种不同颜色的花中,NnCCD4b表达量远高于NnCCD4a和NnCCD4c,且白花表达量最高,红花次之,黄花则相对偏低。
CCD 基因家族成员是一类具有RPE65 保守结构域的基因家族,大多存在于植物中,如葡萄基因组中鉴定出19 个CCD[31]、水稻中鉴定出11个CCD[32]、拟南芥和番茄中均鉴定到9 个CCD[6,33]。CCD 亚家族各成员编码的酶在类胡萝卜素的代谢过程中发挥了重要作用,目前在番红花、桂花和矮牵牛中均已证实CCD1 和CCD4可参与类胡萝卜素的降解,导致类胡萝卜素含量发生变化,裂解产生独特的香气物质。Baldermann等[34]证明桂花OfCCD1可裂解β-胡萝卜素产生β-紫罗兰酮、假紫罗兰酮以及香叶基丙酮。Simkin等[35]证明矮牵牛花中PhCCD1的表达量增加会使β-紫罗兰酮的含量相应升高。Rubio等[29]证明番红花CsCCD4柱头发育期间会裂解出β-胡萝卜素,产生β-紫罗兰酮。Song等[36]证明在转基因水稻中过表达拟南芥AtCCD4 会使水稻中β-胡萝卜素降低74%,且β-紫罗兰酮的含量是非转基因水稻的2 倍。本研究通过GC-MS 和SPME 顶空吸附上机对莲NnCCD4b共转化菌的挥发性物质进行检测,结果表明NnCCD4 可以催化β-胡萝卜素氧化裂解,产生香气物质β-紫罗兰酮。这与Baldermann 等[34]和Simkin 等[35]的研究结果一致。本研究表明NnCCD4很可能是莲代谢途径里的一个关键基因,这为今后植物品质改良提供了一定的理论依据,为后续进一步研究莲NnCCD4基因家族功能特性提供了理论基础。
4 结论
本研究以NnCCD4 为研究对象,通过生物信息学手段对其氨基酸序列进行分析,发现NnCCD4 与其他物种家族成员同源性较高,且NnCCD4在不同亚基因家族之间亲缘关系存在差异;采用qRT-PCR 对不同生长时期NnCCD4基因的表达量进行分析,证明了莲不同组织部位中不同基因之间存在表达差异,通过构建原核表达载体,进一步研究NnCCD4 蛋白的酶活性以及酶切产物,从分子水平上揭示了NnCCD4 降解类胡萝卜素产生香气物质对莲品质的影响。

