利用常压室温等离子体诱变选育工厂化金针菇新菌株
陆 欢 刘建雨 杨 慧 张 丹 宋春艳 谭 琦 王瑞娟 尚晓冬
(上海市农业科学院食用菌研究所/农业农村部南方食用菌资源利用重点实验室/囯家食用菌工程技术研究中心/上海市农业遗传育种重点实验室,上海 201403)
近十年来,我国食用菌产业进入快速发展时期,食用菌产量和产值都发生了极大的变化。其中,金针菇(Flammulina filiformis)作为我国最早实现工厂化生产的品种,居工厂化栽培品种之首,2019 年的年产量已达到258.96 万吨[1]。金针菇工厂化栽培集中度随着经济和技术的发展而不断提高,栽培技术水平和规模均位于世界前列,使得工厂化金针菇成为世界上工业化水平最高、市场竞争最激烈的品种之一。
菌种是食用菌生产最重要的生产资料,种质资源更是食用菌产业发展的关键,优良新品种的选育是影响食用菌产业,尤其是金针菇产业持续发展的重要因素[2-3]。我国金针菇工厂化主栽品种一直以生产周期短、产量高的日本白色系列品种为主。目前仍没有我国自主知识产权品种用于规模化生产,因此菌种成为了制约我国金针菇产业发展的首要瓶颈问题[4]。而且市场上白色金针菇产品同质化竞争日趋激烈,在外观、营养品质、口感、货架期等方面几乎没有差异,限制了金针菇产业的发展。因此,开发创制金针菇新种质,培育具有市场竞争潜力的金针菇新品种,对引领金针菇产业的现代化发展有十分必要的作用。
金针菇的育种工作是实践和理论相结合的一项工作,既需要开展大量的选配、鉴定、筛选和推广,也需要高度凝练的育种原则和成熟的育种理论,两个方面的有效结合才能提高育种工作的效率。通过近些年发展起来的新颖物理诱变方式——常压室温等离子体(atmospheric and room temperature plasma mutagenesis,ARTP)诱变,能在短时间内处理生物细胞并产生104以上的突变体,构建大的突变库,从多样性的大突变文库中筛选具有理想目的性状的菌株[5-7]。ARTP诱变具有以下特点:第一,能使细胞表面电势下降,改变细胞壁或细胞膜结构及通透性;第二,可对遗传物质造成损伤,启动生物细胞SOS 修复机制;第三,造成基因序列及其代谢网络发生显著变化,最终引起突变效应获得大量稳定遗传的突变株。据报道,杨茹等[8]已利用ARTP 诱变技术选育出一株抗病性强、纤维含量低的金针菇菌株;此外,该技术在猴头菇[9-11]、柱状田头菇[12]、灰树花[13]、灵芝[14]、桑黄[15]、蛹虫草[16]和花脸香蘑[17]等食用菌新品种选育上也已成功应用,充分说明ARTP 诱变技术能为食用菌的高效育种提供重要技术撑。为进一步完善金针菇ARTP 诱变技术体系,本研究构建从ARTP 诱变后的诱变群体,通过群体农艺性状及其稳定性测定,筛选出具有高产优质特性的新菌株,以期有效扩充我国工厂化金针菇的种质资源库。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 试验所用菌株为农业农村部国家食用菌种质资源库(上海)保藏的金针菇菌株上研1号。
1.1.2 供试培养基 马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,无菌水定容至1 000 mL,自然pH值,在121 ℃、1×105Pa条件下灭菌20 min。液体培养基:豆粉1.5 g,白砂糖12 g,硫酸镁0.4 g,磷酸氢二钾0.4 g,自然pH 值,无菌水定容至600 mL,在121 ℃、1×105Pa条件下灭菌20 min。栽培配方:培养基干物质构成包括玉米芯38.5%,米糠29.5%,麸皮9.6%,棉籽壳5.4%,大豆皮3.2%,啤酒糟4.8%,甜菜渣3.2%,豆渣3.5%,贝化石1.6%,轻质碳酸钙0.7%,含水量65%左右,自然pH值。
1.2 仪器与设备
ARTP 诱变育种仪,无锡源清天木生物科技有限公司;MS-TS 分析天平,梅特勒-托利多仪器(上海)有限公司;FD5-3T真空冷冻干燥机,美国西盟国际公司;GZX-9240MBE 数显鼓风干燥箱,上海博迅实业有限公司医疗设备厂;JXFSTPRP-24 研磨仪,上海净信科技有限公司; Heraeus Fresco17 离心机,美国Thermo Fisher Scientific 公司;YM-080S 超声仪,深圳市方奥微电子有限公司;6460 Triple Quadrupole Mass Spectrometer质谱仪、1290 Infinity II series UHPLC System 超高效液相仪,美国Agilent公司。
1.3 试验方法
1.3.1 诱变材料制备 采收成熟金针菇菌株上研1 号的子实体,分别取10~15 个菌盖置于无菌培养皿中,静置收集孢子。用无菌水将金针菇孢子制备成浓度为1×106的孢子悬浮液,将孢子悬浮液装至灭菌后的2 mL离心管备用。
1.3.2 ARTP 诱变处理 在超净台内将载片置于酒精灯外焰灼烧30 s,待冷却后放到已灭菌培养皿中,取10 µL 备用的菌悬液均匀涂布在载片表面。用无菌镊子将装有样品的载片依次放到诱变仪对应的凹槽,并将装有1 mL 无菌生理盐水的2 mL 离心管放入凹槽下方位置固定。设置诱变仪的工作功率为120 W,气流量为10 L·min-1,诱变处理时间分别为15、30、45、60、75、90、105、120 s。诱变处理结束后将离心管置于振荡器上振荡1 min,形成新的菌悬液。对菌悬液进行适当稀释至浓度为1×103,取100 µL 稀释液涂布于PDA平板上,20 ℃条件下恒温培养3~5 d。以未经处理的同等浓度的孢子悬液作为空白对照(CK),计算致死率。每个处理设5个重复。
1.3.3 自交群体构建 孢子萌发后,挑选两个或多个单菌落菌丝融合生长在一起的菌块进行镜检,有锁状联合的菌块鉴定为自交成功的菌株。将镜检后的自交菌株转接至平板PDA 培养基上,于20 ℃条件下恒温培养。用打孔器取直径为5 mm 的自交菌株菌种块转接于PDA 平板,转接培养15~20 次,于20 ℃条件下恒温培养7 d,保存备用。
1.3.4 菌丝生长速度测定 将自交菌株分别转接于PDA 平板上,于20 ℃条件下恒温培养,从菌块中心点开始用游标卡尺测量培养第5 和第7 天的菌丝生长距离,计算自交菌株菌丝在平板PDA 培养基上的日平均生长速度,每个菌株设3个重复。
1.3.5 摇瓶培养 用打孔器取8 块5 mm 的菌种块接种于装有600 mL 培养基的1 000 mL 三角瓶中,置于20 ℃、150 r·min-1的摇床中避光培养8 d,观察自交菌株的菌球形态及测量菌丝生物量,每个菌株设3个重复。
1.3.6 栽培试验及农艺性状测定 栽培瓶灭菌接种后移入培菌室(黑暗条件下培养),温度为14~19 ℃,湿度保持在85%以上。培养22 d 后搔菌,移入出菇培养室。菌丝恢复阶段温度为14~15 ℃,湿度保持在90%以上。搔菌后第4天开始现原基,原基发生期每天给予充分光刺激。搔菌后第9天进入抑制期,抑制期的温度控制在3~4 ℃之间,湿度保持在90%以上,间断给予光刺激。搔菌后第15天套筒,培养温度为5~8 ℃,湿度为80%~85%,间断给予光刺激。搔菌后第26~第28天,开始采收。记录不同自交菌株的原基形成时间(从搔菌到原基形成的时间),并用游标卡尺测量和记录菌盖直径、菌柄直径,用直尺测量和记录菌柄长度,以及单瓶产量等农艺性状数据,每个自交菌株32瓶重复。
1.4 新菌株的氨基酸含量测定及评价
参照王清华[18]的方法测定子实体中的氨基酸含量。根据Seligson 等[19]的方法计算化学评分(chemical score,CS);根据朱圣陶等[20]的方法计算氨基酸比值系数分(score of RC,SRC),参照Oser等[21]的方法计算必需氨基酸指数(essential amino acid index,EAAI);依据世界卫生组织/联合国粮食及农业组织/联合国大学(World Health Organization/Food and Agriculture Organization of the United Nations/United Nations University,WHO/FAO/UNU)提出的方法计算蛋白质消化率校正氨基酸得分(protein digestibility corrected amino acid score,PDCAAS)[22]。
1.5 数据分析
采用Agilent Mass Hunter Work Station Software(B.08.00)进行氨基酸的质谱数据采集及目标化合物定量分析,采用SPSS 22.0 软件对金针菇的农艺性状进行方差和显著性分析,采用Origin 2021作直方图、相关性热图和主成分分析(principal component analysis,PCA)图。
2 结果与分析
2.1 ARTP诱变处理孢子萌发及菌株筛选情况
上研1 号的孢子经ARTP 诱变处理后的萌发率及致死率统计结果见表1。当诱变时间达120 s 时,致死率达100%。挑选两个或多个单菌落菌丝融合生长在一起的菌块进行培养,经镜检有锁状联合后确认为自交菌株。选取不同诱变处理时间(15~105 s)的自交菌株各25 个,从中挑选出菌丝生长状况良好的164 个诱变菌株按照A1~A164 进行编号,连续传代培养至第10 代,传代过程中淘汰菌丝长势差和退化的35 个菌株,得到129 个诱变菌株。再继续传至第20 代过程中淘汰28个气生菌丝多、长势差的菌株,最后得到108个诱变自交菌株。

表1 孢子ARTP 诱变后的孢子萌发率及致死率统计结果Table 1 Statistical results of single colony germination and mortality of spore of Flammulina filiformis after ARTP mutagenesis
2.2 多孢自交菌株平板培养和摇瓶培养筛选情况
经过比较108 个孢子诱变自交菌株的平板菌丝生长速度、菌落形态和摇瓶菌球生长情况、生物量等性状,筛除菌丝生长速度极慢、菌丝活力弱、气生菌丝浓密、传代后菌丝容易断裂退化、摇瓶后菌球数量少和易污染的菌株,获得菌丝生长速度较快、菌丝活力较强和摇瓶菌球生物量较多、菌球形状大小均匀的65 个菌株。筛选出65 个菌株的平板菌丝生长速度和摇瓶菌丝生物量(干重)的频次分布图见图1、2,部分菌株摇瓶菌球外观形态见图3。

图1 65个自交菌株菌丝生长速度频次分布图Fig.1 Frequency distribution map of mycelial growth rate of 65 self-bred strains of Flammulina filiformis
65 株自交菌株群体平板菌丝生长速度呈正态化分布(图1),自交菌株菌丝平均生长速度主要分布在2.90~4.30 mm·d-1之间,有16.92%的自交菌株平均生长速度大于4.00 mm·d-1。亲本上研1 号的平均菌丝生长速度为2.60 mm·d-1,其中有90%的自交菌株菌丝平均生长速度高于亲本上研1 号,表现出了超亲的优势,可能是诱变后产生的突变效应导致的。65 株自交菌株摇瓶菌丝生物量的分布情况见图2,可知65 株自交菌株群体的菌丝生物量同样呈正态化分布,自交菌株菌丝生物量主要分布在1.25~2.00 g 之间。65 株自交菌株的摇瓶菌球形态均为球形,菌球大小较均一,部分菌株菌球表面有刺突状(图3)。
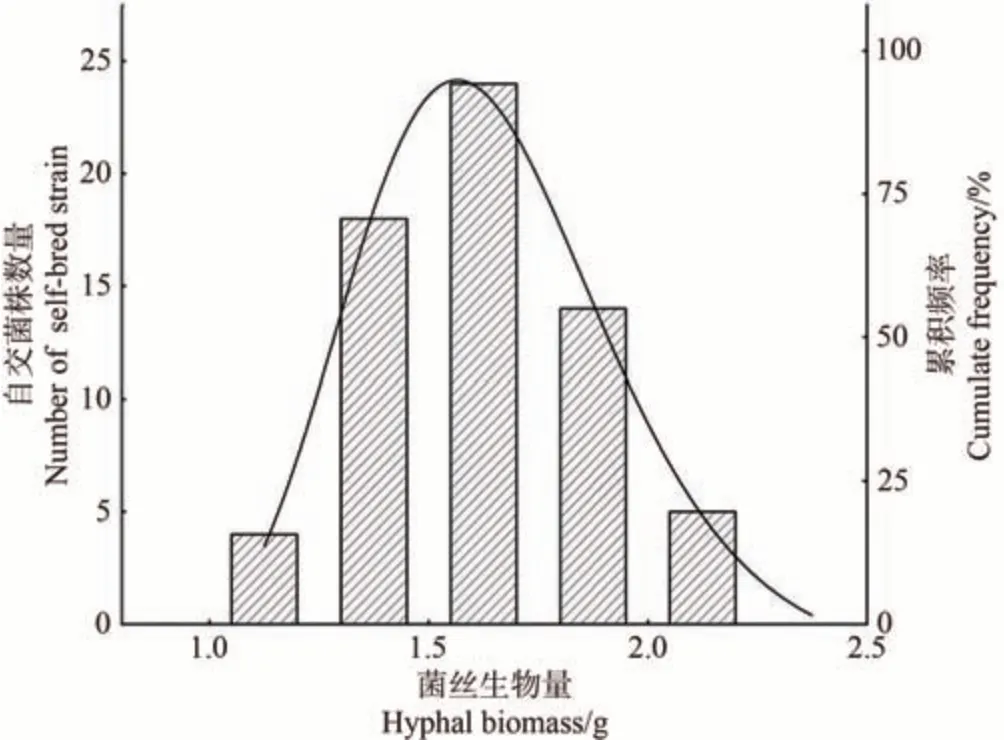
图2 65个自交菌株菌丝生物量(干重)频次分布图Fig.2 Frequency distribution map of hyphal biomass(dry weight) of 65 self-bred strains of Flammulina filiformis

图3 自交菌株摇瓶菌落形态图Fig.3 Colony morphology diagram of self-bred strains of Flammulina filiformis in shake flask
2.3 自交菌株工厂化小试出菇栽培情况
将筛选出的65 个菌株及其亲本上研1 号进行工厂化小试出菇试验,65 株自交菌株的平均单瓶产量分布情况如图4 所示,65 株自交菌株的单瓶产量呈正态化分布。自交菌株的亲本上研1 号平均单瓶产量为433.3 g/瓶,自交群体的平均产量为382.40 g,主要分布范围为387.50~425.00 g 之间。其中有4.62%自交菌株的单瓶产量高于亲本上研1号,有12.31%自交菌株的单瓶产量与亲本上研1 号的平均产量无显著差异,有29.23%自交菌株的单瓶产量高于400 g,说明孢子诱变后的自交菌株在工厂化栽培条件下具有高产的商品特性。

图4 65个自交菌株单瓶产量频次分布图Fig.4 Frequency distribution map of yield per bottle of 65 self-bred strains of Flammulina filiformis
单瓶产量是金针菇工厂化生产重要的考核指标之一,子实体生育时间、菌丝生长速度和出芽数影响着金针菇的单瓶产量。此外,菌盖直径、菌盖厚度、菌柄长度和菌柄直径影响金针菇的商品特性。将65 株自交菌株的单瓶产量、菌丝生长速度和菌盖直径等8 个农艺性状进行相关性分析,结果如图5 所示。单瓶产量与菌丝生长速度呈极显著相关(P<0.001),与子实体生育时间和出芽数呈显著相关(P<0.01),并与出芽数的相关性较大。菌盖直径与菌柄高度和菌柄直径呈极显著相关(P<0.001),与菌柄直径的相关性较大;菌盖高度与子实体生育时间呈极显著相关(P<0.01);菌柄直径与出芽数呈显著相关(P<0.01);菌柄长度也与出芽数呈显著相关关系(P<0.05);出芽数与菌丝生长速度呈极显著相关(P<0.01);子实体生育时间也与菌丝生长速度呈显著相关关系(P<0.05)。说明自交菌株的单瓶产量主要与菌丝生长速度相关,还与出芽数和子实体生育时间相关,菌株的商品性状也与出芽数和子实体生育时间相关,因此在筛选产量高、商品性状的优良新菌株时,需要综合考虑菌丝生长速度、出芽数和子实体生育时间,以此缩短选育时间。

图5 65个自交菌株的农艺性状相关性热图Fig.5 Correlation thermogram of agronomic characters of 65 self-bred strains of Flammulina filiformis
对主要影响工厂化金针菇生产品质和效能的因素:单瓶产量、菌丝生长速度、出芽数和子实体生育时间进行PCA 分析,结果如图6 所示。第一主成分贡献率为97.3%,第二主成分贡献率为2.7%,且出芽数分布在第一象限,菌丝生长速度和子实体生育时间分布在第二象限,单瓶产量分布在第三象限。根据PCA 的基本原则,在得分图上距离越接近表示具有信息量和影响力相似值越大,说明菌丝生长速度相关和子实体生育时间在对金针菇品质的影响力值相当;此外,出芽数是影响金针菇生长和产品品质的主要因素。
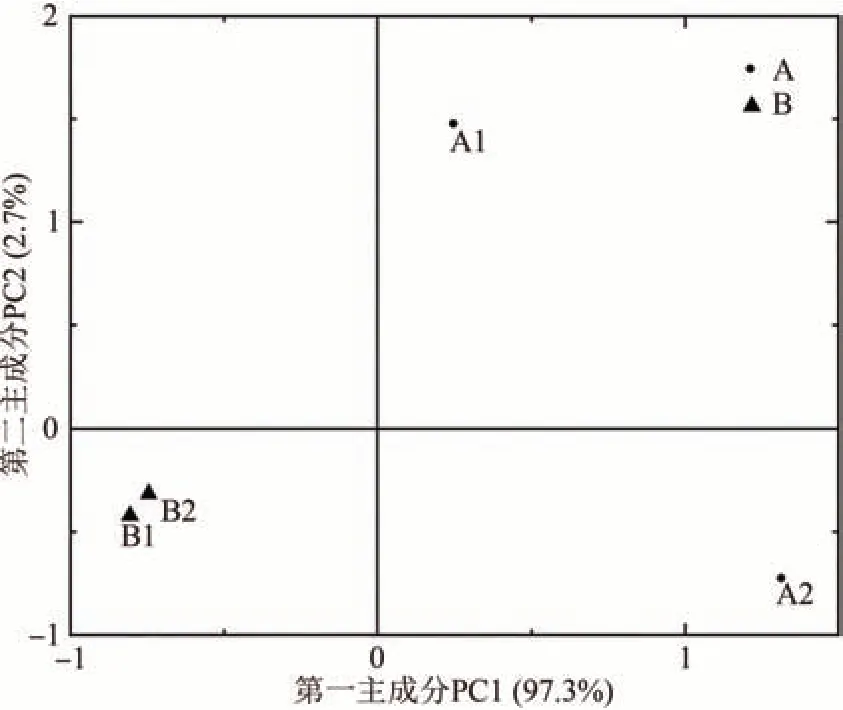
图6 65个自交菌株的4个重要农艺性状PCA得分图Fig.6 PCA score plot of 4 important agronomic characters of 65 self-bred strains of Flammulina filiformis
2.4 优良菌株出菇栽培情况及农艺性状比较
根据菌丝生长速度、摇瓶生长情况、单瓶产量及菌盖直径等农艺性状筛选结果,并结合不同性状的相关性结果,从65 株自交菌株中筛选出菌丝生长速度快、摇瓶菌球均匀、生育时间较短、单瓶产量较高出芽数较多和菌盖较厚的17 个自交菌株。对17 个自交菌株进行扩大重复栽培试验,以考察菌株农艺性状的遗传稳定性(表2、3)。

表2 17个优良自交菌株的主要农艺性状Table 2 Main agronomic characters of 17 excellent self-bred strains of Flammulina filiformis

表3 17个优良自交菌株的商品性状Table 3 Commercial characters of 17 excellent self-bred strains of Flammulina filiformis
对17 株自交菌株的原基形成时间、子实体生育时间、平均单瓶产量,子实体的菌盖直径、菌盖高度、菌柄直径、菌柄长度,以及子实体密度和菌根粘连程度等主要农艺性状和商品性状进行了对比。结果显示,筛选出的17 个优良自交菌株菌盖多为半球形、球形或钟形,而上研1 号的菌盖为半球形。17 个优良自交菌株的现原基时间在5~7 d 之间,栽培周期在25~28 d 之间,与亲本现原基时间(5~6 d)和栽培周期(27~29 d)之间的差异不明显。亲本的菌盖直径为8.33 mm,菌盖高度为4.02 mm,菌柄直径为2.17 mm,菌柄长度为16.97 cm,出芽数为1 191 个;自交菌株的菌盖直径为4.76~7.90 cm 之间,菌盖高度为3.52~5.11 cm,菌柄直径为1.78~3.53 mm,菌柄长度为11.69~16.82 mm,出芽数为637~1 142 个。自交菌株中子实体密度分为高、中、低3 种,粘连度也分为高、中、低3 种,其中35.29%自交菌株的子实体密度和菌柄粘连度都较高,相对应的单瓶产量也较高且商品性状较好。
对比17 个自交菌株不同农艺性状和商品特性后,发现自交菌株A130具有菌丝生长速度快、原基形成时间短、菌盖直径较小、子实体密度较高和单瓶产量较高的特性,单瓶产量和菌丝生长速度等农艺性状的表现优于亲本,此外,子实体菌盖厚度高于亲本,子实体生育时间较亲本缩短1 d。因此,可将A130 作为生产备用品种,命名为上研A130,并对其进一步扩大栽培验证性状的稳定性。
2.5 上研A130工厂化出菇栽培及品质比较
上研A130 及其亲本、工厂化生产对照的子实体见图7,与亲本和生产对照的性状对比见表4。上研A130 子实体颜色均匀,菌盖呈球形内扣,菌盖纵切面顶端呈半球形,菌褶排列规则,其单瓶产量和菌柄直径等重要农艺性状都高于亲本,子实体生育时间和菌盖直径都小于亲本,出芽数和亲本无显著差异。在上海雪榕生物技术股份有限公司、河北光明九道菇生物科技有限公司、福建万辰生物科技股份有限公司和上海颂菌生物科技有限公司开展多批次多点工厂化示范栽培,上研A130 整体表现为稳产高产、早熟优质,其产量、生育周期和农艺性状等指标均表现出均一稳定性,适合工厂化栽培。目前上研A130 已通过了2022 年上海市农业技术推广服务中心非主要农作物品种认定。

图7 上研A130和亲本及生产对照子实体形态图Fig.7 Morphological diagram of fruiting body of Shangyan A130,its parent and production control
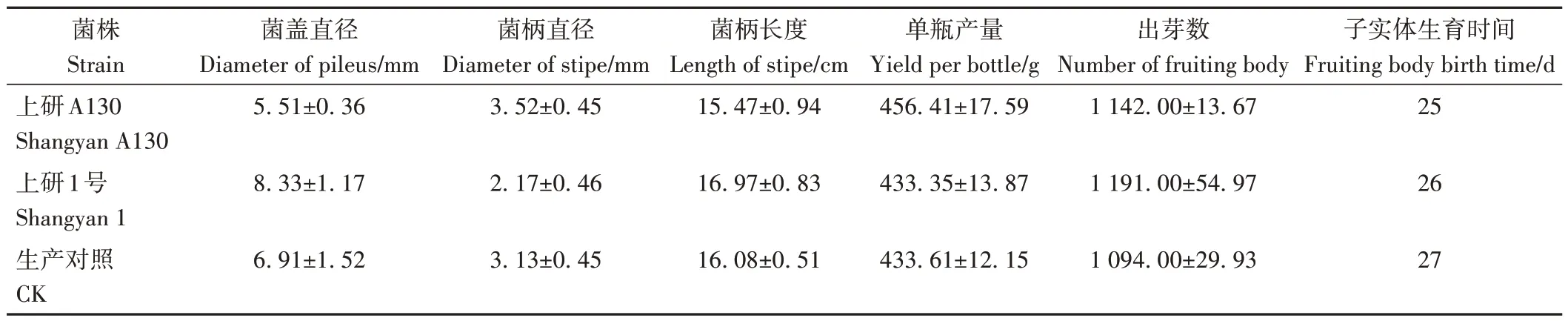
表4 上研A130和亲本及生产对照的农艺性状比较Table 4 Comparison of agronomic characters between Shangyan A130 and its parent
2.6 上研A130与亲本及生产对照的蛋白质评价比较
由表5 可知,上研A130 与其亲本及生产对照的氨基酸组分间含量存在一定的差异。其中上研A130 的苏氨酸、赖氨酸、色氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、酪氨酸和组氨酸高于亲本,其余氨基酸低于亲本,除丙氨酸和脯氨酸高于生产对照外,其余氨基酸均低于生产对照。上研A130 及与其亲本及生产对照的CS、SRC、EAAI 和PDCAAS 值如表6 所示。A130 的CS和EAAI 值都低于亲本和生产对照,SRC 和PDCAAS 值都高于亲本,PDCAAS 值低于生产对照。其中上研A130 的SRC 值与鸡蛋(81.22)无显著差异,说明上研A130 蛋白质营养价值比较高。但A130 的EAAI 值远低于100,说明其蛋白质平衡性相对较差。上研A130的PDCAAS(消化率以73%计算)比亲本在人体对必需氨基酸消化过程中营养吸收的能力强。综上,新品种上研A130的蛋白质含量丰富,可用于后续蛋白产品的开发。

表5 上研A130及其亲本的氨基酸组成Table 5 Amino acid composition in Shangyan A130 and its parents
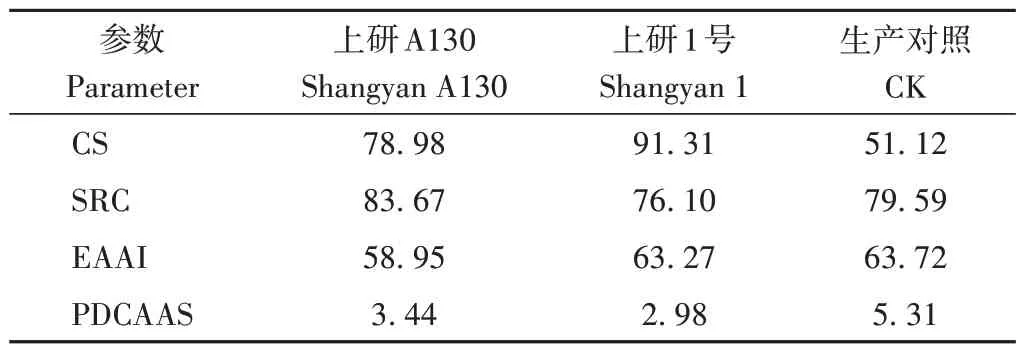
表6 上研A130及其亲本蛋白中必需氨基酸评价Table 6 Evaluation of essential amino acids in proteins of Shangyan A130 and its parents
3 讨论
目前,ARTP 诱变技术已被广泛应用于微生物的诱变育种工作。ARTP 诱变处理微生物后,具有改良菌种[23]、提高产量[24]、提高目标产物和发酵产物的含量[25-27]、提高耐受性[28-30]等特性。虽然我国拥有丰富的金针菇种质资源,但优良育种材数量较少,白色品种亲缘关系较为接近,如何对这些珍贵的种质资源进行精准利用,是创制新型优异白色金针菇种质的关键。本研究发现,具有高产特性的金针菇菌株上研1 号经ARTP 处理后,提高了亲本的突变率,结合传统选育方法,筛选出产量和性状都优于亲本的突变株。这样的突变选择有利于选育高产、优质的新种质,在生产实践中可提高生产效率。李正鹏等[31]利用ARTP 诱变技术,选育出具有菌丝生长速度快、产量和生物转化率都比较高的特性的暴马桑黄新品种沪桑2 号;Li 等[15]通过ARTP 诱变技术,筛选出1 株高产的桑黄菌株A130-20,均与本研究的选育结果一致,即通过ARTP 诱变技术筛选出了具有目标性状的新菌株。
食用菌新品种是否具有价值取决于其商品性状是否满足了市场需求,因此,通常以菌丝生长情况和生产上的农艺性状等商品性状来评价新种质。而在进行ARTP 诱变时,等离子体产生的大量高能自由基团和活性离子,能破坏细胞结构,不断击穿微生物导致其死亡,最后经ARTP 处理后存活下来的微生物则发生了基因突变。因此选择合适的诱变时间、流量等条件有利于快速有效地筛选突变株。本研究结果表明,ARTP不同处理时间对上研1 号孢子萌发率有影响,在诱变时间达120 s 时,致死率达100%。这对提高孢子自交菌株的农艺性状有一定的影响,可能是由于经等离子体照射后,孢子所含的与生长代谢相关的酶或基因产生了变化,使得孢子的细胞壁膜结构和通透性都发生变化,提高了新陈代谢水平,从而促进了菌丝的萌发和生长和农艺性状的改变。刘微[32]以毛木耳菌悬液为材料,发现ARTP 的最佳诱变时间为50 s,诱变致死率为92.03%,筛选得到生物学效率最高的菌株SL205,且SL205 与出发菌株遗传关系最远,说明发生了明显基因突变,与本研究结果相似,推测是经过不同时间的处理,诱变材料在等离子体的作用下出现了断裂、破碎现象,导致DNA结构发生了变化。
通过传统的自交和杂交的选育方法是创制金针菇新种质的主要手段之一。徐珍等[33]利用单孢子分离技术,经过单单杂交选育出菇形好、生育期短、产量高的白色优良菌株G1;王波等[34]通过双单杂交从F2代中选育出早熟、菌柄基部无绒毛、不粘连、子实体弯曲度低和高产的白色金针菇优良品种川金5号,但传统方法创制出具有优良性状的品种的概率较低。因此,通过诱变育种以获得具有新性状的突变体,最终达到育种目标,也是目前食用菌育种的主要方法之一。武晓雨等[35]通过紫外诱变选育出耐高温的香菇新品种金西1号,出菇温度可达38 ℃;李春霞等[36]利用ARTP 诱变获得了产漆酶能力高的真姬菇突变菌株;杨茹等[8]利用ARTP诱变技术选育出抗病性强、纤维含量低的白色菌株AR12和AR17。本研究利用金针菇孢子为诱变材料,验证了常压室温等离子体诱变技术在育种方面的可行性,为后续将 ARTP 技术应用食用菌育种提供了基础。
本研究从孢子准备到诱变再到出菇试验,不同突变菌株在农艺性状上存在显著的差异,并筛选得到出芽快、产量高、商品性状优良菌株上研A130,推测是ARTP 处理后激发基因突变导致的。接下来可利用原生质体、单孢子等为材料进行ARTP诱变,并细化ARTP诱变参数,以期明确金针菇ARTP 诱变最适合的条件,进一步从分子层面研究其诱变机理,建立金针菇ARTP诱变育种平台,为金针菇育种的后续深入研究提供依据。
4 结论
以上研1号为亲本,对其孢子进行不同时间ARTP诱变,当诱变时间达120 s时,致死率达100%。诱变后采用多孢自交方法获得108 个突变自交菌株,根据生理指标进行筛选,选育出菌丝长势强、菌丝生长速度快、子实体生育时间短、芽数多、产量高、菌盖厚实不易开伞、商品性状优良的金针菇新菌种上研A130。上研A130 具有生产同步性好、出菇整齐等特性,适用于瓶栽工厂化周年生产。经过ARTP 诱变后的自交群体中只有少部分菌株的菌丝生长速度、原基形成时间、子实体生育时间和单瓶产量均优于亲本上研1 号,可能与诱变后导致基因突变有关,但突变的机理以及新菌株的优异性状是否能稳定遗传还需进一步研究。

