白细胞介素-6及其因CYP2C19基因多态性对伏立康唑血药谷浓度的影响*
申明慧,周丽娟,李慧红,桑智慧,2,何勐,张华,李敏
(1.郑州大学附属郑州中心医院转化医学中心,郑州 450007;2.新乡医学院药学院,新乡 453003;3.郑州大学附属郑州中心医院药学部,郑州 450007;4.郑州大学附属郑州中心医院呼吸内科,郑州 450007)
伏立康唑(voriconazole,VCZ)是侵袭性曲霉病的一线治疗药物,主要经肝细胞色素P450(CYP)2C19代谢,少部分经CYP3A4和CYP2C9代谢[1]。VCZ的药动学特征呈非线性且药物浓度个体间和个体内变异大。已有研究表明[2-3],VCZ血清谷浓度(voriconazole serum trough concentration,VCZ-Cmin)和临床有效性及毒性相关,当Cmin<0.5 mg·L-1时与治疗失败相关,Cmin≥5.0 mg·L-1,疗效较好,但易出现相关的肝毒性、神经毒性和视觉毒性等不良反应。
CYP同工酶、肝损伤、药物相互作用、C-反应蛋白(C-reactive protein,CRP)、低白蛋白血症、年龄、体质量等因素均能影响VCZ-Cmin,但这并不能解释全部Cmin的变异[4-7]。研究报道[8-9],感染或炎症刺激可改变CYP同工酶的活性及表达水平,本课题组前期研究发现[10],VCZ-Cmin和CRP、降钙素原(procalcitonin,PCT)和白细胞介素-6(interleukin-6,IL-6)等炎症因子均有一定相关性。IL-6可下调肝和肝外细胞色素CYP酶、药物代谢酶及转运体表达,从而影响底物的药动学[11-12]。目前IL-6对Cmin影响的研究鲜有报道[9],因此,本课题采用大样本前瞻性研究,确证IL-6及其因CYP2C19基因多态性对VCZ-Cmin的影响,以期为患者精准用药提供依据,保证用药更加安全有效。
1 资料与方法
1.1临床资料
1.1.1研究对象 本研究为前瞻性研究,入选2018年8月—2022年2月郑州大学附属郑州中心医院住院收治的侵袭性肺真菌感染患者237例,经该院伦理委员会批准同意,所有受试者或家属均自愿签署知情同意书。入选标准:①符合侵袭性肺部真菌感染诊断标准[13-14];②采用VCZ治疗≥14 d;③每例患者至少抽取一个稳态谷浓度血样。排除标准:①对VCZ过敏或不耐受者;②使用VCZ期间合并使用其他抗真菌药物者;③血样抽取不合格者(没达稳态血样或非谷浓度血样等);④肝功能受损者[VCZ治疗前丙氨酸氨基转移酶(alanine aminotransferase,ALT)或天冬氨酸氨基转移酶(aspartate aminotransferase,AST)>3倍正常参考值上限或总胆红素(total bilirubin,T-BiL)>2倍正常参考值上限];⑤肾功能中或重度损伤;⑥妊娠或哺乳期妇女;⑦合并使用肝药酶诱导剂或抑制剂;⑧临床资料不完整者。
1.1.2试剂及药品 血液基因组DNA提取试剂盒(QIAGEN公司);人类CYP2C19基因扩增试剂盒(武汉友芝友公司,批号:18071303,19041202,20100905,21031802,21091305);IL-6检测试剂盒[罗氏诊断产品(上海)有限公司,批号:496515,540226,620928];注射用VCZ(辉瑞制药有限公司,每支200 mg,注册证号:H20150168,批号:Z547301,Z562101,Z579501,Z591201)。
1.1.3仪器 Agilent 1260型高效液相色谱仪(美国安捷伦公司);Applied Biosystems®7500 fast DX 实时荧光定量聚合酶链反应(PCR)仪(美国Thermo公司);Roche cobas®6000化学发光仪(瑞士罗氏公司)。
1.2方法
1.2.1患者给药方案及分组 按照说明书用药:负荷剂量(第1个24 h),静脉滴注VCZ 6 mg·kg-1,q12 h;维持剂量(开始用药24 h后),静脉滴注VCZ 4 mg·kg-1,q12 h。医师根据患者实际情况,静脉滴注VCZ 4 mg·kg-1,q12 h。根据首次稳态Cmin测得值,将患者划分为亚治疗范围组(<0.5 mg·L-1),治疗范围组(0.5~<5.0 mg·L-1),超治疗范围组(≥ 5.0 mg·L-1)。此后,再根据Cmin、不良反应及临床疗效,并按文献[15]进行剂量调整。
1.2.2CYP2C19基因分型检测 对所有入选患者进行CYP2C19基因分型,分为超快代谢型(ultra metabolism,UM,*17/*17、*1/*17)、快代谢型(extensive metabo-lism,EM,*1/*1)、中间代谢型(intermediated metabolism,IM,*1/*2、*1/*3、*2/*17、*3/*17)和慢代谢型(poor metabolism,PM,*2/*2、*2/*3、*3/*3)。试验采用RT-PCR在本院转化医学中心进行,实验室经室内和室间评价合格。以DNA提取试剂盒提取DNA,CYP2C19基因分型检测试剂盒进行CYP2C19*2(681G>A),CYP2C19*3(636G>A),CYP2C19*17(806C>T,3402C>T)突变位点检测,严格按照试剂盒说明书操作。
1.2.3VCZ-Cmin的测定 抽取所有患者给药前30 min的外周静脉血1~2 mL(采用负荷剂量给药,则至少用药3 d,无负荷剂量给药,则至少用药5 d),置于无添加剂的真空采血管中,采用反相高效液相色谱法进行检测。每例患者的第一份Cmin血样均为调整剂量前采集的首次稳态血样[10]。
1.2.4IL-6检测 血常规和IL-6与Cmin采血的时间间隔≤24 h。抽取外周静脉血3 mL,离心取上清液,于-20 ℃保存。采用IL-6检测试剂盒,电化学发光法测定,严格按照说明书操作。
1.2.5患者临床资料收集 从我院医院信息系统和对患者随访来录取患者资料:姓名、性别、年龄、体质量、身高、VCZ使用疗程。血常规、尿常规、CRP、ALT、AST、碱性磷酸酶(alkaline phosphatase,ALP)、谷氨酰转肽酶(γ-glutamyl transpeptadase,GGT)、白蛋白(albumin,ALB)、血尿素氮(blood urea nitrogen,BUN)、血小板(platelet,PLT)、血肌酐(serum creatinine,Scr)、胸部CT、半乳甘露聚糖试验和1,3-β-D葡聚糖试验结果等。
2 结果
2.1患者入选及研究流程 按入排标准,最终剔除患者10例,入选227例,其中4例患者用药不足15 d,出现死亡,病例失访,最终按223例患者进行试验,男143例,女80例,年龄19~98岁,平均年龄(73.11±15.82)岁。其中曲霉菌感染198例,念珠菌6例,合并曲霉菌和念珠菌19例。见图1。

图1 研究流程图
2.2CYP2C19基因表型分类 223例患者中UM型7例(*1/*17者7例),EM型96例(*1/*1者96例),IM型95例(*1/*2者84例,*1/*3者9例,*2/*17者1例,*3/*17者1例),PM型25例(*2/*2者20例,*3/*3者2例,*2/*3者3例)。CYP2C19*2位点分布进行检验,符合基因遗传定律,见表1。
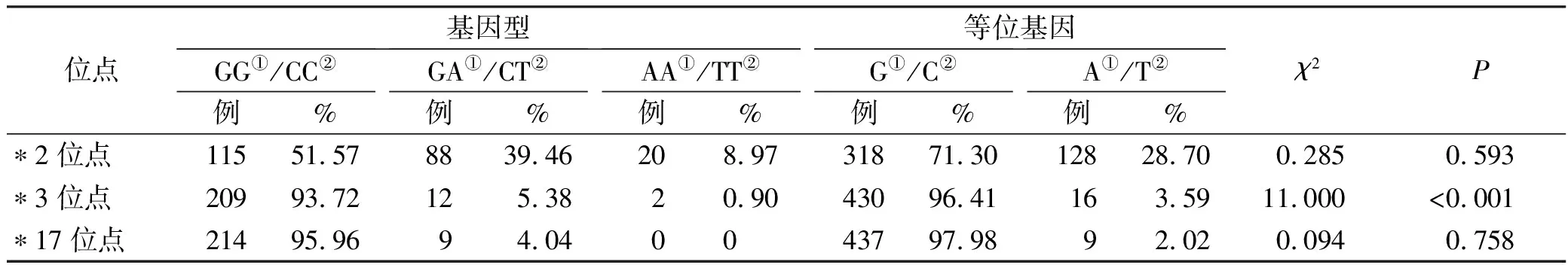
表1 CYP2C19基因型分布
2.3不同Cmin范围组别间一般临床资料的比较 223例患者共获得279份血样(其中35例患者中4例测定4次、13例测定3次和18例测定2次),均选取首次VCZ-Cmin223个数据进行比较,结果,亚治疗范围组、治疗范围组和超治疗范围组分组在性别、年龄、体质量、白蛋白水平、实验室指标、合并用药和基础疾病等一般临床资料上,均差异无统计学意义(均P>0.05),具有可比性,见表2。
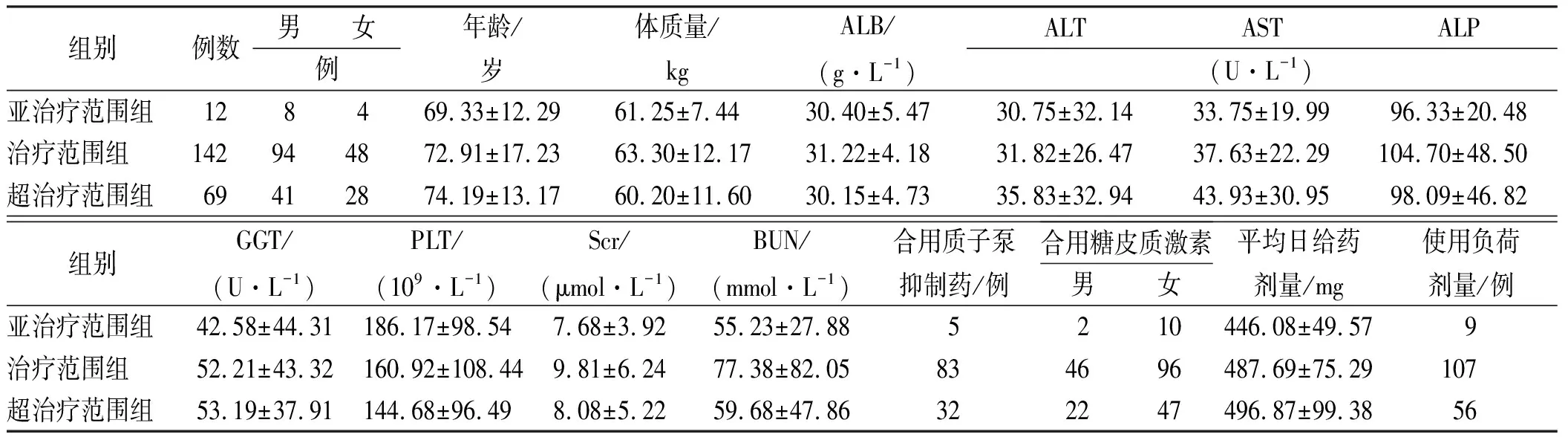
表2 3组患者一般临床资料比较
2.4IL-6水平与VCZ-Cmin的相关性 将IL-6与VCZ-Cmin分别取Log10对数进行Pearson’s相关分析,结果IL-6水平与VCZ-Cmin呈良好的正相关性(n=223,r=0.520,P<0.001),见图2。
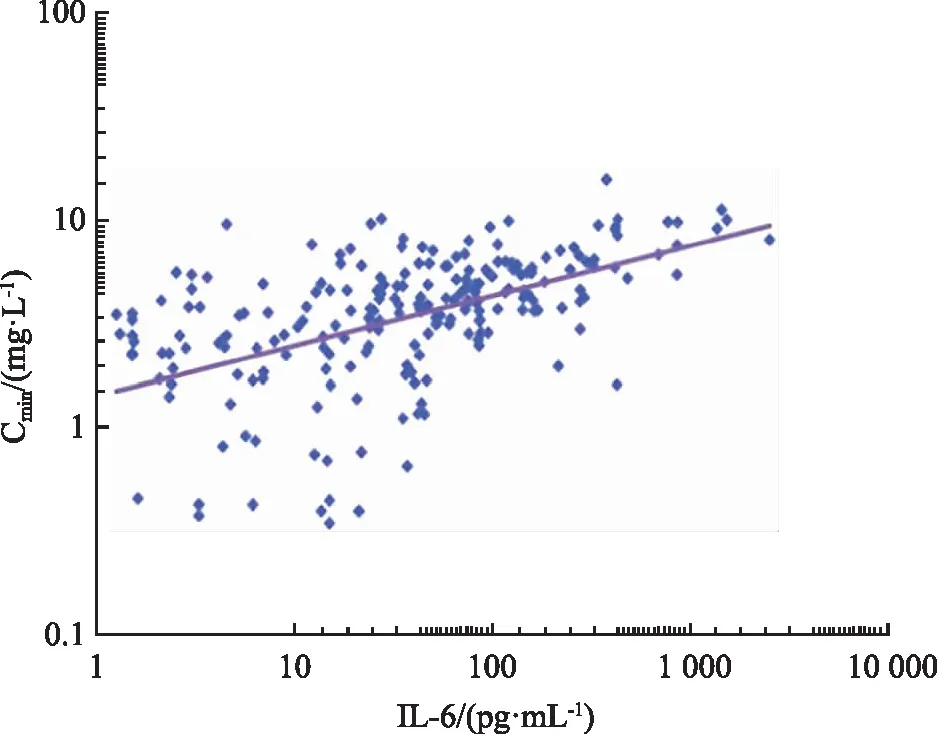
图2 IL-6和VCZ-Cmin的相关性
2.5VCZ-Cmin随IL-6水平在同一患者体内的变异性 223例患者中有35例患者住院期间多次同时进行VCZ-Cmin和IL-6水平检测,患者在各次测定前后,均无剂量调整,结果VCZ-Cmin在各患者体内不同时间点高度变异,且其中27例患者(27/35,77.14%)VCZ-Cmin的变化趋势和IL-6水平的变化趋势基本一致。
2.6不同VCZ-Cmin范围内IL-6水平的差异 将223份首次VCZ-Cmin对应的IL-6进行分组比较,结果IL-6水平在亚治疗范围、治疗范围和超治疗范围组均差异有统计学意义{6.10 pg·mL-1[3.26,14.90],n=12vs.26.60 pg·mL-1[6.92,64.53],n=142vs.120.00 pg·mL-1[45.75,331.75],n=69,χ2=57.799,P< 0.001}。IL-6的中位值随VCZ-Cmin的升高而逐渐升高,见图3。
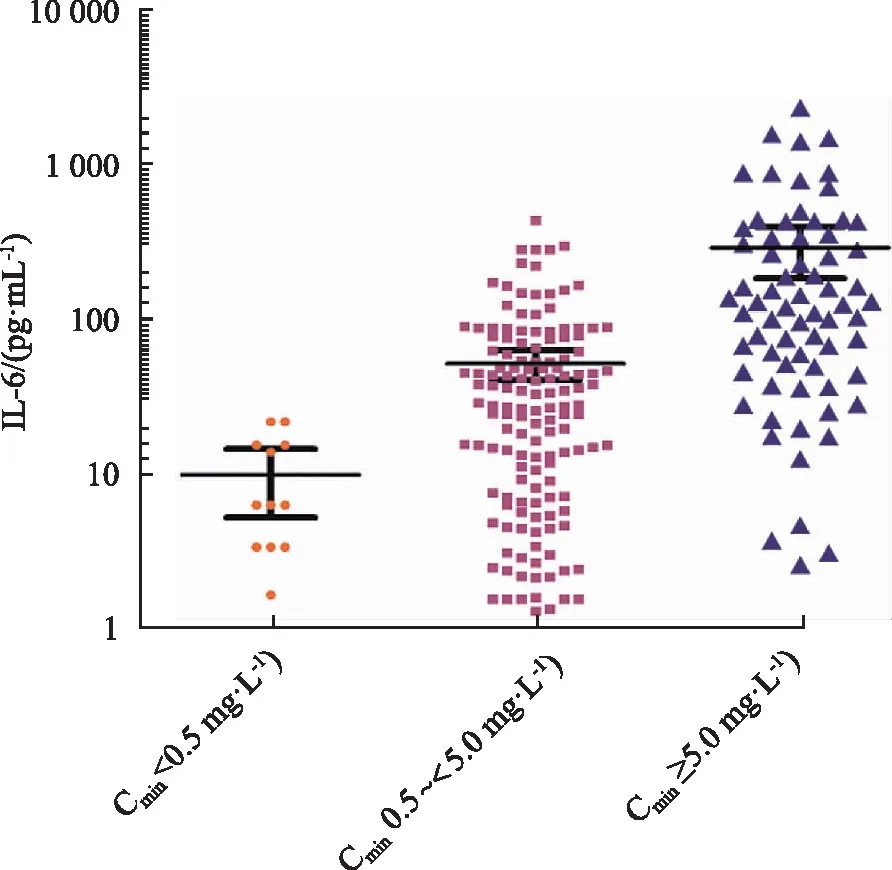
图3 不同VCZ-Cmin范围内IL-6水平的比较
2.7IL-6预测VCZ-Cmin≥5.0 mg·L-1的ROC曲线 IL-6预测VCZ-Cmin≥ 5.0 mg·L-1的 ROC曲线血药浓度-时间曲线下面积和截断值分别是(0.801±0.033)[95%CI=(0.736,0.865),P<0.001],47.30 pg·mL-1,敏感度和特异度分别为75.4%和72.1%,见图4。
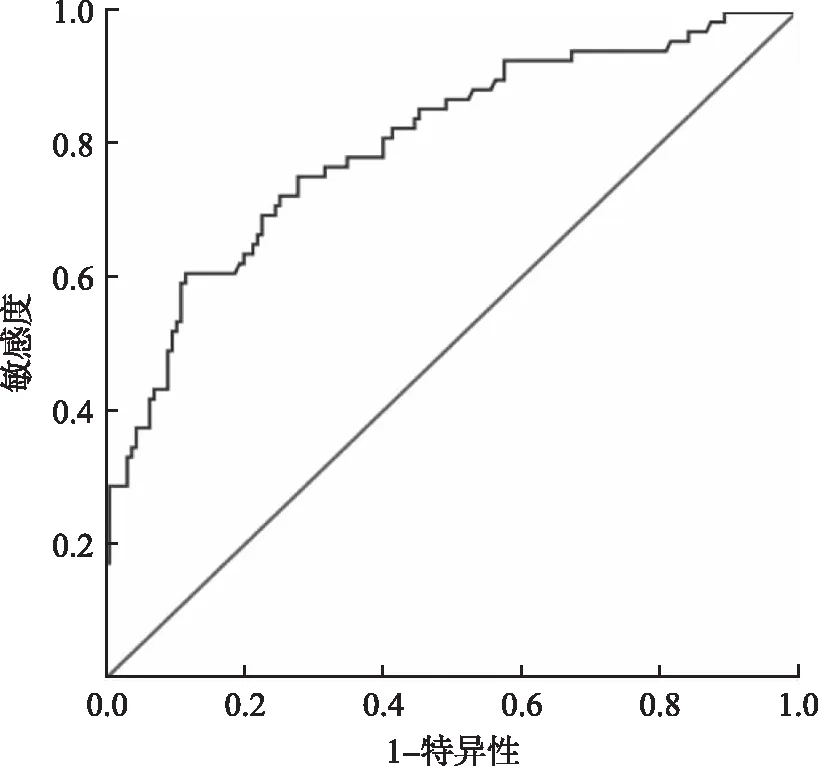
图4 IL-6水平预测VCZ-Cmin≥5.0 mg·L-1的ROC曲线
2.8不同IL-6分层范围平均VCZ-Cmin的差异 根据“2.7节”下的截断值,对IL-6进行分层,比较IL-6不同分层间平均VCZ-Cmin的差异,VCZ-Cmin在3组间差异有统计学意义(3.12 mg·L-1[1.85,4.58],n=147vs.4.66 mg·L-1[3.68,5.86],n=41vs.6.25 mg·L-1[4.50,9.13],n=35,χ2=50.435,P< 0.001)。VCZ-Cmin的中位值随着IL-6的升高而逐渐升高,见图5。
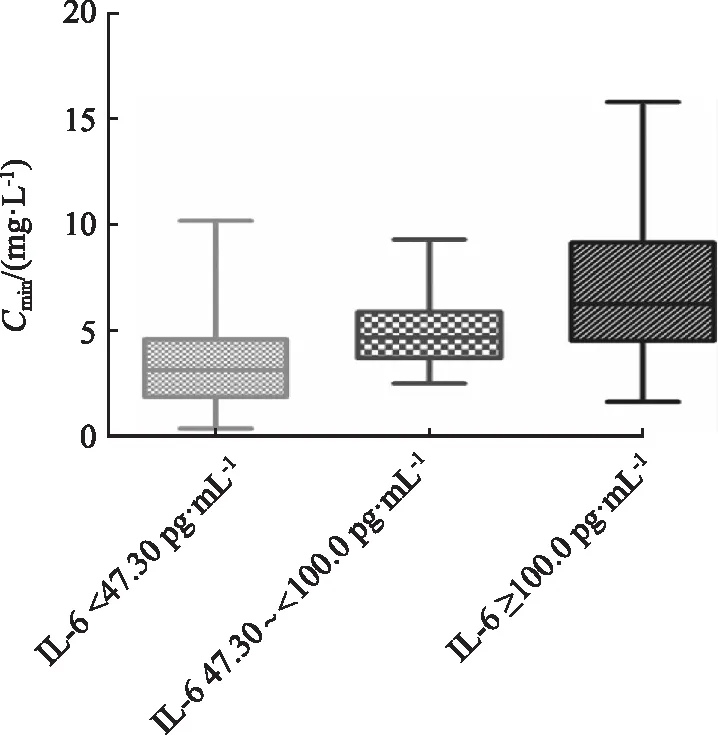
图5 不同IL-6范围内平均VCZ-Cmin水平的比较
2.9不同IL-6分层范围达到VCZ-Cmin范围比率的差异及风险评估 在不同IL-6分层范围间(IL-6<47.30 pg·mL-1、47.30 pg·mL-1≤IL-6<100 pg·mL-1和IL-6 ≥100 pg·mL-1),VCZ-Cmin达到0.5~5.0 mg·L-1治疗范围的比例(74.15%vs.58.54%vs.25.71%,χ2=29.247,P<0.001)和≥ 0.5 mg·L-1范围的比例(17.69%vs.41.46%vs.74.29%,χ2=44.983,P<0.001)均差异有统计学意义。IL-6≥100 pg·mL-1和47.30 pg·mL-1≤IL-6< 100 pg·mL-1范围发生VCZ-Cmin≥5.0 mg·L-1的风险分别是IL-6<47.30 pg·mL-1的13.444倍[95%CI=(5.642,32.039)]和3.296倍[95%CI=(1.554,6.993)]。
2.10各CYP2C19基因表型下IL-6水平对VCZ-Cmin的影响 在CYP2C19 UM+EM和IM型患者中,不同IL-6分层范围间平均VCZ-Cmin差异有统计学意义(F=7.532,P=0.001;F=26.536,P<0.001);而在PM型患者中,不同IL-6分层范围间平均VCZ-Cmin差异无统计学意义(χ2=5.130,P=0.077)。CYP2C19各基因表型下,IL-6对VCZ-Cmin的影响程度不同,即IL-6对UM+EM和IM患者人群的VCZ-Cmin影响较大(P<0.01),而对PM型患者的VCZ-Cmin影响较小(P>0.05)。且在CYP2C19 PM型患者中,不同的IL-6分层组别间,两两比较发现,平均VCZ-Cmin差异无统计学意义(P>0.05),见图6。
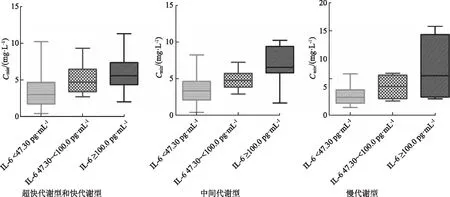
图6 不同CYP2C19基因表型和IL-6水平患者中VCZ-Cmin水平
3 讨论
在VCZ临床用药实践中,严重炎症下调药物代谢酶的活性以影响VCZ的浓度,也用于解释一部分VCZ浓度的高度变异。GAUTIER-VEYRET等[16]研究表明,CRP水平反映的炎症状态是法国血液病患者VCZ使用过量的主要危险因素。在年龄≥12岁的人群中,CRP反映的高炎症水平与VCZ的浓度升高相关,而在年龄<12岁的儿童并非如此,指出CRP值有助于指导严重炎症期间患者VCZ治疗药物监测。
患者重症感染期间,过量释放细胞因子,出现炎症反应,外周血IL-6水平已被用于重症感染疾病的炎症指标,可影响肝细胞功能,进而对VCZ-Cmin产生一定的影响。本研究进一步明确促炎因子IL-6水平与VCZ-Cmin的关系及对不同患者及同一患者体内VCZ-Cmin的影响,阐明IL-6在不同CYP2C19基因表型下对VCZ浓度的影响程度,可帮助临床医师在IL-6变化较大期间,频繁监测Cmin,及时调整用药剂量,以免因Cmin升高产生不良反应。研究中排除了患者在使用剂量、严重肝、肾功能受损、合并肝药酶诱导剂和抑制剂及ALB水平对Cmin的影响。本研究监测223例患者初始Cmin研究数据显示,IL-6水平与VCZ-Cmin相关性良好。且77.14%患者多次同时监测Cmin和IL-6水平变化趋势基本一致,说明在患者用药剂量不变的情况下,IL-6可影响VCZ-Cmin值。IL-6在VCZ亚治疗范围、治疗范围和超治疗范围均差异有统计学意义(P<0.001),IL-6的中位值随着VCZ-Cmin的升高而逐渐升高。这与先前的炎症因子(CRP、IL-6、IL-8等)与VCZ浓度的关系相一致[9,16]。本研究选取患者来自于呼吸重症医学科和血液内科等,患者年龄大,免疫功能低下,合并重症肺炎、急性呼吸窘迫,易引发全身炎症反应综合征等。因此,临床上使用VCZ治疗期间,患者的炎症因子水平波动较大,继而影响VCZ-Cmin。
炎症是一个促成因素,IL-6是一种促炎细胞因子,不仅对免疫细胞,而且对肝细胞也有影响。它首先与IL-6R结合,然后与gp130形成复合物,随后激活信号转导器和转录激活因子3,并导致转录。肝细胞表达丰富的gp130,可以直接和通过反转录信号被激活,这强调了IL-6水平对肝细胞的显著影响。因此IL-6水平导致CYP同工酶在基因转录水平上的下调,引起相应的mRNA、蛋白和酶活性的降低[11-12],被CYP酶代谢的药物减少,以致VCZ的代谢速率下降,VCZ-Cmin升高,当患者炎症消退时,血清浓度也会下降。依据上述的发现,笔者采用了ROC曲线对IL-6水平预测VCZ-Cmin≥5.0 mg·L-1的截断值为47.30 pg·mL-1,并依据该截断值,将IL-6水平进行了分层,取47.30 pg·mL-1作为第一分层点,同时取所有患者IL-6的均值约100 pg·mL-1作为第二分层点,评价得出IL-6水平各分层之间VCZ-Cmin差异有统计学意义(P<0.001),进一步证实了IL-6水平对VCZ-Cmin的影响,且IL-6≥100 pg·mL-1和47.30 pg·mL-1≤ IL-6<100 pg·mL-1范围发生VCZ-Cmin≥5.0 mg·L-1的风险分别是IL-6<47.30 pg·mL-1的13.444倍和3.296倍。因此建议在VCZ治疗期间,临床医师应在患者发生严重炎症前后,频繁监测VCZ-Cmin,以通过调整剂量将VCZ-Cmin保持在治疗范围内,以免因高炎症导致不良反应[17]。
本研究提示IL-6水平升高可造成VCZ-Cmin的升高,这种变化趋势是否受到CYP同工酶基因多态性的影响呢?评估考虑患者炎症状态是否有助于VCZ的TDM监测以维持一致性,这将有助于临床实践中进一步指导TDM以及患者的用药调整。
CYP2C19基因型在VCZ的代谢中起着重要作用,如与广泛代谢物比较,CYP2C19基因型代谢不良者的血清VCZ-Cmin明显高于前者,而超快速代谢者的血清VCZ-Cmin较低[18]。本研究223例汉族人群CYP2C19基因型*2、*3和*17携带率与以往研究一致。CYP2C19*2位点分布符合基因遗传定律。根据已有的文献显示,*17突变的UM型对VCZ影响较小,且中国人群中*2和*3的突变达97%,*17突变频率很低,因此,本研究将UM+EM合并在一起与IM组和PM组比较,结果,在CYP2C19 UM+EM型和IM型患者中,不同IL-6分层范围间平均VCZ-Cmin均差异有统计学意义,PM型患者对应的炎症对VCZ-Cmin水平影响较小,即对VCZ代谢的抑制作用不如UM+NM型及IM型患者那么明显。这与以往的研究[17]相一致,不同基因型的炎症对VCZ的代谢和VCZ-Cmin的影响可能不同。炎症对VCZ的暴露的影响可能取决于CYP基因型,炎症对VCZ代谢的抑制作用对基础代谢能力降低的患者(遗传评分<2)相比基础代谢能力升高的患者(遗传评分>2)可能不那么重要[19]。研究表明[20-21],炎症同时影响CYP3A4和CYP2C19的代谢型,IL-6和其他上游促炎细胞因子下调CYP2C19和CYP3A4基因表达。因炎症可能通过降低酶的活性来迅速抑制VCZ的代谢,最终导致VCZ-Cmin的增加和药物过量暴露的风险[22-23],引起VCZ相关的不良反应[24-25]。
综上所述,CYP2C19和IL-6水平均会对VCZ-Cmin产生显著影响,尤其是对于临床IL-6水平波动较大的患者,在应用VCZ过程中,应特别注意避免炎症相关的VCZ-Cmin水平升高造成不良反应,在重症炎症前后密切监测VCZ-Cmin,使其维持在有效治疗范围内。本研究也存在一些局限性,如未进行CYP3A4和CYP2C9基因检测,未对患者的治疗效果进行统计分析,今后将采取前瞻性大样本研究,进一步证实IL-6影响VCZ血药浓度程度及在不同CYP2C19代谢表型间的差异,深入探索影响VCZ-Cmin的未知因素。

