药物流行病学在临床药物评价中的应用
李旭晗,冼静怡,杨燕,李慧杰,范正悦,宋晶,杨佳,宗晓郁,吕旋瑞,王萌萌,柴栋,3,宫建
(1.沈阳药科大学药物流行病与临床药物评价课题组,沈阳 110016;2.武汉大学中南医院中南医学期刊社,武汉 430072;3.北京瑞达康泽医药科技有限公司临床研究部,北京 100176)
药物流行病学是运用流行病学原理和方法,研究药物在人群中的利用及效应,优化药品、疫苗的效益-风险比的一门科学和艺术[1-2]。其内容涉及发现药品不良反应、对比药物疗效、提高药物资源的配置和改进处方决策等方面。目前我国药学信息系统发展迅速,拥有坚实的信息学基础,为评价患者用药有效性、安全性、经济性提供了基石,也推动了药物流行病学在临床药物评价中的应用。本文将从临床用药评价有效性、安全性、经济性和临床决策4个方面入手,对药物流行病学在临床药物评价中的应用进行相应举例及概述。
1 有效性评价
1.1随机对照试验(randomized controlled trial,RCT) RCT一般适用于比较两组或多组用药方案之间的疗效差异,或比较相关药学服务与常规用药教育是否可以提高患者用药依从性及疗效等情况。其要求试验项目具有明确的研究目的、研究对象、测量结局和样本量,需随机分组,设立对照组,并要求应用盲法以及质量控制。RCT一般可得到一种干预与多种结局的关系,并且具有检验假设能力强、减少混杂偏倚、使组间具有可比性等优点,但RCT实施难度较大,需消耗大量人力、财力,由于随访时间较长,易出现失访情况;且干预适用范围有限,易影响结果推广;如果安慰药使用不恰当,也会产生伦理学等问题。
例1:一项关于膀胱灌注卡介苗(bacillus calmette-guerin,BCG)预防中高危非肌层浸润性膀胱癌(non-muscle- invasive bladder cancer,NMIBC)术后复发的研究中,使用RCT方法对比了BCG灌注与表柔比星灌注后的复发情况。531例患者以2:2:1比例随机分配接受BCG灌注15次(1组)、BCG灌注19次(2组)或表柔比星灌注18次(对照组)。通过对3组患者膀胱灌注后复发情况进行分析,结果显示,1组、2组及对照组的无复发生存率分别为80.0%、88.3%和73.3%,其中2组优于1组及对照组(P=0.028 1;P=0.003 1),而1组与对照组差异无统计学意义(P=0.295 1)。比较3组的累计无复发生存率,1组与2组间差异无统计学意义[95%CI=(0.80,2.43),P=0.243 3],但1组与2组均优于对照组[95%CI=(0.31,0.92),P=0.026 6;95%CI=(0.20,0.65),P=0.008],说明BCG对于预防中高危NMIBC患者术后复发优于表柔比星,其中BCG灌注19次的预防效果更为确切[3]。
1.2真实世界研究(real world studies,RWS) RWS是对临床常规产生的真实世界数据进行系统性收集并进行分析的研究[4]。其数据来源于电子健康档案记录数据、药品和疾病登记表数据、医疗理赔单/账单数据、医院药物警戒系统数据等[5-6]。RWS主要包括病例回顾研究、临床注册研究、观察性研究、监测数据研究、横断面研究等。在RWS中,受试者通常知晓干预,故不存在无效治疗,且该方法可获取样本量较大,统计效能较高,同时可对有临床意义的结局指标进行评价。但由于无法保证数据的准确性及相关性,并且各数据库收集、记录标准不一,以及混杂偏倚较多、异质性较高、暴露隐私风险较高等情况存在,故具有一定的局限性。
例2:在一项紫龙金片治疗老年非小细胞肺癌(non small cell lung cancer,NSCLC)疗效的研究中,共纳入患者205例,其中紫龙金片组99例,非紫龙金片组106例。两组患者的人口学、治疗、症状等数据均通过面访、电话等方式,并结合医院电子病例系统进行采集。对其进行分析后,结果显示,紫龙金片组1年生存率显著优于非紫龙金片组(67.7%vs.44.3%,P<0.05),且生存时间较非紫龙金片组长(10.37个月vs.8.88个月,P<0.05),提示紫金龙片可以有效提高老年NSCLC患者的治疗效果[7]。
1.3系统评价及Meta分析 系统评价及Meta分析是将多个相似研究结果进行定量综合分析的一种方法。若对药物安全性、有效性存在质疑且缺乏大样本研究,即可使用系统评价及Meta分析方法增强其统计学效能。其具体步骤为提出问题-制定研究计划-检索文献-选择文献-评价文献质量-提取纳入文献的信息-分析资料-研究结果报告-更新系统评价[8]。系统评价/Meta分析的优点[8-9]包括:①对同一主题多项研究结果间的一致性进行评价及分析;②为指南提供证据;③可寻找需进一步解决的问题;④从方法学角度评价主题的研究设计;⑤发现单项研究没有阐述的问题;⑥扩大样本量,增加统计效能;⑦增强结果客观可靠性;⑧证据使用方便。但该方法只是某种混合效应,故具有不能解释最终合并效应量的局限性。
例3:如一项血清降钙素原(procalcitonin,PCT)在慢性阻塞性肺疾病急性加重患者治疗的价值研究中,共纳入RCT试验6项、患者1 096例进行系统评价及Meta分析。其中,治疗组以PCT水平为抗菌药物使用依据,而对照组则以常规经验或指南为抗菌药物使用依据。结果显示,治疗组抗菌药物处方率较对照组降低27%,提示血清PCT在慢性阻塞性肺疾病急性加重患者抗菌药物使用过程中具有重要意义[10]。
2 安全性评价
2.1药品不良反应(adverse drug reaction,ADR)报告与监测 ADR报告与监测是ADR发现、报告、评价和控制的过程。上市后药品通过报告ADR并收集ADR数据,发现临床研究阶段尚未发现的不良反应,进而控制药品安全风险,保障群众用药安全[11]。ADR监测方法主要包括自愿报告系统、医院集中监测系统、处方事件监测等[12]。通过ADR监测后,需对其进行相应评价。ADR评价可分为两步:个例评价和集中评价。个例评价是运用ADR评价准则,对每份报表进行评价。而集中评价是将同类型报表积聚到一定数量,在个例分析基础上,利用计算机系统进行统计分析、评价,将ADR表现和怀疑药品组成配对检索,发掘ADR信号。
例4:一项研究对10 830例马来酸桂哌齐特注射液ADR自发呈报数据进行了分析,发现桂哌齐特相关ADR表现主要累及神经系统、皮肤及其附件、消化系统、血液系统等;ADR好转或痊愈比例较高,提示桂哌齐特相关ADR表现严重程度多属轻微,绝大部分预后良好。同时,结果也表明白细胞减少和中性粒细胞减少仍然是其特征ADR,其严重变态反应同样也不容忽视[13]。
2.2ADR信号挖掘与主动监测 数据挖掘技术广泛应用于ADR信号挖掘与主动监测中,其方法众多,包括聚类分析、主成分分析、贝叶斯法、决策树法等。ADR主动监测主要面向非固定人群,对已批准上市药品进行监测,跟踪其安全信号,并对药品风险效益进行评价,其整个过程不对治疗进行干预,因此具有计划性、连续性的监测特征。同时该方法简单易行、监测范围广、可及时得到反馈信息。但仍需注意数据抓取不全[14]、阳性预测值低、灵敏度低、投入高等局限性。
例5:一项对肿瘤坏死因子抑制剂(tumor necrosis factor inhibitor,TNFis)相关吉兰-巴雷综合征(Guillain-Barre syndrome,GBS)的风险信号挖掘中,收集了TNFis相关GBS不良事件报告病例330例,结果显示,在美国食品药品管理局不良事件报告系统数据库中,5种TNFs均有GBS报告,其中阿达木单抗报告数量最多(130例),其次为依那西普(110例)及英夫利昔单抗(76例)。经报告比值比法分析后,英夫利昔单抗单抗及阿达木单抗产生了GBS风险信号,其中英夫利西单抗信号最强,并可能存在药品之间的差别[15]。
2.3ADR分析性研究
2.3.1病例对照研究 病例对照研究为观察性研究,是一种可由果推因,但不能由因到果的方法,故不可施加干预,仅可收集研究对象既往暴露情况,同时需设置可比性对照组,为病例组的暴露比例提供参比。其要求具有明确的研究目的与类型、研究因素、研究对象,需估计样本量并进行资料收集。该方法比较适用于罕见、潜伏期长、原因不明的疾病研究,以及多种暴露因素和一种疾病相关的研究;同时也适用于研究小样本试验对象,相较于其他研究较节省经费及时间。但该方法不适用于研究人群中暴露比例较低的因素,且易发生偏倚,很难确定暴露和疾病先后顺序,也不能直接计算暴露组和非暴露组发病率。
例6:一项抗菌药物不良反应的病例对照研究中,以住院期间接受抗菌药物治疗后发生ADR的患者为病例组(n=124),并以1:2比例配以对照组(n=248),对照组的患者均与病例组年龄相差≤5岁,且为同期(≤15 d)、同诊断、接受抗菌药物治疗并未发生ADR的患者。通过获取电子病例系统中患者临床信息,并对其进行多因素条件Logistic回归发现,当存在药物过敏史[P=0.000,OR=3.314,95%CI=(2.683,3.812)]、联合使用抗菌药物[P=0.000,OR=2.734,95%CI=(1.925,3.108)]、给药方式为静脉滴注[P=0.005,OR=1.326,95%CI=(1.145,1.892)]和使用喹诺酮类药物[P=0.010,OR=1.399,95%CI=(1.004,1.527)]因素时,更易发生ADR[16]。
2.3.2队列研究 队列研究与病例对照研究一样,同为观察性研究,但队列研究在时间上具有前瞻性,可由因到果,研究对象也需按有无暴露因素进行分组[17]。其要求具有明确的研究因素、研究结局、研究现场及人群,并需进行样本量估计、资料收集与随访。队列研究的优点主要包括:①暴露资料可靠性高;②可获得发病/死亡率;③因果顺序明确,偏倚少,检验病因假说能力强;④能了解疾病自然史;⑤可分析一种暴露和多种疾病间关系。其缺点则包括:①耗费人/物/财力及时间;②不适用于发病率低的疾病研究;③由于随访时间长,易发生失访偏倚;④易引入已知变量或人群变化。
例7:一项前瞻性队列研究分析了母亲孕期及儿童1岁以内抗菌药物暴露与儿童过敏性疾病的相关性。共1 558对母子被纳入该研究中,在收集相关人口学信息及生命早期抗菌药物暴露情况等资料后,采用单因素及多因素二分类非条件Logistic回归模型进行分析。其中,在调整儿童性别及体质量、父母过敏史、孕期二手烟接触史等影响因素后,结果显示,儿童在3~5个月龄[RR=1.61,95%CI=(1.19,2.17)]及6~11个月龄[RR=1.43,95%CI=(1.06,1.93)]使用抗菌药物,是6~11个月龄儿童过敏性疾病发生的危险因素;而0~2个月龄[RR=1.41,95%CI=( 1.03,1.95)]、3~5个月龄[RR=1.54,95%CI=(1.12,2.11)]、6~11个月龄[RR=1.58,95%CI=(1.17,2.14)]使用抗菌药物是18~23个月龄儿童过敏性疾病发生的危险因素[18]。
3 经济性评价
3.1药物利用与药物利用评价(drug utilization evaluation,DUE) DUE是在药品治疗过程中,对药品选用、给药途径、剂量、药品配伍等问题是否合理、正确作出的评估,是一种基于证据的质量改进方法,旨在提高药物使用质量、安全性和成本效益[19-20]。其不仅以药物使用评估为手段,还对药品应用过程中药品用量、消耗费用等来作比较和评估。
例8:某研究为探讨辽宁省两城市神经内科下呼吸道感染住院患者的抗菌药物利用情况,对抗菌药物使用相关信息进行了提取,并计算其用药频率、药物利用指数(drug utilization index,DUI)。结果显示,使用例次前3位的类别分别是头孢菌素类(65.34%)、β-内酰胺酶抑制剂及与β-内酰胺类抗菌药物配伍的复方制剂(10.39%)、喹诺酮类(8.34%)。其中,DUI值排列前三依次是头孢哌酮/舒巴坦钠(2.00)、头孢替坦(1.73)、头孢哌酮-他唑巴坦(1.65),而头孢匹罗(0.66)、利福平(0.79)、阿米卡星(0.80)DUI值最低,氨曲南(1.01)、环丙沙星(1.01)、万古霉素(1.02)等抗菌药物DUI值接近1。该研究反映辽宁省两城市神经内科下呼吸道感染住院患者抗菌药物DUI值较为集中,环丙沙星、氨曲南、万古霉素等药物选择基本合理,但仍需注意头孢哌酮/舒巴坦钠、头孢替坦、利福平、阿米卡星等药物的合理性使用问题[21]。
3.2药物经济学研究 随着社会卫生及医疗保健需求的日益增加,各国医疗事业的药物治疗费用负担逐渐加重。为提高药物资源的配置和利用效率,最大程度发挥药物资源效用,以优先药物资源实现健康水平最大化发展,由此衍生出对药物经济学研究。
3.2.1药物经济学评价的方法 药物经济学评价有多种方法,如成本效益分析(cost-benefit analysis,CBA)、成本效果分析(cost-effectiveness analysis,CEA)、成本效用分析(cost-utility analysis,CUA)等。其中,CBA主要通过货币形态对方案的成本和收益进行计量和描述,并对其进行比较。其既可对单一方案经济性进行判定,也可对多种方案经济性进行比较与选优(如例9)。而CEA是评价卫生活动方案的效果成本,确定每个方案的可行性,在比较中选择最佳方案。其既可比较不同药物对同一疾病的治疗效益,也可进行不同疾病治疗措施间的比较,甚至疾病治疗与其他公共投资项目的比较,适用于全面的卫生及公共投资决策(如例10)。CUA则是将各卫生活动方案的成本与效用联系起来考虑的分析方法,在兼顾患者用药意愿及生活质量基础上,比较不同医疗方法的经济合理性(如例11)。
例9:一项研究以2019年中国新生儿为研究对象,以当前中国单价RV疫苗(cRV1)自费接种策略为对照,对美国5价RV疫苗(RV5)、英国单价RV疫苗(eRV1)、cRV1纳入国家免疫规划的成本效益进行了评估。结果显示,当前cRV1自费接种策略对轮状病毒胃肠炎的疾病经济负担为976 226.9万元,接种成本为102 674.2万元。若将RV5、eRV1和cRV1纳入国家免疫规划后,可使经济负担相应降低68.0%、56.4%和21.4%,但接种成本会相应增加13.83倍、12.22倍、9.02倍,效益成本比分别为0.47、0.44和0.23。说明3种疫苗纳入国家免疫规划未节约社会成本,需降低疫苗价格后才具有成本效益[22]。
例10:一项关于环磷酰胺、他克莫司、环孢素、吗替麦考酚酯治疗特发性膜性肾病(idiopathic membranous nephropathy,IMN)的研究中,对4种药物治疗IMN建立决策树模型,进行了成本-效果分析。结果显示,吗替麦考酚酯增量CEA为-6 826.15元,具有绝对劣势,而环孢素相比于环磷酰胺的增量成本效果比为59 380元,他克莫司相比于环孢素增量成本效果比为242 100元。提示在治疗IMN时,环磷酰胺及环孢素更具有经济性,而他克莫司经济性相对较弱。同时也可根据不同意愿支付金额,选择最优方案。如当意愿支付金额<59 380元时,可最优选择环磷酰胺;而当意愿支付金额为59 380~242 100元时,可最优选择环孢素;当>242 100元时则可最优选择他克莫司,这为IMN治疗提供了经济性的用药方案。
例11:在一项对德谷胰岛素治疗2型糖尿病患者的经济性研究中,以甘精胰岛素为参照药物,质量调整生命年(quality-adjusted life years,QALY)为健康产出指标,降糖治疗成本、疾病管理和并发症治疗成本为成本范畴,对其进行了CUA分析。结果显示,与甘精胰岛素U100比较,使用德谷胰岛素使得患者增加0.060 QALY,直接医疗成本增加158元,增量成本效果比为2 639元/QALY,低于我国2021年1倍国内生产总值(gross domestic product,GDP)。而与甘精胰岛素U300比较,德谷胰岛素使得患者增加0.085 QALY,且直接医疗成本降低1 402元。提示对于我国2型糖尿病患者,使用德谷胰岛素相比于使用甘精胰岛素U100及甘精胰岛素U300更具有经济性[24]。
3.2.2药物经济学评价中的模型技术 药物经济学模型包含多种变种和混合,共4种主要类型:决策树模型、马尔可夫模型、离散事件模拟/逆向诱导模型和蒙特卡罗模型。其中,最通用的是决策树模型。所有相关结果、成本和健康状态都可被图形化建模为一个初始健康状态或医疗干预决策的序列分支。通过将成本、效用、健康状态或其他结果测量值分配给所有潜在路径上的每个节点和成本,然后得到每个路径的概率,估算预期总成本。决策树模型优点为直观、通用、灵活,易用图形描述临床路径;缺点为信息需求随决策树分支的数量和深度呈指数级增长,比较适合短期分析。
例12:在一项关于阿托西班治疗自发性早产的研究中,模拟了1 000例孕28~34周自发性早产入院的人群。共分为两组,接受阿托西班和糖皮质激素治疗组(药物治疗组)及卧床休息和使用糖皮质激素治疗组(非药物治疗组)。使用决策树模型对人群进行分支,分支点分别为是否使用阿托西班药物治疗、是否保胎成功48 h以上进行糖皮质激素治疗、是否进入儿童重症监护中心、新生儿是否存活、新生儿是否发生脑瘫不良结局。决策树模型见图1。模型参数均来源于文献、医院调查、物价局等。结果显示,药物治疗组的增量成本效果比为70 497.23元/QALY,低于2014年3倍人均GDP,成本效益比为0.67,故每投入1元产生的效益低于1元。提示阿托西班治疗自发性早产具有一定的成本效果,同时适当降低阿托西班治疗费用后,可提高其成本效益,减轻患者负担[25]。
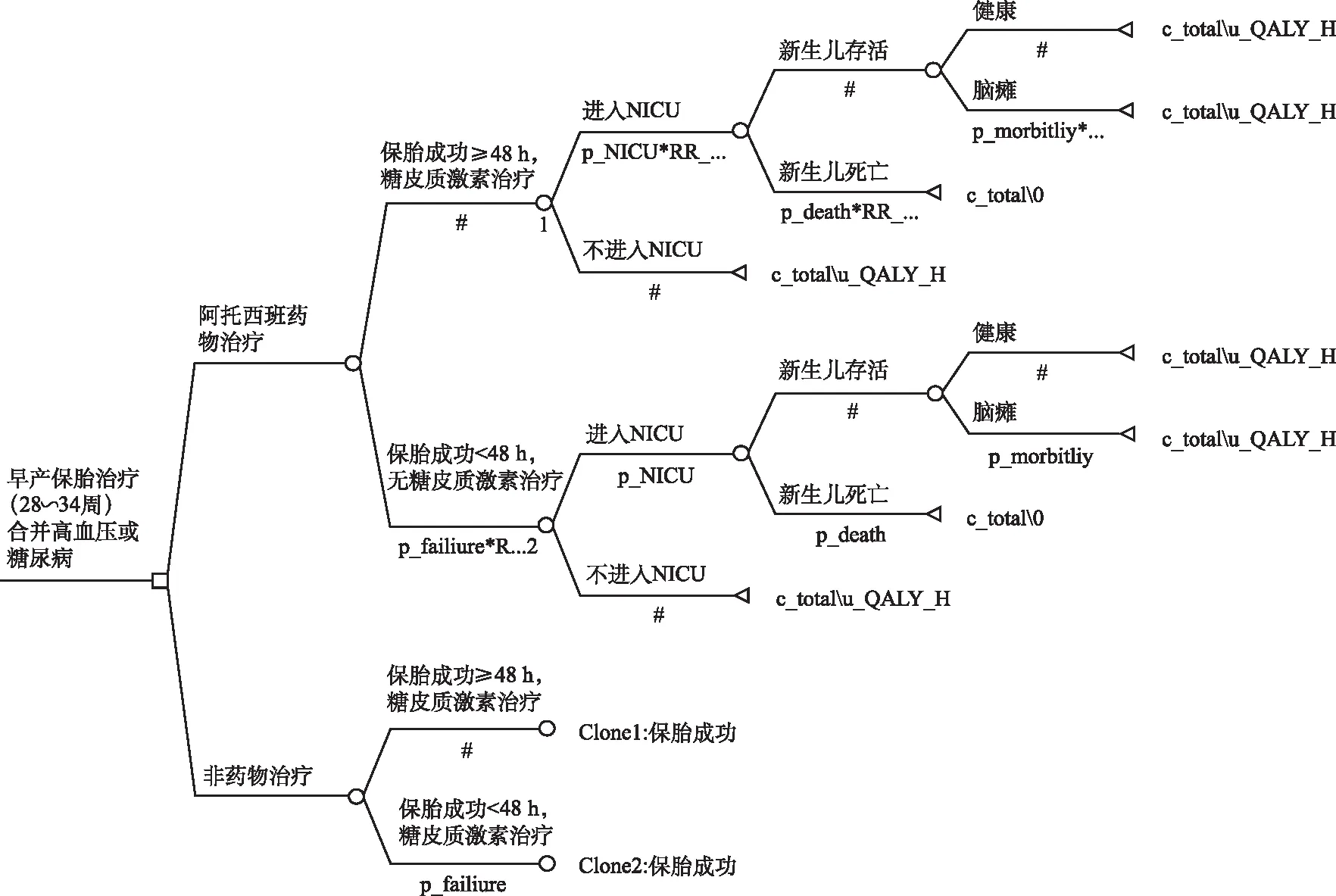
图1 阿托西班治疗自发性早产的药物经济学研究决策树模型
马尔可夫模型是通过固定长度的时间周期明确得到事件时间的一种模型。患者在每个周期中处于一组离散的健康状态,在每个周期后,患者有可能转换到其他健康状态或保持当前状态。由于健康状态转移概率仅依赖于患者当前周期中的健康状态,因此马尔可夫模型完全由周期长度和健康状态转移概率来描述。这种模型对于每个时间区间的成本和结果计算简单,参数不确定性和灵敏度分析易纳入,但状态转变的概率随时间而固定。
例13:在一项关于他汀类药物干预措施预防心血管病效果的研究中,使用马尔可夫模型对我国发达地区人群心血管病一级预防效果进行了评估。研究人群为225 811例未患心血管病的40~79岁人群。其中,基于风险评估的他汀类药物干预的策略主要包括不采取基于风险评估的他汀类药物干预的常规策略(策略0)、采用2019年世界卫生组织心血管病风险评估简易模型(无实验室指标)进行风险分层并对高危人群实施他汀类药物干预策略(策略1)、采用世界卫生组织心血管病风险评估复杂模型(含实验室指标)进行风险分层并对高危人群实施他汀类药物干预策略(策略2)、采用中国动脉粥样硬化性心血管病风险预测研究(prediction for atherosclerotic cardiovascular disease risk in China,China-PAR)风险评估模型进行风险分层,并对高危人群进行他汀类药物干预策略(策略3)。研究人群中,中危人群采用生活方式干预,高危人群在中危人群干预方式基础上实施他汀类药物干预,研究期限设定10年,模型循环周期设定1年,模拟10个周期并计算心血管事件发生例数及每预防1例心血管病事件或死亡的需干预人数(number need to treat,NNT)等信息。参数参考研究人群数据源、公开发表的中国人群研究数据、Meta分析等。他汀类药物干预策略的马尔可夫模型见图2。分析显示,与策略0比较,采用策略1、策略2、策略3可分别预防3 482例[95%UI=(2 110,4 661)]、3 685例[95%UI(2 255,4 912)]、3 895例[95%UI=(2 396,5 181)]心血管病事件数。策略1、策略2和策略3每预防1例心血管病事件,使用他汀类药物的NNT分别为22例[95%UI=(14,54)]、21例[95%UI=(14,52)]和27例[95%UI=(17,67)]。说明世界卫生组织模型在预防1例心血管病事件的NNT方面更具有优势,而China-PAR模型策略可预防更多心血管病事件,获得更多健康收益[26]。
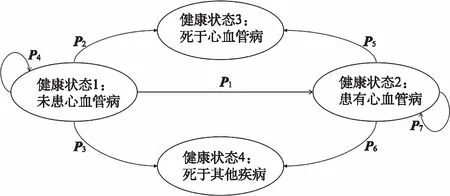
P1:从未患心血管病状态到患有心血管病状态的概率;P2:从未患心血管病状态到死于心血管病状态的概率;P3:从未患心血管病状态到死于其他疾病状态的概率;P4:未患心血管病存活状态的概率;P5:从患有心血管病状态到死于心血管病状态的概率;P6:从患有心血管病状态到死于其他疾病状态的概率;P7:患有心血管病存活状态的概率。
4 临床决策
卫生技术评估(health technology assessment,HTA)是对使用医疗卫生技术在一定时间内对社会产生的效果进行系统研究的综合政策研究方法,其采用多学科方法对卫生技术进行系统评价,并为决策提供信息。其评估内容主要包括医疗卫生技术的安全性和有效性、医疗卫生技术的成本和效益及其对社会的影响。该方法可降低卫生总费用和资源合理配置,是链接卫生决策与科学研究不可或缺的纽带。
在进行HTA时,首先需确定优先评估项目及评估问题,对评估目的和评估结果的潜在使用者进行了解,明确评估负责人;其次进行资料收集和质量评价,相关人员对资料收集范围、时间、费用、质量等应进行详细计划,并从中得出可靠结果。为保证结果能得到客观合理应用,评估人在评估报告中应详细说明所用资料来源,并提供资料有效性和科学性的评价结果。因卫生技术产品的信息具有时效性,应对评估结果进行广泛及时宣传,最后监督评估结果的影响。
HTA为临床医务工作者和决策层提供了科学信息和决策依据,对卫生科学技术的研究、使用、推广和淘汰等进行了政策干预,以合理配置卫生资源,提升卫生资源的使用质量与效益。卫生科技的正确使用能通过防治、诊断和治愈疾病、改善生命品质从而对社会经济产生正面影响,但错误的应用也会带来社会安全和卫生问题、增加患者负担、造成资源浪费或恶化医患关系。
例14:一项关于泊沙康唑预防血液恶性肿瘤患者侵袭性真菌感染(invasive fungal infections,IFIs)的快速HTA研究中,以泊沙康唑干预为治疗组,以使用其他抗真菌药物为对照组,对各HTA网站及数据库进行了检索。最终共纳入文献34篇,并对其结果进行综合分析。其中,有效性评价结果显示,泊沙康唑可减少血液恶性肿瘤患者IFIs发生率,显著优于氟康唑和伊曲康唑。安全性评价结果显示,泊沙康唑与其他真菌药物比较,ADR发生率无显著差异。在经济性评价结果中,多数研究均显示在意愿支付阈值内泊沙康唑更具成本-效果优势,提示泊沙康唑预防血液恶性肿瘤患者IFIs具有较好的有效性、安全性和经济性[27]。
5 分析与总结
5.1药物流行病学贯穿于临床研究与药物评价的各方面 在查明病因过程中,流行病学研究方法发挥了很大作用。药物流行病学者以药物有效性、安全性、实用性为研究目标,二次研究(Meta分析、系统综述、经济型分析等),观察性研究(横断面研究、病例对照研究、队列研究等)及实验研究作为研究内容,贯穿于临床研究与药物评价各方面。
5.2现阶段主要存在的问题 药物流行病学发展中有许多困难,如经费问题,需从人群收集大量信息资料以推动研究继续进行,对计算机硬件和数据库、管理维护的要求较高,需大量资金投入等。另外,药物流行病学的发展与社会医疗卫生保健制度的发展不可分割。药物流行病学的调查研究中需了解很多情况,如药品销售及ADR相关信息等。因此还需建立更可靠的卫生制度,完善相关立法,加强医务人员培训,提高工作人员综合素质。
5.3掌握方法学知识,提升临床研究的质量与水平 药物流行病学目前仍处于起步阶段,缺乏相关经验,相关人员需掌握方法学知识,提升临床研究质量和水平。首先,开展研究项目第一步是指定研究计划,并在实施期间按要求进一步修改或更新。科研问题阐述必须建立在研究资料基础上,而科研方案设计也应围绕科研问题。其次,研究方案实施时,要遵从伦理要求保护患者隐私,涉及人体受试者的研究应获得机构内伦理审查委员会、独立伦理审查委员会或其他相关机构批准。此外,为确保结果的科学有效性,应事先制定研究质量控制标准和措施。最后,研究者有义务发布有科学意义或公共卫生意义的研究结果,通过发表科学文献或以报告等方式及时向学界同行告知研究结果,遵循有关法律要求,及时报告ADR。
致谢:感谢沈阳药科大学药物流行病与临床药物评价课题组张灵健、孟彤、沈智文、贾敏、王俊彦、张兴会、陈明珠、王树月在本文立题、修改过程中的支持与帮助!

