不同产地显齿蛇葡萄以及近缘种指纹图谱的建立及有效成分分析
凌伟红,陈 燕,冯 淼,王超纯,龚慧敏,田春莲, , 4*
不同产地显齿蛇葡萄以及近缘种指纹图谱的建立及有效成分分析
凌伟红1,陈 燕2,冯 淼1,王超纯1,龚慧敏3,田春莲1, 3, 4*
1. 吉首大学 林产化工工程湖南省重点实验室,湖南 张家界 427000 2. 张家界市永定区农业农村局,湖南 张家界 427000 3. 吉首大学生物资源与环境科学学院,湖南 吉首 416000 4. 杜仲综合利用技术国家地方联合工程实验室,湖南 吉首 416000
建立显齿蛇葡萄以及近缘种的高效液相色谱(HPLC)指纹图谱,并对有效成分进行定量分析。使用Ultimate XB-C18(250 mm×4.6 mm,5 μm)色谱柱;流动相为乙腈-0.01%磷酸,检测波长为280、360 nm,体积流量为1 mL/min,进样量20 μL,柱温30 ℃下梯度洗脱,建立显齿蛇葡萄以及近缘种HPLC指纹图谱,结合相似度评价、层次聚类分析(clustering analysis,CA)、主成分分析(principal component analysis,PCA)与正交偏最小二乘法-判别分析(orthogonal partial least squares method-discriminant analysis,OPLS-DA)等化学模式识别方法,评价不同产地显齿蛇葡萄及近缘种的质量。建立的HPLC指纹图谱方法符合方法学要求,18批显齿蛇葡萄属样品指纹图谱有31个共有峰,经对照品定性指认4、9、11、14、15和24号峰对应的化合物分别为没食子酸、儿茶素、二氢杨梅素、芦丁、杨梅苷和杨梅素,且相似度>0.8;所有样品按产地经CA分为2类,PCA结果与其一致;OPLS-DA筛选出不同产地显齿蛇葡萄及近缘种的13~14个差异标志物,以二氢杨梅素和杨梅素为主要差异标志物。建立的指纹图谱方法稳定、可靠、重复性好,结合化学模式识别可用于作为藤茶原料的蛇葡萄属植物的质量评价。
藤茶;显齿蛇葡萄;HPLC指纹图谱;化学模式识别;正交偏最小二乘法-判别分析;没食子酸;儿茶素;二氢杨梅素;芦丁;杨梅苷;杨梅素
藤茶是由葡萄科(Vitaceae)蛇葡萄属L. 植物的嫩茎叶加工而成,又称莓茶、甜茶藤、龙须茶和甘露茶[1]。藤茶是我国南方地方习用类茶,常用于治疗口腔溃疡、咽喉肿痛、感冒发热、湿热黄疸、目赤肿痛和痈肿疮疖等症状[2]。藤茶的化学成分、保健属性和功能特性已受到学者的广泛关注,有望成为预防与高脂肪饮食有关的代谢性疾病的辅助饮食[3-4]。显齿蛇葡萄(Hand.-Mazz.) W. T. Wang为主要藤茶加工原料,富含黄酮类、甾体类、萜类、多酚等有效成分,其中黄酮类成分抗病毒、抗菌、抗炎、调节免疫等功效显著[5]。显齿蛇葡萄分布区域广,主产于湖南、湖北、广东、广西、云南等地[6],产地环境及生长条件造成有效成分差异较大。目前,地方标准仅以二氢杨梅素含量作为质量控制的考察指标,无法完整反映显齿蛇葡萄内在品质和产地质量差异,限制了显齿蛇葡萄叶作为新资源食品的应用。因此,建立一种整体、全面的藤茶植物质量控制方法尤为重要。
化学识别模式结合指纹图谱可将指纹图谱中的有效信息提取,以获得完整的质量信息,在中药材鉴别的作用日益凸显[7-8]。目前,藤茶HPLC指纹图谱研究多为方法学考察,应用聚类分析(clustering analysis,CA)、主成分分析(principal component analysis,PCA)对显齿蛇葡萄分类描述[4, 9-12],吴佳等[13]首次采用CA、PCA结合正交偏最小二乘法-判别分析(orthogonal partial least squares method - discriminant analysis,OPLS-DA)筛选其普叶和龙须的7个差异性成分。藤茶原料植物为显齿蛇葡萄,但同属植物广东蛇葡萄与羽叶蛇葡萄也为加工原料[14],导致藤茶产品同名异物。因此,为有效甄别藤茶及其易混品,从材料源头控制藤茶品质,本研究采用HPLC双波长切换法,建立藤茶植物定量指纹图谱,结合相似度评价、CA、PCA、OPLS-DA等化学识别模式,鉴别各地用于加工藤茶的3种蛇葡萄属植物并筛选差异标志物,以期为藤茶质量控制、标准制订提供参考。
1 仪器与试剂
1.1 仪器
Agilent 1260高效液相色谱仪(美国安捷伦科技有限公司);FA1004型万分之一电子天平(上海舜宇恒平仪器有限公司);EX125DZH型奥豪十万分之一电子天平(上海析平科学仪器有限公司);DSA300-GL1型超声波清洗仪(福州德森精工有限公司)。
1.2 试药
对照品儿茶素(批号200829)、芦丁(批号RP190213)购自成都麦德省科技有限公司;没食子酸(批号202011-201215)、杨梅苷(批号202012-201218)购自中原植提标准品实验耗材中心;二氢杨梅素(批号20190610)购自中国生物制品检定所;杨梅素(批号L1623059)购自上海麦克林生化科技有限公司,质量分数均>98%。乙腈为色谱纯,磷酸等其余试剂均为分析纯,水为娃哈哈纯净水。
1.3 样品
20批次样品于2021年5月下旬~6月初采自湖南、湖北、广西、云南4省18个产地(表1),经吉首大学廖儒博研究员鉴定S1~S18为显齿蛇葡萄(Hand. -Mazz.) W. T. Wang,S19为羽叶蛇葡萄(Lévl. et Vant.) Rehd.,S20为广东蛇葡萄(Hook. et Arn.)Planch的4年生植物。取长5~7 cm的嫩茎叶50 ℃烘干,分别粉碎,过40目筛备用。
2 方法与结果
2.1 对照品溶液的制备
精密称取二氢杨梅素、杨梅素、杨梅苷、没食子酸、儿茶素、芦丁适量置入5 mL量瓶中,加入60%的甲醇溶解并定容,摇匀,得140 μg/mL没食子酸、10 406 μg/mL二氢杨梅素、2034 μg/mL杨梅苷 162 μg/mL杨梅素、78 μg/mL儿茶素、126 μg/mL芦丁的照品溶液,按一定梯度稀释,得不同质量浓度的对照品溶液。
表1 样品及来源信息
Table 1 Samples and source information
编号产地品种编号产地品种 S1湖南永定三家馆显齿蛇葡萄S11湖南双牌上梧江显齿蛇葡萄 S2湖南永定温塘显齿蛇葡萄S12湖南桂东四都显齿蛇葡萄 S3湖南永定王家坪显齿蛇葡萄S13湖北来凤绿水显齿蛇葡萄 S4湖南永定沅古坪显齿蛇葡萄S14湖北来凤旧司显齿蛇葡萄 S5湖南永定茅岩河显齿蛇葡萄S15湖北来凤芭蕉溪显齿蛇葡萄 S6湖南永定罗塔坪显齿蛇葡萄S16湖北来凤牛耳坪显齿蛇葡萄 S7湖南永定教字垭显齿蛇葡萄S17云南广南者兔显齿蛇葡萄 S8湖南桑植桥自湾显齿蛇葡萄S18广西西林古障显齿蛇葡萄 S9湖南永顺润雅显齿蛇葡萄S19湖北来凤旧司羽叶蛇葡萄 S10湖南双牌孝层场显齿蛇葡萄S20湖北来凤旧司广东蛇葡萄
2.2 供试品溶液的制备
分别称取0.1 g样品于圆底烧瓶,加入10 mL 60%甲醇溶液后称定质量,超声45 min,冷却至室温,再次称量,加60%甲醇溶液适量补足质量,过0.45 μm滤膜,4 ℃保存,供试品溶液备用[11]。
2.3 色谱条件
采用Ultimate XB-C18(250 mm×4.6 mm,5 μm)色谱柱;流动相为0.01%磷酸水溶液(A)-乙腈(B),梯度洗脱(0~8 min,5%~15% A;8~18 min,15%~24% A;18~25 min,24%~40% A;25~35 min,40%~50% A);检测波长:0~15 min,280 nm;15~35 min,360 nm;体积流量1.0 mL/min;柱温30 ℃;进样量20 μL。
2.4 方法学考察
2.4.1 线性关系考察 将含没食子酸、二氢杨梅素、杨梅苷、杨梅素、儿茶素、芦丁的对照品溶液梯度稀释,得不同质量浓度的对照品溶液,分别按“2.3”项色谱条件进样,将对照品溶液的质量浓度与峰面积线性回归,得回归方程(表2),6种成分的相关系数(2)均大于0.999,各成分在浓度范围内线性关系良好。
表2 线性关系数据
Table 2 Linear relationship data
对照品回归方程线性范围/(μg·mL−1)R2 没食子酸Y=40.196 X-41.2541.40~140.000.999 5 二氢杨梅素Y=2.041 2 X-56.867104.06~10 406.000.999 9 杨梅苷Y=19.843 X+371.9720.34~2 034.000.999 6 杨梅素Y=33.787 X+142.8616.20~162.000.999 4 儿茶素Y=4.740 8 X-1.009 77.80~78.000.999 7 芦丁Y=28.98 X-20.2251.26~126.000.999 8
2.4.2 精密度试验 称取S2样品0.1 g,按“2.2”项方法制备供试品溶液,按“2.3”项色谱条件重复进样6次,记录各共有峰的保留时间及峰面积,并计算RSD。结果保留时间的RSD为0.53%~1.42%,峰面积的RSD为0.78%~1.92%,仪器精密度良好。
2.4.3 稳定性试验 取S2样品0.1 g,按“2.2”项方法制备供试品溶液,分别在0、2、4、8、12、24 h时按“2.3”项色谱条件进样测定,记录各共有峰的保留时间及峰面积,并计算RSD。结果相对保留时间的RSD为0.89%~1.73%,相对峰面积RSD为0.61%~1.62%,表明供试品在24 h内稳定。
2.4.4 重复性试验 称取同一份S2样品0.1 g,共6份,按“2.2”项方法制备成6份供试品溶液,按“2.3”项色谱条件进样,记录各共有峰的保留时间及峰面积。得出保留时间RSD为0.829%~1.26%,相对峰面积的RSD为2.24%~4.41%,表明方法重复性良好。
2.4.5 加样回收率试验 称取5份S2样品0.1 g,按“2.2”项方法制备样品液,取500 μL样品溶液按比例(1∶1)加入相应的对照品溶液,按“2.3”项方法测定,记录峰面积,并计算各成分的加样回收率及RSD。没食子酸、儿茶素、二氢杨梅素、芦丁、杨梅苷、杨梅素的加样回收率结果分别为104.22%、102.73%、101.73%、96.48%、101.25%、98.76%,RSD分别为2.5%、0.6%、2.3%、1.0%、0.5%、1.5%,表明本方法的加样回收率良好。
2.5 指纹图谱的建立和相似度评价
取20批样品供试液20 μL按“2.3”项下色谱条件进样,记录色谱图。将S1~S18的色谱图导入《中药色谱指纹图谱相似度评价系统》(2012A版),以S1图谱为参照匹配共有峰,时间窗宽度设为0.2 min,生成叠加图谱,采用中位数法生成对照指纹图谱[15]。再将对照、S19、S20的图谱导入,并评价相似度。图1和图2分别为对照指纹图谱及HPLC指纹图谱,标定出31个共有峰,通过与混合对照品出峰时间相匹配,确认峰4为没食子酸、峰9为儿茶素、峰11为二氢杨梅素、峰14为芦丁、峰15为杨梅苷、峰24为杨梅素。峰11保留时间(16.161 min)居中、峰面积大且分离度良好,作为参照峰计算出样品共有峰相对保留时间RSD<0.86%,说明样品共有峰出峰时间稳定;但共有峰相对峰面积RSD为21.47%~117.93%,相差较大,表明S1~S20共有化合物的含量差异较大。样品与对照指纹图谱相似度(表3)分别为S1~S16(0.943~0.998),S17、S18(0.869、0.868),S19、S20(0.319、0.389),表明湖南和湖北产显齿蛇葡萄化学成分种类相似度极高,而广西、云南产显齿蛇葡萄与前2个产地有差异,不同种蛇葡萄属植物化学成分种类差异大。
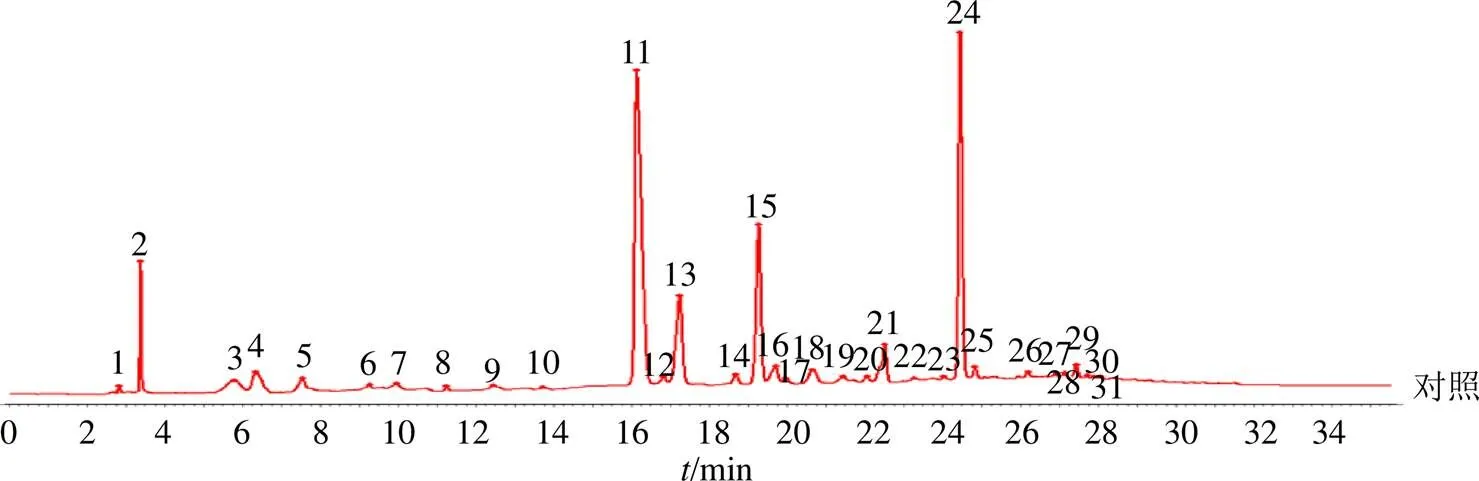
4-没食子酸 9-儿茶素 11-二氢杨梅素 14-芦丁 15-杨梅苷 24-杨梅素
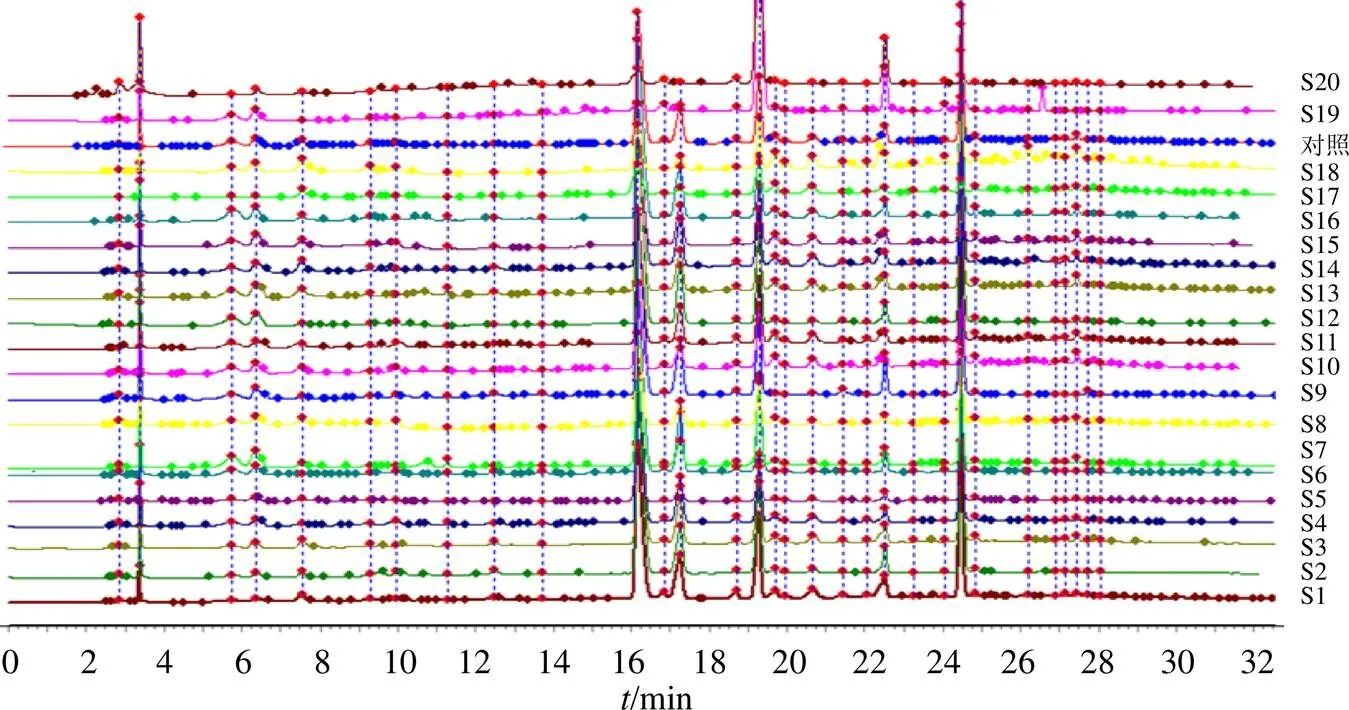
图2 20批次样品HPLC指纹图谱叠加图
表3 20批样品与对照图谱的相似度结果
Table 3 Similarity results of fingerprints of 20 batches of raw material plants and reference atlas samples
编号相似度编号相似度编号相似度编号相似度 S10.996S60.970S110.993S160.994 S20.966S70.943S120.984S170.869 S30.998S80.987S130.995S180.868 S40.986S90.994S140.992S190.319 S50.995 S100.975S150.993S200.389
2.6 化学模式识别研究
2.6.1 聚类分析(cluster analysis analysis,CA)以地域及种类将样品分组,然后以31个共有峰相对峰面积为变量,运用微生信在线绘图(http://www.bioinformatics.com.cn),采用组间均联法,选择平方Euclideam距离为测度进行系统聚类,绘制聚类热图[16]。热图颜色代表归一化后的值,颜色越红说明共有峰相对峰面积越大,颜色越蓝表示共有峰相对峰面积越小。如图3所示,除S18外,其他样品被分为2类,S20、S19、S7、S12、S9、S6聚为第I类,其他聚为第II类,每类又分2小类,第Ⅰ类S19、S20单独聚成1小类,显示显齿蛇葡萄与广东蛇葡萄、羽叶蛇葡萄差异较大,第Ⅱ类中S13、S14、S16聚为1小类,说明湖北产显齿蛇葡萄与其他产地不同。同时,热图显示广西显齿蛇葡萄未知峰17、6、26、23的相对峰面积比其他样品高,S19、S20的15号峰杨梅苷相对峰面积高于S1~S18,S20未知峰1、2、21相对峰面积高于S1~S18。聚类分析表明,不同产地来源的显齿蛇葡萄质量与地理差异存在一定相关性,不同种的蛇葡萄属植物化学成分差异较大。
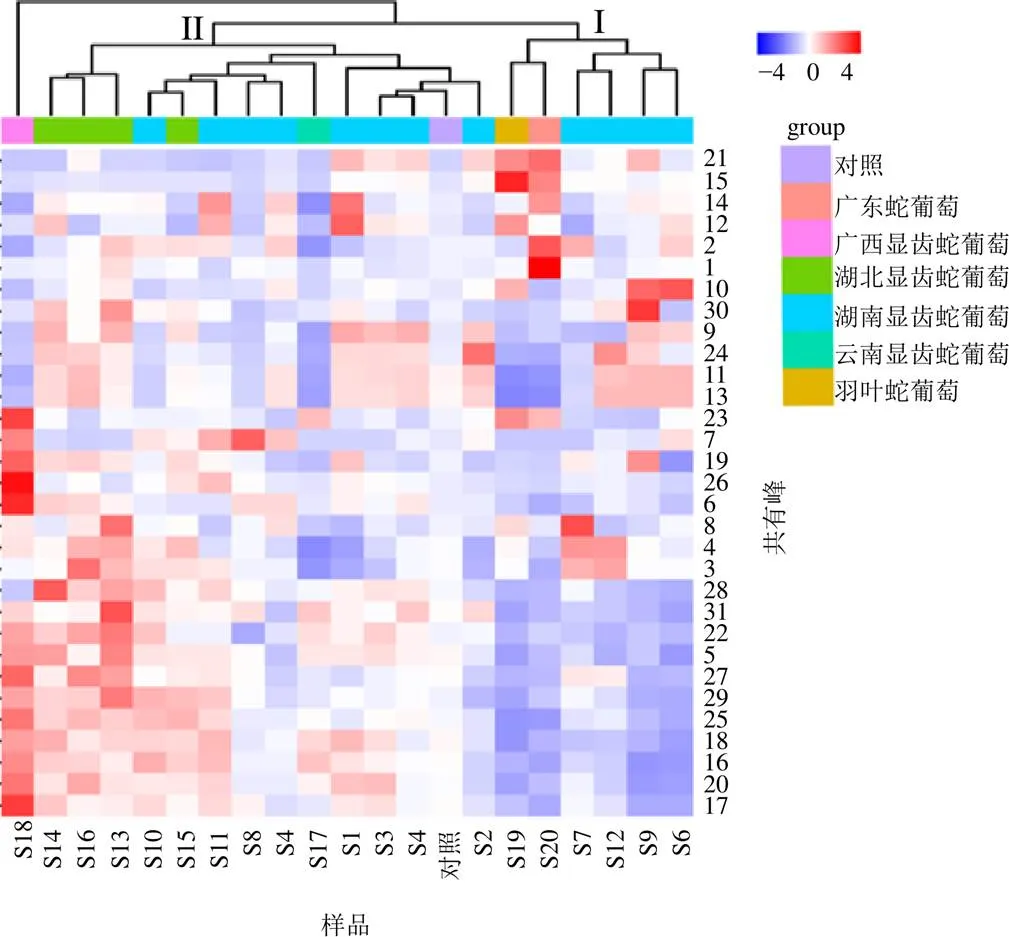
图3 不同显齿蛇葡萄样品聚类热图
2.6.2 主成分分析(principal component analysis,PCA)采用SPSS 22.0系统标准化处理31个共有峰峰面积,对S1~S20指纹图谱所得的6个共有峰PCA,见表4,以特征值>1为标准,提取8个主成分(1~8),累积方差贡献率90.41%(>80%),可代表所有样品指纹图谱共有峰的绝大多数信息。主成分载荷矩阵反映了各变量对主成分的贡献大小及方向,载荷值越大,对主成分的贡献越大[17],由图4可知,峰29、18、20、25对主成分1贡献较大,峰11、13、23、24对主成分2贡献较大,除峰23对第2主成分呈负相关外,其他均呈正相关。依各主成分贡献率,按公式计算综合得分值(F)。
表4 特征值和方差贡献率
Table 4 Characteristic value and variance contribution rate
主成分特征值方差比/%累积贡献率/% 111.305 9636.4736.47 2 5.102 7216.4652.93 3 3.103 2410.0162.94 4 2.911 98 9.3972.34 5 2.185 28 7.0579.38 6 1.446 59 4.6784.05 7 1.063 90 3.4387.48 8 1.005 05 3.2490.41

图4 公共因子得分和载荷散点图
F=0.364 7 F1+0.164 6 F2+0.100 1 F3+0.093 9 F4+0.070 5 F5+0.046 7 F6+0.034 3 F7+0.032 4 F8
由表5所知,综合排名前3为S13、S16、S18,最小是S19。PCA与聚类分析结果基本一致。
2.6.3 正交偏最小二乘法-判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)以指纹图谱31个共有峰为变量系数,参照文献方法[14]将31个共有峰峰面积导入SIMAC 14.1软件进行OPLS-DA,并绘制散点得分图(图5)。S13~S16分布在中线右侧,S19、S20在图的左下角,其结果与PCA结果一致。为寻找藤茶植物的差异标志物,结合OPLS-DA模型中变量重要性投影值(variable importance forthe projection,VIP值)分析,以VIP>1.0为阈值,从不同地域显齿蛇葡萄筛选出14个差异标志物(图6-A),影响程度为峰7>峰28>峰24(杨梅素)>峰26>峰17>峰29>峰9(儿茶素)>峰11(二氢杨梅素)>峰31>峰13>峰22>峰5>峰16>峰23。图6-B显示近缘植物羽叶蛇葡萄、广东蛇葡萄、显齿蛇葡萄有13个差异标志物,影响程度为峰18>峰17>峰29>峰1>峰13>峰31>峰11(二氢杨梅素)>峰10>峰27>峰24(杨梅素)>峰5>峰6>峰28。差异标志物数量见表6,显齿蛇葡萄12~17个,3种蛇葡萄属植物11~13个,为进一步确认差异标志物,通过计算各共有峰峰面积占总共有峰峰面积的占比以及各共有峰峰面积的RSD值,可知杨梅素(峰24)与二氢杨梅素(峰11)占共有峰峰面积比率大且RSD值偏高,说明二氢杨梅素和杨梅素是影响显齿蛇葡萄产地差异的主要因素,也是区别其他藤茶原料的主要指标。
表5 主成分得分和综合排名
Table 5 Principal component score and comprehensive score
编号主成分得分排名 F1F2F3F4F5F6F7F8F S13 1.156 0.952 1.234 2.046−0.275−1.119 0.332−0.957 0.803 1 S16 0.866 0.975 1.063 0.332 0.509−0.023−0.099 1.728 0.701 2 S18 2.370−1.988−0.104−1.155 2.313−0.220 1.104 0.033 0.610 3 S14 0.909 0.955−0.752 0.870−0.056−0.172−0.924−0.326 0.441 4 S15 0.602 0.158 0.790−0.081−0.364 0.254 0.427−0.412 0.304 5 S10 0.706−0.349 0.318 0.534−0.902 0.603−0.867−0.464 0.202 6 S11 0.596−0.187−0.683 0.106−0.100 2.287−1.260−0.556 0.167 7 S7−0.305−0.287 2.459 0.165−0.328−0.050−0.460 0.096 0.065 8 S5−0.008 0.603−0.577 0.015−0.361−0.344 0.284 1.242 0.048 9 S1 0.093 0.587−2.406 0.931 0.955 0.444−0.585 0.045 0.04710 S3 0.199 0.452−1.030 0.177−0.302−0.828 0.005 0.845 0.02811 S12−0.505 0.827 0.861−1.304 0.576 0.387−0.466 1.546 0.00912 对照 0.030−0.001 0.091−0.329−0.686−0.044−0.095−0.043−0.06613 S4−0.455 0.154−0.132−0.498−0.415 1.479 0.065−0.161−0.16414 S9−1.148 1.545 0.089−0.580 1.809−0.810 0.857−2.609−0.17515 S8 0.111−0.777 0.263−1.311−0.927 0.931 0.663−0.726−0.20716 S2−0.550 0.577−0.851−0.705−0.685−1.006 1.787 1.348−0.24717 S6−1.511 0.587 0.068−1.095−0.142 0.688 0.003−0.450−0.54318 S20−1.696−1.800−0.027 2.449 0.198 0.921 1.995 0.357−0.55119 S17 0.217−1.357−0.862−0.740−2.162−1.914−0.326−0.970−0.58420 S19−1.677−1.626 0.186 0.174 1.345−1.465−2.443 0.432−0.88721

图5 OPLS-DA 得分散点图(A) 和OPLS-DA置换检验图 (B)

图6 S1~S18样品(A)和S19~S20、对照(B)各共有峰的VIP图
表6 不同样品的差异标志物
Table 6 Differential markers of different samples
样品差异代谢物共有峰号总数/个 显齿蛇葡萄(湖南-湖北)27、29、28、4、3、17、31、16、30、5、7、25、18、2014 显齿蛇葡萄(湖南-云南)24、9、13、1、11、23、3、4、31、14、2、2212 显齿蛇葡萄(湖南-广西)26、17、23、27、29、16、7、11、6、20、31、5、10、18、28、24、2517 显齿蛇葡萄(湖北-云南)24、9、1、3、4、13、2、11、8、14、19、2312 显齿蛇葡萄(湖北-广西)26、7、28、23、11、24、9、10、13、17、2、6、14、3014 显齿蛇葡萄(云南-广西)26、7、1、6、4、24、13、19、27、8、9、28、2913 显齿蛇葡萄-羽叶蛇葡萄18、29、13、31、11、27、5、28、22、24、25、15、2013 显齿蛇葡萄-广东蛇葡萄13、17、24、28、11、27、6、25、1、16 、18、31、2613 羽叶蛇葡萄-广东蛇葡萄18、29、1、31、17、10、5、6、2、22、1111
2.7 不同产地显齿蛇葡萄及近缘种植物中酚类成分的测定
取20批样品粉末各适量,按“2.2”项下方法制备供试品溶液,再按“2.3”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品中6种待测成分的含量,平行操作3次,结果见表7。20批样品中6种成分含量热图见图7。二氢杨梅素和杨梅素在显齿蛇葡萄含量较高,但杨梅苷含量最低。就各地区显齿蛇葡萄上述成分含量差异明显,原产地张家界罗塔坪样品中二氢杨梅素含量最高。羽叶蛇葡萄与广东蛇葡萄中杨梅苷含量明显高于显齿蛇葡萄,说明杨梅苷可作为广东蛇葡萄、羽叶蛇葡萄质量评价的主要指标成分。
3 讨论
目前,关于藤茶的质量标准是以二氢杨梅素含量作为藤茶质量判定标准,但中药化学成分复杂多样,有效成分难以一一明确,因此,如何在化学成分不完全明确的前提下对药材进行质量控制十分有必要。而指纹图谱技术与相似度、聚类、主成分分析等化学计量学手段可以用于综合评价中药质量优劣,避免了以单一成分含量来评价药品质量好坏的弊端。多酚类化合物抗氧化、抗病毒、抗心脑血管疾病、抗肿瘤等生物活性显著,类黄酮是多酚类化合物的典型代表,二氢杨梅素、杨梅素、杨梅苷为3种藤茶植物嫩茎叶的主要化学成分[13],儿茶素是诠释茶叶保健功能的主要物质基础,具有抗菌、抗突变、抗癌和保护神经系统等功效[18],儿茶素在藤茶茶多酚中占60%~80%[19],没食子酸是一种富含于藤茶植物中的多酚类化合物,具有抗癌等多种生物活性[20]。因此,选用上述成分作为质量评价的主要指标。本研究基于HPLC指纹图谱技术,得到31个共有峰,指认其中6个共有成分,与已报道的显齿蛇葡萄(藤茶)指纹图谱的文献相比[9,21],本研究得到的共有峰更多,且指认出的成分不仅为黄酮成分,并通过相似度分析初步评价了20批不同样品的相似性。同时,本研究利用PCA和OPLS-DA等化学模式识别分析技术评价了不同藤茶原料植物间的质量差异,初步筛选出了不同产地显齿蛇葡萄及其近缘种的差异性标志物。此外,研究发现羽叶蛇葡萄与广东蛇葡萄中杨梅苷含量明显高于显齿蛇葡萄。因此,该研究可为显齿蛇葡萄、羽叶蛇葡萄与广东蛇葡萄的药材质量标准的建立提供科学依据,并为藤茶植物综合开发提供技术参考。
表7 20批样品6种酚类活性成分含量
Table7 Content of six polyphenol active components in 20 batch of samples
编号二氢杨梅素/%杨梅素/%杨梅苷/%芦丁/%儿茶素/%没食子酸/% S129.014 91.040 71.031 90.824 40.308 50.041 7 S233.137 01.907 91.138 30.340 10.255 40.051 6 S329.971 31.068 01.000 00.371 30.275 90.075 8 S428.204 20.603 60.741 50.584 70.160 00.077 1 S531.027 9 1.117 9 1.133 00.563 6 0.310 8 0.098 8 S635.731 10.579 71.060 10.475 20.237 40.089 4 S714.867 90.425 81.058 20.312 50.072 10.167 0 S814.874 20.361 30.433 60.312 60.085 80.094 9 S935.420 01.120 60.910 30.492 90.264 50.102 4 S1013.894 00.430 70.686 00.466 50.102 80.116 2 S1121.193 50.573 40.681 10.733 80.093 00.079 3 S1233.411 01.627 91.113 20.417 10.058 60.161 8 S1325.795 70.893 50.684 10.460 50.290 90.152 5 S1429.793 71.173 70.662 80.496 50.289 70.104 4 S1523.744 80.627 90.639 50.312 10.225 70.140 3 S1634.809 61.146 90.753 80.456 90.175 10.146 0 S17 6.179 60.049 10.357 00.148 70.026 30.029 5 S18 7.773 40.295 90.513 60.222 20.077 30.116 7 S19 1.313 10.105 54.139 50.407 10.069 80.106 5 S20 3.194 60.050 52.761 00.736 30.101 00.065 6

图7 20批样品6种成分含量热图
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院植物研究所. 中国高等植物图鉴(第二册: 补编) [M]. 北京: 科学出版社, 1983: 246-272.
[2] 张云坤, 李娟, 黄丹, 等. 中药藤茶化学成分及抗感染作用研究进展 [J]. 世界科学技术—中医药现代化, 2021, 23(6): 2012-2022.
[3] Carneiro R C V, Ye L Y, Baek N,. Vine tea (): A review of chemical composition, functional properties, and potential food applications [J]., 2021, 76: 104317.
[4] Zhang Q L, Zhao Y F, Zhang M Y,. Recent advances in research on vine tea, a potential and functional herbal tea with dihydromyricetin and myricetin as major bioactive compounds [J]., 2021, 11(5): 555-563.
[5] 刘畅, 邓薇, 刘小英, 等. 藤茶生物活性成分及其制备工艺研究进展 [J]. 食品工业, 2015, 36(4): 233-237.
[6] 熊皓平, 何国庆, 杨伟丽, 等. 显齿蛇葡萄生化成分分析 [J]. 中国食品学报, 2004, 4(3): 68-71.
[7] You G J, Li H H, Liu Y N,. Comparative analyses ofwith different appearance traits and from different geographical origins using HPLC fingerprints and chemossmetrics [J]., 2020, 83(12): 1443-1451.
[8] Bai J, Yue P, Dong Q,. Identification of geographical origins ofbased on HPLC multi-wavelength fusion profiling combined with average linear quantitative fingerprint method [J]., 2021, 11(1): 5126.
[9] 范莉, 侯小龙, 王文清, 等. 指纹图谱结合一测多评模式在藤茶质量评价中的应用研究 [J]. 中草药, 2016, 47(22): 4076-4081.
[10] 苏素娇, 李娜, 陈亮, 等. 藤茶的HPLC指纹图谱及化学模式识别研究 [J]. 中国实验方剂学杂志, 2013, 19(22): 144-147.
[11] 石依姗. 特色民族药材藤茶质量评价及其袋泡茶工艺研究[D]. 武汉: 华中科技大学, 2020.
[12] 张朝阳, 马世龙, 秦邦, 等. 野生藤茶资源的鉴别及指纹图谱评价 [J]. 山东农业大学学报: 自然科学版, 2022, 53(2): 188-196.
[13] 吴佳, 叶文卉, 卢宗元, 等. 藤茶不同部位指纹图谱及其差异研究 [J]. 天然产物研究与开发, 2020, 32(9): 1507-1514.
[14] 刘翔, 李紫微, 秦松云. 重庆蛇葡萄属药用植物资源研究 [J]. 资源开发与市场, 2007, 23(6): 517-518.
[15] 周冰倩, 高喜梅, 杨颖, 等. 不同来源竹茹药材HPLC指纹图谱和化学计量学分析 [J]. 中草药, 2022, 53(3): 853-857.
[16] 张琳琳, 张文婷, 唐登峰, 等. 基于指纹图谱、多指标含量测定及化学计量学的宁心宝胶囊质量评价 [J]. 中国药学杂志, 2019, 54(17): 1425-1431.
[17] 谢苏梦, 季巧遇, 吕尚, 等. 不同产地野菊花HPLC指纹图谱建立及化学模式识别研究 [J]. 中草药, 2021, 52(24): 7616-7623.
[18] Musial C, Kuban-Jankowska A, Gorska-Ponikowska M. Beneficial properties of green tea catechins [J]., 2020, 21(5): 1744.
[19] 李佳川, 李思颖, 王优, 等. 藤茶化学成分、药理作用及质量标志物(Q-marker)预测分析 [J]. 西南民族大学学报: 自然科学版, 2021, 47(3): 254-266.
[20] Tuli H S, Mistry H, Kaur G,. Gallic acid: A dietary polyphenol that exhibits anti-neoplastic activities by modulating multiple oncogenic targets [J]., 2022, 22(3): 499-514.
[21] 汪秋兰, 王文清, 万青, 等. 基于HPLC-PDA指纹图谱、化学模式识别及多成分定量分析评价藤茶药材的质量 [J]. 中国药师, 2021, 24(8): 558-565.
HPLC fingerprint and chemical pattern recognition offrom different producing areas
LING Wei-hong1, CHEN Yan2, FENG Miao1, WANG Chao-chun1,GONG Hui-min3, TIAN Chun-lian1,3,4
1. Hunan Key Laboratory of Forest Products and Chemical Industry Engineering, Jishou University, Zhangjiajie 427000, China 2. Zhangjiajie Yongding County Agricultural and Rural Bureau, Zhangjiajie427000, China 3. College of Biology and Environmental Sciences, Jishou University, Jishou 416000, China 4. National and Local United Engineering Laboratory of Integrative Utilization Technology of, Jishou University, Jishou 416000, China
To establish the HPLC fingerprint of Xianchi Sheputao () and perform chemical pattern recognition.The gradient elution was carried out on an Ultimate XB-C18column (250 mm × 4.6 mm, 5 μm) with a mobile phase of acetonitrile-0.01% phosphoric acid, detection at 280 nm and 360 nm, a volume flow rate of 1 mL/min, an injection volume of 20 μL and a column temperature of 30 ℃. HPLC fingerprints ofand closely related species was established and a combination of chemical pattern recognition methods such as similarity evaluation, cluster analysis (CA), principal component analysis (PCA) and orthogonal partial least squares-discriminant analysis (OPLS-DA), were used to evaluate the quality ofand closely related species from different producing areas.The HPLC fingerprint method was developed in accordance with the methodological requirements, with 31 common peaks from 18 batches ofThe peaks 4, 9, 11, 14, 15 and 24 were qualitatively identified as gallic acid, catechin, dihydromyricetin, rutin, myricetrin andmyricetin , respectively, and the similarity was more than 0.8. The samples were divided into two categories according to different origins through CA and the results of PCA were consistent with it. Moreover, thirteen to fourteen markers of variation were identified in OPLS-DA, with dihydromyricetin and myricetin as the main markers of variation in the different origins ofand closely related species.The established fingerprint method is stable, reliable and reproducible; Combined with chemical pattern recognition, it can be used for the quality evaluation ofgenus as raw material plant of vine tea.
vine tea;(Hand.-Mazz.) W. T; HPLC fingerprint; chemical pattern recognition; orthogonal partial least squares-discriminant analysis; gallic acid; catechin; dihydromyricetin; rutin; myricetrin; myricetin
R286.2
A
0253 - 2670(2023)17 - 5725 - 09
10.7501/j.issn.0253-2670.2023.17.025
2023-02-03
湖南省科技厅资助项目(2019NK4164);林产化工工程湖南省重点实验室开放基金(LCHG21908)
凌伟红(1997—),女,硕士研究生,从事天然产物研发及药物质量控制研究。Tel: 15580542151 E-mail: 1455426685@qq.com
田春莲,教授,硕士生导师,主要从事中药、民族药质量控制及新药研发工作。E-mail: tianchunlian1970@163.com
[责任编辑 时圣明]

