circ_0001658通过靶向miR-1179调控乳腺癌细胞的增殖细胞周期和凋亡
李 欢, 谢贤鑫, 孙 涛
(辽宁省肿瘤医院乳腺内科, 辽宁 沈阳 110042)
乳腺癌起源于乳腺上皮组织,是世界上最常见的癌症,也是导致女性癌症相关死亡的主要原因[1]。乳腺癌的发生归因于多种风险因素,如DNA损伤和基因改变。尽管在乳腺癌的早期诊断、手术干预、局部和全身辅助治疗上取得了显著进展,但患者预后仍较差。所以,深入揭示该疾病发展的分子机制对寻找新的治疗方法意义重大。环状RNAs(circRNAs)是一类单链环状分子,在真核生物中广泛表达,没有聚腺苷酸化尾以及帽状结构,能够抵抗外切酶降解。研究发现,Hsa_circ_0001658(circ_0001658)在非小细胞肺癌组织和细胞系中表达升高,其高表达与TNM分期、组织分化程度显著相关,敲除circ_0001658可抑制非小细胞肺癌细胞活力,增加凋亡率[2]。另有研究指出这个circRNA能够显著增加骨肉瘤细胞的增殖、运动,并抑制凋亡[3]。然而,还没有数据表明是否circ_0001658参与乳腺癌的发展。Circinteractome预测显示,circ_0001658包含miR-1179结合位点。先前的证据已经表明此miRNA低表达与乳腺癌淋巴结转移、晚期临床分期和总生存期缩短相关,它的模拟物限制乳腺癌细胞增殖以及运动[4]。尽管miR-1179在乳腺癌中作用已有报道,但circ_0001658可否通过调控miR-1179表达来影响乳腺癌进展还没有报道。基于以上原因,此研究探讨circ_0001658对乳腺癌BT-549细胞表型变化的影响及分析circ_0001658对这些细胞行为的调控中是否涉及miR-1179。
1 资料与方法
1.1临床资料:选取在本院2017年1月至2019年1月期间治疗的30例乳腺癌患者,获得原发性乳腺癌组织及相应癌旁组织,于-80℃保存。每位患者均知情且同意,本研究经本院伦理委员会批准。
1.2材料:人乳腺癌细胞BT-549、DMEM、Annexin V-FITC/PI凋亡检测试剂盒、青霉素-链霉素溶液购自武汉普诺赛生物;胎牛血清购自美国Gibco公司;Trizol、反转录试剂购自日本Takara公司;Lipofectamine2000购自美国Invitrogen公司;RIPA蛋白裂解液、MTT试剂盒、qRT-PCR试剂盒、双荧光素酶基因检测试剂盒由北京索莱宝生物提供;胰蛋白酶、BCA试剂盒购自上海研谨生物;凝胶制备试剂盒由福州飞净生物提供;引物由上海生工生物合成。
1.3细胞转染与分组:将BT-549细胞铺在6孔板(2×105个/孔),在正常条件下培养指导细胞达到75%左右汇合度,根据Lipofectamine 2000试剂说明书分别准备si-NC、si-circ_0001658、miR-NC、以及miR-1179和脂质体的混合物,将混合物在室温条件下孵育20min分别转染至BT-549细胞;另外根据Lipofectamine 2000说明书准备si-circ_0001658、anti-miR-NC以及脂质体混合物和si-circ_0001658、anti-miR-1179以及脂质体混合物,并分别转染至BT-549细胞。转染48h后,用于后续分析。
1.4RT-qPCR:提取细胞总RNA,反转录为cDNA,并参照qRT-PCR试剂盒说明书定量RNA表达。Circ_0001658、miR-1179分别以β-actin和U6为内参,2-△△Ct法计算相对表达水平。circ_0001658上游引物:5'-GCCCAATCTCTCCTGCAAGT-3';下游引物:5'-CCACCTAGGAGGAACTGACAA-3';β-actin上游引物:5'-CCTGTACGCCAACACAGTGC-3';下游引物:5'-ATACTCCTGCTTGCTGATCC-3';miR-1179上游引物:5'-AAGCATTCTTTCATTGGTTGGA-3';下游引物:5'-CTCTACAGCTATATTGCCAGCCAC-3';U6上游引物:5'-TGCGGGTGCTCGCTTCGGCAGC-3';下游引物:5'-GTGCAGGGTCCGAGGT-3'。
1.5MTT检测细胞增殖:将BT-549细胞铺在96孔板,培养24、48、72h后,将细胞继续和MTT溶液孵育4h,随之和DMSO室温孵育5min,最后利用酶标仪分析每孔样品。
1.6PI单染法测定胃癌细胞周期:取各组BT-549细胞,PBS洗涤1次,离心后弃上清,乙醇固定细胞,室温放置3h,PBS洗涤1次,离心后弃上清,加入100μL RNaseA,37℃水浴30min,再加入400μL PI染液,4℃避光反应20min,流式细胞仪测定488nm处红色荧光。
1.7Annexin V检测细胞凋亡:将各组BT-549细胞通过离心法收集,用合缓冲液重悬后,按照Annexin V-FITC/PI试剂盒说明将Annexin V-FITC、碘化丙啶(PI)各5μL和样品混匀,孵育15min后,用流式细胞仪分析各组样品。
1.8蛋白表达分析:应用裂解液裂解各组样品,通过离心提取细胞总蛋白,标准曲线法定量蛋白浓度后,样品经聚丙烯酰胺凝胶电泳后转至硝酸纤维素膜。膜上的非特异蛋白条带用脱脂牛奶封闭,随后将硝酸纤维素膜和一抗以及二抗孵育。用增强的化学发光系统显影,最终用ImageJ软件定量条带灰度值。
1.9双荧光素酶报告实验:构建荧光素酶表达载体WT-circ_0001658、MUT-circ_0001658,依据商业化的试剂盒说明分析荧光素酶活性。
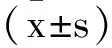
2 结 果
2.1circ_0001658在乳腺癌组织中表达:circ_0001658和miR-1179在癌旁组织组织中的表达量分别是1.00±0.11和1.00±0.10,在乳腺癌组织中的表达量分别是4.24±0.53和0.45±0.05,且差异具有统计学意义(P<0.05),见表1。
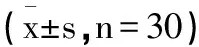
表1 circ_0001658和miR-1179在乳腺癌组织中定量分析
2.2沉默circ_0001658对BT-549细胞增殖、细胞周期和凋亡的影响:如图1、表2和表3所示,与si-NC组比较,si-circ_0001658组BT-549细胞中circ_0001658表达降低,细胞OD值、S期细胞比例以及PCNA、CyclinD1、Bcl-2产生减少,G0-G1期细胞比例、细胞凋亡率以及p27、Bax产生增加(P<0.05)。
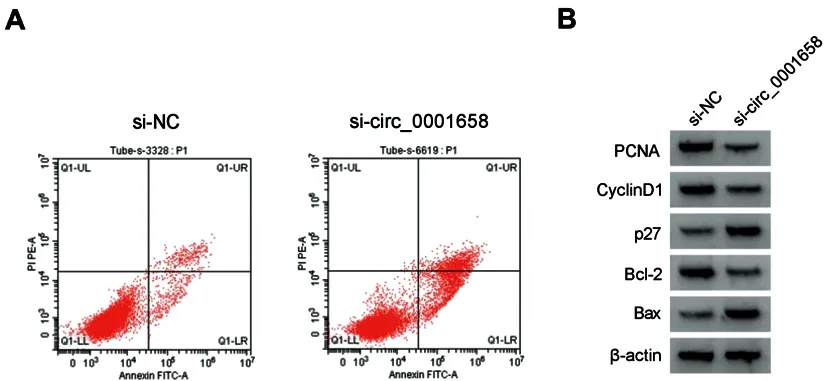
图1 沉默circ_0001658对BT-549细胞增殖和凋亡的影响

表2 沉默circ_0001658对BT-549细胞增殖细胞周期和凋亡的影响

表3 沉默circ_0001658对BT-549细胞增殖细胞周期和凋亡相关蛋白表达的影响
2.3circ_0001658靶向miR-1179:Circ_0001658含有miR-1179互补的核苷酸序列(图2)。结果展示相对荧光素酶活性值在WT-circ_0001658和miR-NC转染组、WT-circ_0001658和miR-1179转染组、MUT-circ_0001658和miR-NC转染组和MUT-circ_0001658和miR-1179转染组分别是1.01±0.12、0.43±0.05、1.02±0.10和1.00±0.08(表4、表5),且差异具有统计学意义(P<0.05)。

图2 circ_0001658含有miR-1179互补序列

表4 双荧光素酶报告实验

表5 circ_0001658调控miR-1179表达
2.4过表达miR-1179对BT-549细胞增殖、细胞周期和凋亡的影响:与miR-NC组比较,miR-1179组BT-549细胞中miR-1179表达升高,细胞OD值、S期细胞比例以及PCNA、CyclinD1、Bcl-2蛋白表达降低,G0-G1期细胞比例、细胞凋亡率以及p27、Bax蛋白表达升高(P<0.05)(图3、表6和表7)。
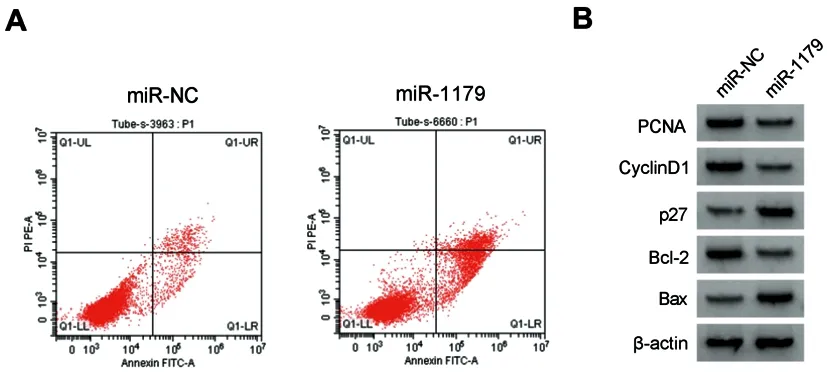
图3 过表达miR-1179对BT-549细胞增殖、细胞周期和凋亡的影响

表6 过表达miR-1179对BT-549细胞增殖、细胞周期和凋亡的影响

表7 过表达miR-1179对BT-549细胞增殖细胞周期和凋亡相关蛋白表达的影响
2.5下调miR-1179逆转了沉默circ_0001658对BT-549细胞增殖、细胞周期和凋亡的影响:如图4、表8和表9所示,与si-circ_0001658+anti-miR-NC组比较,si-circ_0001658+anti-miR-1179组BT-549细胞中miR-1179表达下降,细胞OD值、S期细胞比例以及PCNA、CyclinD1、Bcl-2产生增加,G0-G1期细胞比例、细胞凋亡率以及p27、Bax产生减少(P<0.05)。
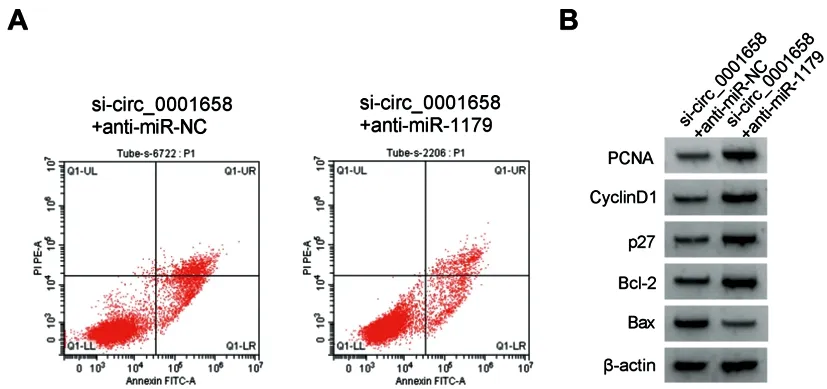
图4 下调miR-1179逆转了沉默circ_0001658对BT-549细胞增殖、细胞周期和凋亡的影响

表8 下调miR-1179逆转了沉默circ_0001658对BT-549细胞增殖细胞周期和凋亡的影响

表9 抑制miR-1179表达挽救了circ_0001658低表达对BT-549细胞增殖细胞周期和凋亡相关蛋白表达的影响
3 讨 论
研究发现,circRNA的异常高表达与乳腺癌进展有关。在乳腺癌组织和细胞中,circ_0103552表达上调,上调circ_0103552可促进乳腺癌细胞的增殖、迁移和侵袭,而敲减circ_0103552则诱导了相反的效应[5]。circCD44在三阴性乳腺癌中高表达,其表达与患者的预后呈负相关,circCD44可促进三阴性乳腺癌细胞的增殖、迁移、侵袭以及肿瘤发生[6]。Circ_0000517低表达能够减少乳腺癌细胞增殖和侵袭能力[7]。Circ-RPPH1敲低减弱乳腺癌细胞运动能力并促进细胞凋亡[8]。下调circ_0000514可抑制乳腺癌细胞的恶性生物学行为。敲减circ_0068631可抑制乳腺癌细胞的增殖和迁移。circ_0088088在乳腺癌中表达上调,其高表达表示不良预后,上调hsa_circ_0088088可促进乳腺癌细胞的生长和转移[9]。circ-PDCD11可加速三阴性乳腺癌细胞的葡萄糖摄取、乳酸生成、ATP生成和细胞外酸化速率[10]。当前的研究结果显示乳腺癌组织中circ_0001658表达增加,circ_0001658敲低降低了BT-549细胞OD值、S期细胞比例以及PCNA、CyclinD1、Bcl-2蛋白水平,升高了G0-G1期细胞比例、细胞凋亡率以及p27、Bax蛋白水平,提示沉默circ_0001658可抑制BT-549细胞增殖,促进细胞周期阻滞和凋亡。
越来越多的证据显示circ_0001658能以竞争性内源RNA的角色介导microRNA和其下游基因表达[2,3]。当前的结果表明circ_0001658与miR-1179之间存在互补序列,且circ_0001658负调控miR-1179表达。相关数据已指出miR-1179在多种肿瘤中发挥抑癌基因作用。如miR-1179过表达可抑制宫颈癌细胞的侵袭[11]。miR-1179通过诱导细胞凋亡和调节MEK/ERK和PI3K/AKT信号通路抑制口腔癌细胞增殖和提高长春新碱敏感性[12]。miR-1179在胃癌组织和细胞系中均显著下调,其表达降低与胃癌患者的肿瘤大小、肿瘤分期和淋巴结转移显著相关,过表达miR-1179可抑制胃癌细胞的增殖和侵袭[13]。miR-1179通过靶向SPAG5和抑制Akt信号抑制非小细胞肺癌细胞的生长和侵袭[14]。miR-1179通过靶向E2F5抑制胰腺癌细胞的增殖、迁移和侵袭。miR-1179在胶质瘤中低表达,上调miR-1179可抑制胶质瘤细胞增殖和细胞周期进程[15]。和这些数据类似,乳腺癌组织中miR-1179表达降低,miR-1179降低了BT-549细胞OD值、S期细胞比例以及PCNA、CyclinD1、Bcl-2蛋白水平,升高了G0-G1期细胞比例、细胞凋亡率以及p27、Bax蛋白水平,提示过表达miR-1179可抑制BT-549细胞增殖,促进细胞凋亡;miR-1179抑制剂挽救circ_0001658敲低对BT-549细胞表型的影响,BT-549细胞OD值、S期细胞比例以及PCNA、CyclinD1、Bcl-2蛋白水平升高,G0-G1期细胞比例、细胞凋亡率以及p27、Bax蛋白水平降低,以上结果说明了circ_0001658通过靶标miR-1179介导BT-549细胞表型变化。
综上所述,抑制circ_0001658表达通过靶向miR-1179抑制BT-549细胞肿瘤特性。circ_0001658可能是乳腺癌的潜在治疗靶点,但仅限于体外实验,circ_0001658在体内的作用还有待进一步研究。

