miR-101对乳腺癌患者的诊断及对乳腺癌细胞自噬和凋亡的影响
宋雅琪, 张志生, 孔令霞, 刘进宇
(河北北方学院附属第一医院乳腺外科, 河北 张家口 075000)
乳腺癌是女性最常见的肿瘤之一,每年全球大约有130万新增乳腺癌患者,其中50万死于乳腺癌[1]。尽管乳腺癌的筛查和治疗方法在近年来有所改进,但该疾病的分子发病机制仍不完全清楚,乳腺癌仍然是一项重要的公共卫生挑战。微小RNA(miRNAs或miRs)是小的非编码RNA分子,可通过靶向3’-非翻译区(3’-UTR)负调节其靶mRNA的稳定性或翻译效率来调节基因表达。在人类基因组中超过10%的蛋白质编码mRNA可能是miRNA的保守靶标[2],miRNAs可以作为原癌基因或抑癌基因发挥作用[3],在细胞增殖、凋亡、细胞周期、分化、迁移等生命活动中起着重要作用。这表明miRNA在人类的生物学过程中具有重要作用。Iorio等[4]鉴定了29种miRNAs,与正常乳腺组织相比,它们在乳腺癌中的表达明显失调,包括miR-10、miR-101b和miR-125b,它们在乳腺癌中下调,以及miR-145和miR-21,它们在乳腺癌中上调。以上结果提示miRNAs与肿瘤发生发展密切相关。因此,深入了解miRNAs与肿瘤之间的关系将有助于我们更好地了解肿瘤的发病机理。
1 资料与方法
1.1一般资料:选择2021年6月1日至2022年10月河北北方学院附属第一医院收治的96名乳腺癌患者作为观察组,41例乳腺良性增生患者作为良性组,35名健康体检者作为正常对照组。疾病组平均年龄为(49.34±11.35)岁,乳腺良性增生组平均年龄为(48.96±10.34)岁,对照组平均年龄为(49.11±11.55)岁。3组间的年龄比较无显著性差异(P>0.05)。纳入标准:①全部患者均签署了知情同意书;②所有观察组乳腺癌患者经组织病理学诊断;③全部病例为首次确诊,未接受过手术、放化疗和生物学治疗,未合并其它原位肿瘤;④良性组均经彩超或组织病理学证实;正常对照组无乳腺相关疾病。排除标准:①妊娠及哺乳妇女;②自身免疫疾病;③临床资料不完整的研究对象。
1.2实验材料:清晨收集3组外周静脉血中抽取5mL到试管中,在4℃离心机中进行离心,提取上层血清,将血清放入无RNA酶的EP管中,EP管放入-80℃的冰箱中进行保存。乳腺癌细胞株MCF-7及正常乳腺细胞株HBL-100,购自上海生命科学院细胞和生物化学研究所。1640培养基和青链霉素购于美国Sigma公司;胎牛血清购于GIBCO公司;Trizol购于中国上海翌圣生物有限公司;miR-101 mimics、mimics control购自上海吉玛制药公司;Annexin V-FITC/PI凋亡试剂盒购于江苏凯基生物公司;CCK-8试剂盒购于日本同仁化学研究所;2×RealStar Fast SYBR qPCR Mix和反转录试剂盒购于北京康润公司;BAX、BCL-2、LC3B、Beclin-1一抗兔抗购于美国Sigma公司。
1.3方 法
1.3.1细胞培养及分组:快速解冻MCF-和HBL-100细胞,离心去除上清,然后在含有1%青霉素/链霉素/庆大霉素的90%培养基和10%血清中重悬。将细胞以1×105cells/mL的浓度接种于25cm2的烧瓶中,在37℃、5% CO2的培养箱中培养至细胞融合度达到~80%。用0.25%胰蛋白酶-edta传代,1500rpm离心;每2天更换一次培养基。细胞分组为空白对照组,miR-101空载组(阴性对照组),miR-101转染组。
1.3.2荧光定量(qRT-PCR):总RNA用Trizol提取,将提取的RNA提取物反转录为cDNA。进行实时定量PCR。用于实时定量PCR的具体miR-101引物序列如下:R-5'-TACAGTACTGTGATAACTGAA-3',F-5'-CTCAACTGGTGTCGTGGA-3'。引物由上海生工生物有限公司合成。使用2-ΔΔCt方法测量miRNA-101相对于U6的表达。U6引物序列如下:R-5'-CGCTTCGGCAGCACATATAC-3',F-5'-TTCACGAATTTGCGTGTCAT-3'。
1.3.3CCK-8检测细胞增殖:根据使用说明,使用CCK-8试剂测定细胞增殖,将细胞以5×104个细胞/孔接种到96孔板中。在24h、48h、72h和96h后,用CCK-8试剂处理细胞并孵育2h。使用Bio-Rad酶标仪(Bio-Rad,Hercules,CA,USA)在450nm波长下测量吸光度。
1.3.4miR-has-miRNA-145表达载体构建及转染:将MCF-7和HBL-100细胞接种在6孔板中,根据制造商提供的说明,使用Lipofectamine 2000转染试剂将miR-101mimics和miR-101minics control转染到细胞中,培养48h后,收集细胞用于分析。
1.3.5流式细胞术检测细胞凋亡:使用Annexin-V-FITC/PI凋亡检测试剂盒检测凋亡细胞。获取处理后的1×105细胞,在避光下用Annexin-V-FITC/PI孵育5min用FACSCalibur流式细胞仪分析凋亡细胞。
1.3.6蛋白质免疫印迹(Western Blot):使用RIPA裂解液提取总蛋白。BCA测定蛋白浓度,进行凝胶电泳,凝胶随后转移到PVDF膜上,一抗4℃过夜,二抗孵育2h。采用ECL测量信号。
2 结 果
2.13组患者血清miRNA-101表达比较:PCR结果显示96例观察组和41例良性组miRNA-101的相对表达量分别为0.63和0.27,与35例对照组(1.00)相比,差异具有统计学意义。(P<0.01)。见图1。
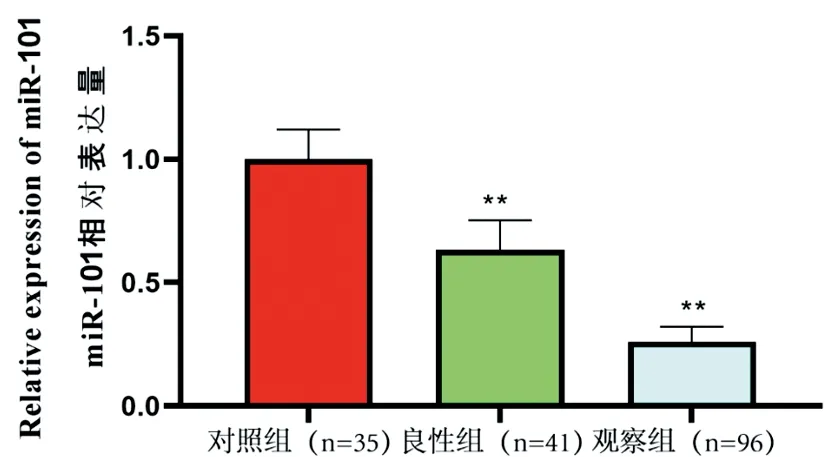
图1 健康对照组、良性组和观察组血清miRNA-101的表达

图2 血清miRNA-101的诊断效能
2.2乳腺癌患者血清miRNA-101表达与临床病理特征的关系:乳腺癌患者血清miRNA-101的表达在年龄、是否绝经和病理类型无显著性差异(P>0.05),血清miRNA-101的表达在淋巴结转移、分化程度、肿瘤直径和TNM分期差异具有显著性(P<0.01),见表1。

表1 乳腺癌患者血清miRNA-101表达与临床病理特征的关系
2.3血清miRNA-101评估乳腺癌的受试者工作特征(ROC)曲线分析显示:血清miRNA-101鉴别观察组和良性组的曲线下面积为0.723(95%CI:0.813-0.924),截断值为0.375时,敏感度和特异度分别为90.24%和89.25%(图2A)。血清中miRNA-101表达水平观察组和对照组的曲线下面积为0.875(95%CI:0.835~0.981),截断值为0.325时,敏感度和特异度分别为94.55%和96.88%(图2B)。
2.4miRNA-101的表达与过表达载体稳定细胞系的构建:与人乳腺细胞(HBL-100)相比,乳腺癌细胞(MCF-7)miRNA-101的表达显着降低(P<0.01)(图3A)。构建miRNA-101过表达载体,qPCR数据结果显示(图3B),稳定过表达miRNA-101的MCF-7细胞中,与空白对照组和miR-101空载组相比,miR-101转染组miR-101的表达量显著升高(P<0.01)。对照组与miR-101空载组相比,miRNA-101的表达无显著差异性(P>0.05)。
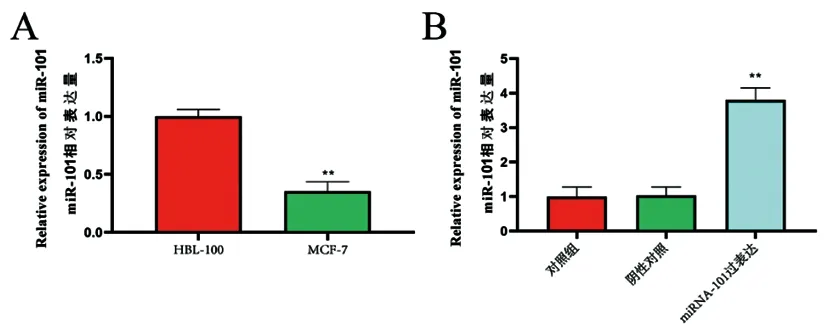
图3 miRNA-101在MCF-7和HBL-100细胞表达及miRNA-101过表达载体稳定MCF-7细胞系的构建
2.5CCK-8法检测不同组之间细胞增殖:通过CCK-8试验检测MCF-7细胞增殖能力的改变。如图4所示,同miR-101空白对照组和miR-145空载组细胞相比,miR-145转染组细胞增殖能力明显受到抑制(P<0.05)。

图4 miR-101转染对MCF-7细胞增殖能力的影响
2.6miRNA-101对MCF-7细胞自噬和凋亡相关mRNA的影响:由图5A可知,与对照组相比,miRNA-101转染组促凋亡基因BAX极显著上升(P<0.01),抗凋亡基因BCL-2表达极显著降低(P<0.01)。miRNA-101空载组则无显著差异(P>0.05)。由图5B可知,与对照组相比,miRNA-101转染组自噬相关基因LC3B和Beclin-1表达极显著降低(P<0.01)。miRNA-101空载组则无显著差异(P>0.05)。

图5 miRNA-101对MCF-7细胞自噬和凋亡相关mRNA的影响
2.7miRNA-101对MCF-7细胞自噬和凋亡相关蛋白及凋亡率的影响:miR-101过表达对MCF-7细胞自噬和凋亡影响,与对照组相比,miR-101转染组BAX蛋白的表达极显著增加(P<0.01),BCL-2蛋白的表达极显著降低(P<0.01),miR-101空载组则无显著差异(P>0.05),同时细胞凋亡率极显著上升(图6A,C)。与对照组相比,miR-101转染组LC3B和Beclin-1蛋白表达极显著下降(P<0.01),miR-101空载组则无显著差异(P>0.05)。
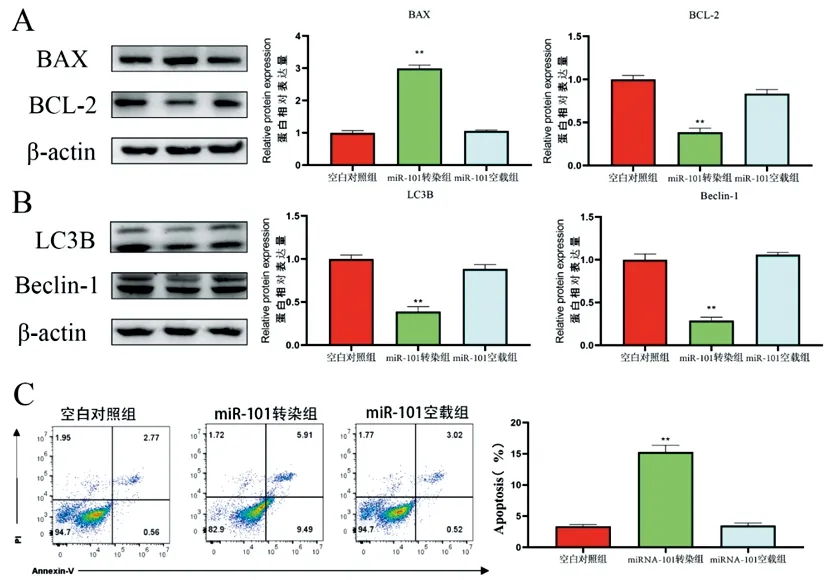
图6 miRNA-101对MCF-7自噬和凋亡相关蛋白及细胞凋亡影响
3 讨 论
乳腺癌已成为严重危害人类生命的恶性肿瘤之一,其发生与患者年龄、职业和遗传等因素密切相关[5]。miRNA血清中的表达较为稳定,其不同种类的miRNA在乳腺癌患者血清中的表达存在差异,这种miRNA表达水平的差异使得miRNA成为诊断乳腺癌的血清学标志物的基础。miR-101属于肿瘤抑制因子,在喉部鳞状细胞癌、神经胶质瘤和骨肉瘤等显著降低[6~8]。本研究发现miR-101在乳腺癌中同样行使抑癌基因的功能,观察组患者血清miRNA-101的表达量显著高于良性增生组和健康对照组。ROC曲线分析表明,miRNA-101可作为乳腺癌早期诊断标志物,对其临床应用有较高的价值。且miRNA-101在乳腺癌患者血清中的表达水平与淋巴结转移、分化程度、肿瘤直径和TNM分期有关。表明miRNA具有高度的可检测性及稳定的特点,miRNAs与疾病的早期诊断密切相关。
自噬通常被称为巨自噬,是真核细胞降解底物的主要机制。细胞自噬在演化过程中表现出高度的保守性,其发生和发展受许多与自噬相关的基因控制。miR-101在自噬调节中作为一种抑癌miRNA,可抑制肿瘤的形成。Frankel等研究发现miR-101能显著降低MCF-7乳腺癌细胞的基础自噬通量,同时还可抑制由依托泊苷(etoposide)和雷帕霉素介导的细胞自噬[9]。本研究结果显示,miR-101过表达可显著降低自噬相关LC3B和Beclin-1基因和蛋白的表达,表明miR-101可抑制MCF-7细胞自噬的发生,符合前人研究结果。
细胞的增殖是生物最主要的生命特征,而细胞的增殖是通过分裂来完成,通过细胞分裂而形成单细胞个体[10]。细胞凋亡,又叫程序性细胞死亡。在器官组织的生长发育、新陈代谢、免疫和异常细胞消除过程发挥着重要的作用[11]。miRNA与细胞增殖和凋亡关系密切,例如过表达miRNA-30b可靶向ITGB3抑制乳腺癌细胞的增殖、侵袭,并促使其凋亡[12]。过表达miR-558可靶向CD155促进乳腺癌细胞的凋亡[13]。在本研究中miR-101在MCF-7细胞中的表达明显低于HBL-100细胞,且细胞增殖实验表明过表达miR-101随着时间的推移可显著抑制MCF-7细胞的增殖,过表达miR-101可显著增加MCF-7细胞BAX/BCL-2蛋白和基因的表达,细胞凋亡率增加。上述结果表明miR-101过表达可显著抑制MCF-7细胞的生长并诱导细胞凋亡。综上所述,在乳腺癌MCF-7细胞中,过表达miR-101可显著抑制MCF-7细胞增殖,抑制细胞自噬,促进其凋亡。但有关miRNA-101在乳腺癌临床治疗的价值和抗肿瘤机制仍需更深入研究。

