基于Sirt1/p53信号通路探究NK4基因对非霍奇金淋巴瘤细胞增殖和凋亡的机制研究
贲海祥, 徐 娟
(江苏省如皋市人民医院血液科, 江苏 如皋 226500)
恶性淋巴瘤(Malignant lymphoma,ML)是一种血液恶性肿瘤,发生在淋巴结或淋巴结外的淋巴组织[1]。非霍奇金淋巴瘤(Non-Hodgkin's lymphoma,NHL)是一类起源于淋巴系统的癌症,由恶性B细胞的过度增殖引起,是美国第七大常见恶性肿瘤,通常被认为是预后良好的恶性肿瘤,5年生存率约为70%[2]。但淋巴瘤的发病率在全球范围内持续增加,对人类健康造成严重危害[3]。NHL最常见的类型为弥漫大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)和套细胞淋巴瘤(MCL)[4]。NK4是一种特异性肝细胞生长因子(HGF)拮抗剂,由HGF的N端发夹结构和α链的四个Kringle结构域组成。NK4蛋白给药或NK4基因治疗抑制了各种肿瘤类型中的肿瘤生长、侵袭、转移和血管生成,所述肿瘤类型包括乳腺癌、结肠癌、肺癌、胰腺癌、间皮瘤、前列腺癌、胃癌和脑癌[5~7]。另外,去乙酰化酶sirtuin-1(Sirt1)是一种NAD+依赖性Ⅲ类组蛋白去乙酰化酶,其功能上与细胞代谢相关,并被视为代谢传感器[8],可调节干细胞、细胞增殖、凋亡、DNA修复、自噬和肿瘤发生,Sirt1在许多癌症中上调,包括前列腺癌、白血病和皮肤T细胞淋巴瘤肿瘤细胞[9]。沉默或抑制Sirt1的表达水平会激活下游p53蛋白,并随后加速或推动细胞衰老[10]。目前,NK4对NHL疾病的调控机制尚鲜有研究,尤其是NK4是否通过介导Sirt1/p53信号通路调控肿瘤细胞的生物学行为仍未可知。因此,在这项研究中,我们旨在探究NK4基因对NHL细胞增殖、凋亡的调节机制。
1 材料与方法
1.1细胞培养:人类非霍奇金淋巴瘤细胞株(Jurkat和Raji)及正常B细胞系均购自美国典型培养物保藏中心(ATCC,Rockville,MD,USA)。Jurkat和Raji细胞在补充有10% FBS的RPMI 1640培养基中生长,B细胞维持在添加10%人血清、100U/mL青霉素、100μg/mL链霉素、2mM L-谷氨酰胺(Invitrogen,Carlsbad,CA,USA)的Iscove s改良培养基中(NABI Biopharmaceuticals,Boca Raton,FL,USA)。所有细胞系都在37℃,5% CO2条件下培养。
1.2细胞转染:pcDNA3.1-NK4、pcDNA3.1-NC均购自Invitrogen(Carlsbad,CA,USA),Sirt1激动剂SRT1720购自碧云天生物科技有限公司(上海,中国)。oe-NK4/NC组细胞处理步骤如下:将细胞以1×106细胞/mL的密度置于6孔板上,按照操作说明书,使用LiPofectamine 2000 (11668-019,Invitrogen,Carlsbad,CA,USA)将50 nM pcDNA3.1-NK4/NC转染到Raji细胞(培养至融合度80%以上)中,转染48h。oe-Sirt1+SA/DMSO组处理步骤如下:在培养基中加入给定浓度的SIRT1激动剂SRT1720 (1moL/L)或者等量的DMSO,再转染pcDNA3.1-NK4 48h后进行后续实验。
1.3qRT-PCR(实时荧光定量聚合酶链反应):从人淋巴瘤细胞系或正常外周淋巴细胞中提取总RNA TRIzol试剂(Invitrogen),并使用反转录第一链cDNA合成试剂盒(K1622; Thermo Fisher Scientific)进行反转录。根据制造商的说明,使用Maxima SYBR Green/ROX qPCR master mix(K0223;Thermo Fisher Scientific)进行qRT-PCR检测NK4 mRNA水平,β-actin用于归一化。用于qRT-PCR的引物如下,NK4 F:5′-GTGAATACTGCAGACCAATGTGCTA-3′和NK4 R:5′-GGTCAAATTCATGGCCAAATTC-3′;β-actin F:5′-TGGCACCCAGCACAATGAA-3′,R:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。使用2-△△Ct比较Ct方法计算。
1.4CCK-8检测细胞增殖:细胞增殖通过细胞计数试剂盒-8(CCK8)分析(C0039,碧云天生物科技有限公司,北京,中国)。将不同组的细胞以2×105细胞/孔的密度接种到96孔板中,并在37℃含5% CO2的湿润培养箱中孵育隔夜。在第0小时、第12小时、第24小时、第48小时和第72小时收集细胞。去除培养基并用无血清基本培养基替换后,向每个孔中加入10μL CCK 8溶液并孵育1h,之后将100 μL样品上清液转移到96孔微孔板中,并根据光密度波长为450nm。
1.5流式细胞术检测细胞凋亡:细胞被胰蛋白酶消化并在冷PBS中洗涤两次。在1000g离心5min后,收集细胞并浓缩至每孔1×106个细胞。将0.1mL细胞悬浮液与5μL FITC缀合的膜联蛋白V混合,在室温下避光孵育15min,然后与5μL PI 混合并孵育5min。然后使用流式细胞仪(FACSCanto Ⅱ,BD Biosciences,US)分析样品。
1.6Transwell法检测细胞迁移、侵袭:根据生产商说明,使用24孔Transwell小室(BD,Biosciences)检测细胞迁移和侵袭能力。侵袭实验时,先按1∶8的比例将50mg/L Matrigel胶稀释后铺于小室底部;迁移实验时不铺胶。24孔板下室加入完全培养基600μL,取各组细胞悬液200μL加入Transwell小室的上室,在37℃下孵育24h后,使用棉签去除上室中的细胞。迁移或侵袭细胞用甲醇在4℃固定30min,用0.1%结晶紫溶液在37℃染色20min,用倒置显微镜(Nikon Corporation,Japan)进行观察。细胞实验独立重复3次。
1.7Western blot:用含有磷酸酶和蛋白酶抑制剂的RIPA裂解缓冲液(基尔顿生物科技上海有限公司,上海,中国)获取细胞裂解液,使用BCA蛋白质测定试剂盒(PICPI23223; Thermo Fisher Scientific)对样品蛋白浓度进行检测。进行加热和变性后,使用10%(对于高分子量蛋白质)或15%(对于低分子量蛋白质)十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质样品(25μg/泳道),并转移到硝酸纤维膜(Millipore,Billerica,MA,USA)上。在室温下用5%脱脂牛奶封闭1h后,将膜与一抗在4℃下单独孵育过夜。一抗信息如下:Sirt1(ab189494,1∶1000,80kDa)、p53(ab32389,1∶10000,44kDa),GAPDH(ab9485,1∶2500,37kDa)所有抗体均购自Abcam(Cambridge,MA,USA)。用含Tween-20的Tris缓冲盐水洗涤后,将膜与辣根过氧化物酶(HRP)偶联的山羊抗兔二抗(1∶1000; ab150077)一起在室温下孵育1h。在Tanon 5200化学发光成像系统(上海天能科技有限公司,上海,中国)上观察到蛋白质条带。使用ImageJ软件(National Institutes of Health,Bethesda,MD,USA)分析条带密度,GAPDH条带用作内参。
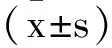
2 结 果
2.1NK4基因在NHL细胞低表达:为评估NK4基因在NHL细胞中的表达水平,我们使用qRT-PCR检测NHL细胞系(Jurkat和Raji)及正常B细胞(normal)中NK4 mRNA的表达。结果显示,与正常B细胞相比,NK4 mRNA水平在NHL细胞系中显著下降(图1,均P<0.01),其中,NK4表达水平在Raji细胞中最低。因此在后续的研究中,我们采取Raji细胞作为研究对象。

图1 NK4基因在NHL细胞低表达
2.2上调NK4基因表达水平抑制NHL细胞生长进展:为探索NK4细胞在NHL细胞中的作用,我们使用pcDNA3.1-NK4及其阴性对照pcDNA3.1-NC转染至Raji细胞中。qRT-PCR结果显示,转染pcDNA3.1-NK4组(oe-NK4组)NK4 mRNA水平显著上升,转染成功(图2A,P<0.001)。随后,我们分别采取CCK-8和流式细胞术探究细胞增殖和凋亡,结果显示,与转染pcDNA3.1-NC组(oe-NC组)相比,上调NK4表达水平显著抑制NHL细胞增殖、促进细胞凋亡(图2B-C,均P<0.001)。此外,在NHL细胞中上调NK4表达水平后,NHL细胞迁移和侵袭能力显著下降(图2D,均P<0.01)。以上结果表明,上调NK4基因表达水平抑制NHL细胞生长进展。

图2 上调NK4基因表达水平抑制NHL细胞生长进展
2.3NK4基因抑制Sirt1/p53信号通路:Western blot检测结果发现,与正常B细胞相比,Sirt1蛋白表达水平在Raji细胞中显著上调(图3,P<0.001),而p53蛋白表达水平显著下降(图3,P<0.001)。而在Raji细胞中过表达NK4基因后,Sirt1蛋白表达水平显著下降,p53水平显著上升(图3,均P<0.001)。以上结果表明,NK4基因抑制Sirt1/p53信号通路。
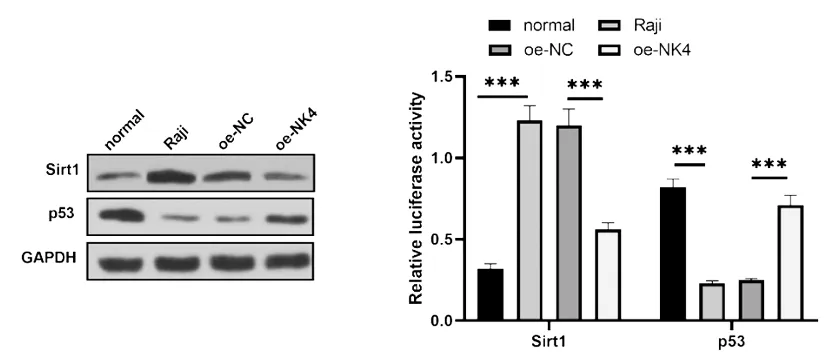
图3 NK4基因抑制Sirt1/p53信号通路
2.4激活Sirt1/p53信号通路部分逆转过表达NK4对NHL细胞生长进展的抑制:为进一步确定NK4/Sirt1/p53在NHL细胞生长进展中发挥的作用,在上调NK4表达的Raji细胞中,同时添加Sirt1激活剂SRT1720上调Sirt1的表达。结果显示,SRT1720显著上调Raji细胞中Sirt1蛋白表达水平,显著降低p53蛋白表达水平(图4A,均P<0.01)。本研究还观察到Sirt激活剂显著促进NHL细胞增殖、抑制细胞凋亡(图4B-C,均P<0.01)。此外,在NHL细胞中添加Sirt激活剂后,NHL细胞迁移和侵袭能力显著下降(图4D,均P<0.01)。以上结果表明,激活Sirt1/p53信号通路部分逆转过表达NK4对NHL细胞生长进展的抑制。

图4 激活Sirt1/p53信号通路部分逆转过表达NK4对NHL细胞生长进展的抑制
3 讨 论
NHL覆盖了约90%的影响淋巴结、脾、骨髓和免疫系统及其他器官的淋巴瘤。NK4基因疗法可抑制多种肿瘤的生长、侵袭、转移和血管生成[5]。在不同癌症的实验模型中,NK4基因治疗抑制了Met受体的激活,这与抑制肿瘤的侵袭和转移有关。类似地,NK4基因治疗抑制肿瘤血管生成,从而抑制血管生成依赖性肿瘤生长[11]。因此,在本研究中笔者大胆假设NK4基因或许对NHL的发生发展发挥着关键作用。结果显示,与正常B细胞相比,NK4基因在NHL细胞系(Jurkat和Raji)中低表达。这提示,差异表达的NK4或许对NHL细胞的生物学功能扮演了重要角色。接下来,我们通过过表达NK4来探究其对Raji生物学行为的影响。结果显示,上调NK4基因表达水平能够明显抑制NHL细胞生长进展。这暗示NK4在NHL细胞中作为抑瘤基因发挥着重要功能。
已有的研究证明,Sirtuin家族具有延缓细胞衰老和延长寿命方面的功能[10]。Sirt1有多种底物,如NF-κB、Ku70、p53、E2F1、TFR2、PPARγ、p73、BcL-XL、MyoD、AR、cI AP2和FOXO家族的转录因子。p53作为Sirt1底物的最具代表性的底物,被认为是一种肿瘤抑制因子。有研究报道,Sirt1表达与弥漫大B细胞淋巴瘤的不良预后相关。Ismail等的研究显示p53的表达水平反映了侵袭性淋巴瘤亚型中有关基因突变的积累。因此,Sirt1/P53通路与抑瘤基因发挥功能密切相关。基于此,在本研究中,结果发现,与正常B细胞相比,Sirt1蛋白表达水平在NHL细胞中显著上调,而p53蛋白表达水平显著下降。这提示Sirt1/P53通路在NHL细胞中异常激活。然而,过表达NK4能够抑制Sirt1/P53通路活性。另外,通过利用Sirt1/P53通路激活剂SRT1720笔者观察到,激活Sirt1/p53信号通路能够部分逆转过表达NK4对NHL细胞生长进展的抑制作用。因此,NK4可能通过抑制Sirt1/p53通路从而抑制NHL细胞增殖、诱导NHL细胞凋亡。
总之,我们的结果提供了NHL中NK4过表达可能对削弱细胞生长进展具有十分重要的作用,这表明NK4在NHL进展中作为一种抗癌基因发挥作用,并可能作为一种新的潜在治疗生物标志物影响下游Sirt1/p53信号通路。但本研究中不足之处在于仅在Raji细胞中对该机制进行验证,未充分考虑该机制是否存在于其它NHL细胞系中。

