CircITGB6调节miR-542-3p/PCNA轴对卵巢癌细胞顺铂耐药性的影响及其机制
廖圣银, 蔡丽芳, 游梦星, 肖琳琳, 谢雪花, 黄伟明, 林 栖, 黄丽斌, 何丽梅
(福建省莆田市第一医院肿瘤内科, 福建 莆田 351100)
卵巢癌(OC)是女性常见的恶性肿瘤之一,具有较高的发病率和死亡率[1]。目前,OC的主要治疗方法是手术切除和以顺铂(DDP)为基础的化疗,但由于DDP耐药的发生,OC患者的总生存率仍较低[2]。因此,有必要进一步研究OC癌变和DDP耐药的分子机制,以改善OC患者的预后和生存率。环状RNA(circRNA)由于独特的闭环结构使其在生物体内极其稳定,许多研究证实circRNA与癌症恶性进展有关[3],且其在癌症化疗耐药中的作用也被许多研究证实[4]。最新研究发现CircITGB6在铂类耐药OC患者的肿瘤组织和血清中显著升高,与预后不良相关[5],但其作用机制尚需深入探索。微小RNA(miR)-542-3p在上皮性OC组织和细胞系中下调,可在OC中作为肿瘤抑制性miRNA发挥作用[6],但其在OC中对DDP耐药性机制的影响鲜有报道。增殖细胞核抗原(PCNA)作为一种在细胞增殖期大量表达的核蛋白,与肿瘤发生和发展中的作用密切相关,已有研究证明PCNA在OC组织中的表达水平明显高于良性卵巢肿瘤组织和正常卵巢组织,可能与OC发生、发展、侵袭和转移相关[7]。生物信息学显示miR-542-3p分别与CircITGB6、PCNA存在结合位点,但CircITGB6能否通过调节miR-542-3p/PCNA轴影响OC细胞顺铂(DDP)耐药性尚未报道,故本研究旨在探讨CircITGB6通过调节miR-542-3p/PCNA轴对OC细胞DDP耐药性的研究。
1 材料与方法
1.1组织及细胞来源:选取2019年至2022年在莆田市第一医院就诊的66例OC患者,所有患者均接受手术治疗,未接受化疗或放疗,于手术中收集肿瘤标本并储存在液氮中。另选取66例因子宫肌瘤行全子宫双附件切除患者的正常卵巢组织为对照组。参与本研究的所有病人或其近亲属均签署知情同意书,且研究经莆田市第一医院伦理委员会审核批准。人OC细胞系SKOV3和DDP抗性菌株(SKOV3/DDP)(美国ATCC);正常卵巢上皮细胞系(IOSE-80)(国家实验细胞资源保藏中心)。SKOV3细胞在含有10% FBS、1%青霉素/链霉素的DMEM培养基中培养。SKOV3/DDP细胞培养基中添加0.5 μg/mL的DDP。IOSE-80细胞在完全培养基中培养,细胞融合至80%时,胰蛋白酶消化进行传代培养。
1.2主要试剂与仪器:CircITGB6抑制物(si CircITGB6)及阴性对照(si NC)、miR-542-3p模拟物(miR-542-3p mimics)、抑制物(miR-542-3p inhibitor)及相应阴性对照(mimics NC、inhibitor NC)、荧光素酶质粒报告(上海吉玛制药有限公司);TRIzol试剂(美国Invitrogen公司);细胞凋亡试剂盒、CCK-8试剂盒、BCA蛋白测定试剂盒(上海碧云天生物技术有限公司);PrimeScript RT试剂盒(日本Takara公司);Bcl-2相关X蛋白(Bax)、细胞增殖相关核抗原(Ki-67)、PCNA、β-actin一抗(英国Abcam公司)。美国Bio-Rad提供Real-time PCR仪;BioTek Instruments提供ELx 800酶标仪。
1.3方 法
1.3.1qRT-PCR检测组织及细胞中CircITGB6、miR-542-3p、PCNA mRNA表达水平:TRIzol试剂提取OC组织和正常卵巢组织、SKOV3、SKOV3/DDP、IOSE-80细胞以及各组SKOV3/DDP细胞中的RNA,逆转录获得cDNA,在Agilent Mx3000P PCR系统进行qRT-PCR分析。引物序列:CircITGB6上游5'-TGTGGTGACCCCTGTAACTC-3',下游5'-TGCACACACATTCACCACAG-3';miR-542-3p上游5'-GCGCGATATCGCGACGAGCGACC-3',下游5'-TTAAGCGAGCTATCGCGCGCGAGCG-3';PCNA上游5'-TGAAGCACCAAACCAGGAG-3',下游5'-GAAGGCATCTTTACTACACAGC-3';内参U6上游5'-CTCGCTTCGGCAGCACATATACT-3',下游5'-ACGCTTCACGAATTTGCGTGTC-3';内参β-actin上游5'-GCAGAAGTGCGAAGAGGAGG-3',下游5'-GCTTGATGGAGTTGTCGGTGTA-3'。PCR反应体系:10μL SYBR Mix、1μL cDNA模板、0.5μL上下游引物。反应条件:95℃ 5min、95℃ 1min、60℃ 50s、72℃ 10min,共40个循环。以U6、β-actin为内参,采用2-△△CT法分析CircITGB6、miR-542-3p、PCNA表达。
1.3.2细胞分组及处理:取SKOV3/DDP细胞分为对照组(不经任何处理)、si NC组(转染si NC)、si CircITGB6组(转染si CircITGB6)、si CircITGB6+miR-542-3p inhibitor组(共转染si CircITGB6、miR-542-3p inhibitor)、si CircITGB6+inhibitor NC组(共转染si CircITGB6、inhibitor NC),转染采用Lipofectamine TM 2000试剂。转染48h后,各组均加入2 μg/mL的DDP处理24h,随后进行各指标分析。
1.3.3CCK-8法检测细胞增殖及耐药性:将SKOV3/DDP接种到96孔板(1×103/孔),按照1.3.2中进行分组处理,向每孔中加入10μL CCK-8溶液,在37℃孵育2h后,使用酶标仪在450nm处测量每个孔的吸光度,计算细胞增殖率。耐药性检测:以0、2、4、8、16、32、64μg/L DDP溶液(100μL/孔)分别加入到各组细胞[10],培养48h后,采用CCK-8法检测细胞增殖活性,计算细胞增殖抑制率,分析各组细胞药物半数抑制浓度(IC50)值。
1.3.4流式细胞术检测细胞凋亡:SKOV3/DDP细胞以1×106密度接种到24孔板中,并用磷酸盐缓冲溶液(PBS)洗涤两次。然后将细胞悬浮在500μL结合缓冲液中,室温下加5μL膜联蛋白V-FITC和10μL PI在黑暗中染色5min。流式细胞仪分析细胞凋亡变化。
1.3.5双荧光素酶实验验证miR-542-3p与CircITGB6、PCNA的靶向关系:分别将CircITGB6、PCNA与miR-542-3p mimics基因结合片段插入到荧光素酶pGL4载体中,构建CircITGB6、PCNA野生型质粒(CircITGB6-WT、PCNA-WT);利用基因突变技术构建CircITGB6、PCNA突变型质粒(CircITGB6-MT、PCNA-MT),之后将CircITGB6-WT、PCNA-WT及CircITGB6-MT、PCNA-MT分别与miR-542-3p mimics、mimics NC共转染到SKOV3/DDP细胞,24h后测定细胞的荧光素酶活性,实验重复3次。
1.3.6Western blot检测相关蛋白表达水平:使用RIPA裂解液提取各组细胞总蛋白质并测定其浓度。蛋白质通过SDS-PAGE分离并转移到PVDF膜上,将膜与Bax、Ki-67、PCNA、β-actin一抗(1∶1000)共同孵育,洗涤后,与二抗(1∶2000)共同孵育,显影,分析各蛋白含量。
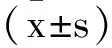
2 结 果
2.1OC组织及细胞中CircITGB6、miR-542-3p、PCNA mRNA表达水平比较:与正常卵巢组织相比,OC组织CircITGB6、PCNA mRNA表达显著增加(P<0.05),miR-542-3p表达显著降低(P<0.05),见表1。与IOSE-80相比,SKOV3、SKOV3/DDP细胞CircITGB6、PCNA mRNA表达显著增加,但miR-542-3p表达显著降低(P<0.05);与SKOV3相比,SKOV3/DDP细胞CircITGB6、PCNA mRNA表达显著增加,但miR-542-3p表达显著降低(P<0.05),见表2。

表1 OC组织中CircITGB6 miR-542-3p PCNA mRNA表达水平

表2 不同OC细胞中CircITGB6、miR-542-3p PCNA mRNA表达水平
2.2各组SKOV3/DDP细胞增殖率变化:与对照组、si NC组比较,si CircITGB6组SKOV3/DDP细胞增殖率显著降低(P<0.05);与si CircITGB6+inhibitor NC组比较,si CircITGB6+miR-542-3p inhibitor组SKOV3/DDP细胞增殖率显著增加(P<0.05),见表3。

表3 各组SKOV3/DDP细胞增殖率变化
2.3各组SKOV3/DDP细胞对DDP耐药性的影响:与对照组、si NC组比较,si CircITGB6组IC50值显著降低(P<0.05);与si CircITGB6+inhibitor NC组比较,si CircITGB6+miR-542-3p inhibitor组IC50值显著增加(P<0.05),见表4。

表4 各组SKOV3/DDP细胞对DDP耐药性的比较
2.4各组SKOV3/DDP细胞凋亡率变化:与对照组、si NC组比较,si CircITGB6组凋亡率显著增加(P<0.05);与si CircITGB6+inhibitor NC组比较,si CircITGB6+miR-542-3p inhibitor组凋亡率显著降低(P<0.05),见图1、表5。
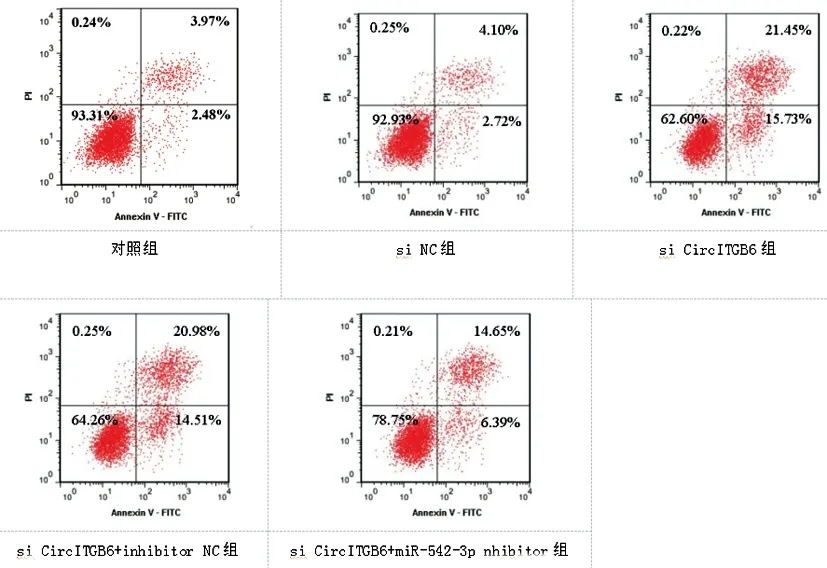
图1 各组SKOV3/DDP细胞凋亡变化

表5 各组SKOV3/DDP细胞凋亡率的比较
2.5各组SKOV3/DDP细胞中CircITGB6、miR-542-3p、PCNA mRNA的表达水平比较:与对照组、si NC组比较,si CircITGB6组CircITGB6、PCNA mRNA表达水平显著降低(P<0.05),miR-542-3p表达水平显著增加(P<0.05);与si CircITGB6+inhibitor NC组比较,si CircITGB6+miR-542-3p inhibitor组miR-542-3p表达水平显著降低(P<0.05),PCNA mRNA表达水平显著增加(P<0.05),CircITGB6无统计学差异(P>0.05),见表6。

表6 各组SKOV3/DDP细胞CircITGB6 miR-542-3p PCNA mRNA的表达比较
2.6验证miR-542-3p与CircITGB6的靶向关系:Starbase数据库显示miR-542-3p与CircITGB6存在结合位点,如图2。荧光素酶活性比较:CircITGB6 WT+miR-542-3p mimics组较CircITGB6 WT+mimics NC组降低(P<0.05),见表7。

图2 数据库预测miR-542-3p与CircITGB6的结合位点

表7 miR-542-3p与CircITGB6的靶向关系验证
2.7验证miR-542-3p与PCNA的靶向关系:Starbase数据库显示miR-542-3p与PCNA存在结合位点,如图3。荧光素酶活性比较:PCNA WT+miR-542-3p mimics组较PCNA WT+mimics NC组降低(P<0.05),见表8。

图3 数据库预测miR-542-3p与PCNA的结合位点

表8 miR-542-3p与PCNA的靶向关系验证
2.8各组SKOV3/DDP细胞中Ki-67、PCNA、Bax蛋白表达水平比较:与对照组、si NC组比较,si CircITGB6组Ki-67、PCNA蛋白水平显著降低(P<0.05),Bax蛋白水平显著增加(P<0.05);与si CircITGB6+inhibitor NC组比较,si CircITGB6+miR-542-3p inhibitor组Ki-67、PCNA蛋白水平显著增加(P<0.05),Bax蛋白水平显著降低(P<0.05),见图4,表9。

图4 各组SKOV3/DDP细胞中Bax、Ki-67、PCNA蛋白表达(Western blot图)

表9 各组SKOV3/DDP细胞中Bax Ki-67 PCNA表达的比较
3 讨 论
据统计,超过70%的OC患者最终出现复发和转移,其高死亡率和复发率的主要原因是缺乏高敏感性、特异性的早期诊断技术以及长期有效的治疗方案[8]。因此寻找有效的治疗靶点已成为近年来OC治疗领域的一个焦点。
DDP被广泛用作OC的有效一线治疗选择,DDP耐药显著影响卵巢癌患者的生存率。研究表明,circRNAs在OC肿瘤组织的化疗耐药和化疗敏感中差异表达,参与OC化疗耐药的发展[9]。circITGB6作为一种新发现的circRNA,已有研究发现circITGB6表达在OC组织以及具有化疗耐药性的OC患者血清中明显增加[5]。本研究发现OC患者癌组织及SKOV3/DDP中CircITGB6表达上调,推测CircITGB6可能与OC中DDP耐药性有关。为了验证此推测,本研究采用小分子干扰技术敲低CircITGB6表达,结果显示,干扰CircITGB6后,SKOV3/DDP细胞增殖率及IC50、Ki-67表达显著降低,凋亡率及Bax表达增加,提示干扰CircITGB6可能会降低细胞对DDP的耐药性,CircITGB6可作为OC中DDP耐药的潜在干预靶点。
circRNAs可以通过调控miRNAs发挥ceRNA的作用[8]。为了明确CircITGB6的作用机制,本研究采用StarBase生物信息学预测了CircITGB6的靶miRNA,结果显示CircITGB6与miR-542-3p存在靶向结合位点,本研究通过双荧光素酶实验验证了两者的靶向关系。miR-542-3p在多项研究中被证实是一种肿瘤抑制因子,如miR-542-3p的表达在骨肉瘤组织和细胞系中显著降低,上调miR-542-3p的表达可以抑制细胞增殖并诱导细胞凋亡[10]。circ_PGAM1通过抑制miR-542-3p的表达促进上皮性卵巢癌的恶性进展[11]。本研究发现OC组织及SKOV3/DDP细胞中miR-542-3p表达被抑制,与之前报道结果吻合[6]。干扰CircITGB6后,miR-542-3p表达上调,提示CircITGB6可能通过靶向负调控miR-542-3p进而降低SKOV3/DDP细胞对DDP的耐药性。为验证该结论,本研究在干扰CircITGB6表达的基础上,采用miR-542-3p inhibitor下调miR-542-3p表达进行回复验证,结果发现miR-542-3p inhibitor逆转了干扰CircITGB6对SKOV3/DDP细胞恶性行为的抑制。提示干扰CircITGB6可能通过靶向上调miR-542-3p表达,增强SKOV3/DDP细胞对DDP的敏感性。
细胞增殖能力是癌症诊断中重要的预后生物标志物,PCNA被认为是增殖和DNA复制的标志。研究显示,PCNA参与DDP耐药[12];且PCNA的高表达与OC的发生、发展、侵袭和转移具有相关性[7]。StarBase数据库预测显示miR-542-3p具有PCNA mRNA结合位点,双荧光素酶实验验证了PCNA为miR-542-3p的靶标,本研究发现PCNA在OC组织及SKOV3/DDP中上调,miR-542-3p可靶向负调控PCNA表达,提示CircITGB6可能是通过上调miR-542-3p,抑制PCNA表达降低SKOV3/DDP细胞对DDP的耐药性。综上所述,干扰CircITGB6表达可通过调节miR-542-3p/PCNA轴降低SKOV3对DDP的耐药性,成为治疗OC的潜在靶点。

